CCINP Chimie 2 PC 2012
| Thème de l'épreuve | La chimie du fer. Synthèse d'un dérivé de l'acide berkelique. |
| Principaux outils utilisés | diagrammes d'orbitales moléculaires, diagrammes d'Ellingham, solutions aqueuses, chimie organique, cinétique chimique |
| Mots clefs | acide berkelique, fer |
Corrigé
: 👈 gratuite pour tous les corrigés si tu crées un compte👈 l'accès aux indications de tous les corrigés ne coûte que 5 € ⬅ clique ici
👈 gratuite pour tous les corrigés si tu crées un compte
- - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - -
Énoncé complet
(télécharger le PDF)











Rapport du jury
(télécharger le PDF)






Énoncé obtenu par reconnaissance optique des caractères
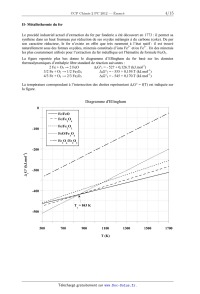
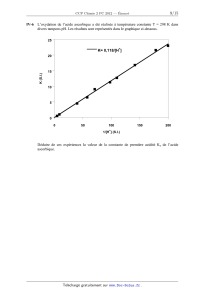
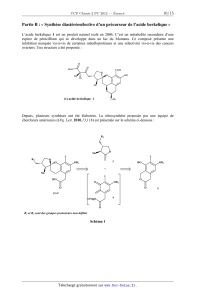
SESSION 2012 PCCH209 EPREUVE SPECIFIQUE - FILIERE PC ____________________ CHIMIE 2 Durée : 4 heures ____________________ N.B. : Le candidat attachera la plus grande importance à la clarté, à la précision et à la concision de la rédaction. Si un candidat est amené à repérer ce qui peut lui sembler être une erreur d'énoncé, il le signalera sur sa copie et devra poursuivre sa composition en expliquant les raisons des initiatives qu'il a été amené à prendre. ___________________________________________________________________________________ Les calculatrices sont interdites Les parties A et B sont indépendantes et dans chacune d'elles, un certain nombre de questions peuvent être traitées séparément. Toute démonstration illisible ou incompréhensible sera considérée comme fausse. Des données spectrales sont mentionnées en fin de sujet. 1/15 Tournez la page S.V.P. Partie A : « Autour de l'élément fer ». Le fer, qui fait partie de la famille des éléments de transition, est l'un des éléments les plus abondants sur terre ainsi que dans l'univers. Son omniprésence et ses propriétés remarquables sont ainsi responsables de l'importance qu'il peut jouer dans de nombreux processus biologiques. De plus, cet élément est abondamment exploité par l'homme, depuis que son extraction à partir de minerais est maîtrisée, c'est-à-dire depuis plus de 3000 ans. Cependant, son utilisation massive dans la société humaine remonte seulement à un peu plus de 200 ans avec la révolution industrielle, qui a accompagné de nombreux bouleversements de notre civilisation. I- Les ligands cyanate (CN) et carbonyle CO : poisons du fer pour le transport d'oxygène Le fer intervient en milieu biologique pour le transfert d'oxygène et donc la respiration cellulaire. Cependant, des ligands comme CO ou (CN) peuvent facilement substituer l'oxygène et bloquer ainsi l'oxygénation des cellules. La compréhension des interactions fortes qu'induisent ces ligands nécessite de considérer leurs diagrammes d'orbitales moléculaires. Les numéros atomiques des différents éléments sont les suivants : Z(C) = 6 ; Z(N) = 7 ; Z(O) = 8 ; Z(Fe) = 26. I-1 a) Donner la configuration électronique de C, N, O, Fe2+ et Fe3+. b) Justifier la stabilité particulière de l'ion Fe3+ comparativement à Fe2+. c) Préciser les nombres quantiques n et des orbitales atomiques de valence pour l'ion Fe3+. I-2 Classer les 4 éléments C, N, O et Fe par ordre d'électronégativité croissante. I-3 Sur la copie, positionner l'énergie des orbitales atomiques de valence des éléments C, N, O sur des axes parallèles comme présentés ci-dessous en respectant leur ordre relatif. Justifier l'ordre des énergies relatives des orbitales atomiques de même type entre C, N et O. N O Energie des orbitales C I-4 a) Donner la formule de Lewis de CO. Est-elle en accord avec l'échelle des électronégativités ? b) En vous basant sur la formule de Lewis, représenter le moment dipolaire de CO en précisant la convention choisie. c) Donner la formule littérale de ce moment dipolaire : on notera d la distance entre les atomes de carbone et d'oxygène et e la valeur absolue de la charge de l'électron. 2/15 3/15 Tournez la page S.V.P. II- Métallothermie du fer Le procédé industriel actuel d'extraction du fer par fonderie a été découvert en 1773 : il permet sa synthèse dans un haut fourneau par réduction de ses oxydes mélangés à du carbone (coke). De par son caractère réducteur, le fer n'existe en effet que très rarement à l'état natif : il est trouvé naturellement sous des formes oxydées, minerais constitués d'ions Fe2+ et/ou Fe3+. Un des minerais les plus couramment utilisés pour l'extraction du fer métallique est l'hématite de formule Fe2O3. La figure reportée plus bas donne le diagramme d'Ellingham du fer basé sur les données thermodynamiques d'enthalpie libre standard de réaction suivantes : -1 2 Fe + O2 2 FeO rG°1 = - 527 + 0,126.T (kJ.mol ) -1 3/2 Fe + O2 1/2 Fe3O4 rG°2 = - 555 + 0,159.T (kJ.mol ) -1 4/3 Fe + O2 2/3 Fe2O3 rG°3 = - 545 + 0,170.T (kJ.mol ) La température correspondant à l'intersection des droites représentant la figure. rG° = f(T) est indiquée sur Diagramme d'Ellingham 0 Fe/FeO Fe/Fe O 3 Fe/Fe O -100 2 4 3 FeO/Fe O 3 4 Fe O /Fe O 3 4 2 3 -1 G° (kJ.mol ) r -200 -300 -400 T = 843 K e -500 500 700 900 1100 T (K) 4/15 1300 1500 1700 II-1 Sur l'exemple du couple Fe/FeO et en raisonnant en terme d'affinité chimique, préciser et justifier l'attribution des domaines de stabilité du réducteur et de l'oxydant par rapport à la droite d'Ellingham rG° = f(T). II-2 a) Justifier que l'oxyde FeO est instable dans un domaine de température qu'on précisera. Ecrire l'équilibre de dismutation de FeO correspondant. b) En déduire et construire l'allure graphique du diagramme qui précise les domaines de stabilité des différentes phases en fonction de la température pour T [500 K ; 1700 K]. Ce diagramme porte le nom de diagramme de Chaudron. II-3 Ecrire l'ensemble des équilibres chimiques possibles dans les différents domaines de température, pour T [500 K ; 1700 K], en faisant intervenir une seule mole de dioxygène dans les équations de réaction. Déterminer l'expression littérale de leurs enthalpies libres standard de réaction en fonction de rG°1, rG°2 et rG°3. II-4 Expliquer la méthode graphique qui permet, pour une pression partielle en dioxygène donnée P(O2), de déterminer le domaine de corrosion par voie sèche d'un métal. II-5 L'air peut être considéré comme un mélange de 80 % molaires de diazote et 20 % de dioxygène. On souhaite ici savoir si des conditions usuelles de « vide d'air » peuvent permettre de prévenir un barreau de fer de tout phénomène de corrosion. Pour cela deux situations de vide d'air peuvent être obtenues : un vide primaire de 3 Pa, avec une pompe à palettes et un vide secondaire plus poussé de 2.10-5 Pa, en utilisant une pompe à diffusion en complément de la pompe à palettes. Dans chacune des situations précédentes, dites si le barreau de fer peut être conservé et, si oui, dans quel domaine de température pour T [500 K ; 1700 K]. L'estimation des domaines de température se fera graphiquement à 100 K près en prenant R.ln(6.10-6) - 100 J.mol-1 et R.ln(4.10-11) - 200 J.mol-1. II-6 Les schémas ci-dessous décrivent des situations hypothétiques de corrosion sèche observées en surface du barreau de fer sous air à P0 = 1 bar. Préciser pour chacune d'entre elles si elles sont possibles ou pas et si oui dans quel domaine de température, en supposant l'ensemble des équilibres thermodynamiques satisfait. O2 O2 O2 O2 Fe2O3 FeO Fe3O4 Fe2O3 Fe3O4 Fe2O3 Fe2O3 Fe3O4 Fe Fe3O4 Fe FeO Fe n°1 Fe n°2 n°3 5/15 n°4 Tournez la page S.V.P. III- Chimie du fer et du cyanure en solution L'acide cyanhydrique, encore appelé acide prussique, possède une forte odeur d'amande. Il est soluble dans l'eau et extrêmement toxique puisque 50 mg suffisent à entraîner la mort d'un être humain. Sa base conjuguée, moins dangereuse, peut donner de nombreux complexes colorés et particulièrement stables, en particulier avec le fer. Rappelons qu'en milieu biologique, la formation de tels complexes bloque l'oxygénation des cellules. Cette partie envisage la préparation d'une solution aqueuse de complexes du fer et du cyanure. Selon le degré d'oxydation du fer, ces complexes trouvent de nombreuses applications : - avec le fer(II), ils sont utilisés en oenologie pour éliminer les traces de métaux des vins rosés et blancs, ou comme additif alimentaire (E536), notamment pour le sel de cuisine. - avec le fer(III), ils sont utilisés en photographie argentique comme affaiblisseur de l'image (teinte sépia) en exploitant ses propriétés oxydo-réductrices. Ces complexes peuvent également servir à la synthèse de pigments célèbres comme le bleu de Prusse, doté de propriétés complexantes très efficaces pour éliminer le césium 137, un élément radioactif, du corps humain. Le bleu de Prusse a ainsi pu être utilisé après des accidents nucléaires comme celui de Fukushima en 2011. Dans les conditions du problème, la pression totale est P = 1 bar, T = 298 K. Les solutions sont préparées sous atmosphère de diazote pour s'affranchir de la présence de dioxygène. On fournit les données suivantes : · Constante d'autoprotolyse de l'eau : pKe = 14 · Constante d'acidité de l'acide cyanhydrique : pKa = 9,3 · Produit de solubilité : · · Fe(OH)2 Fe(OH)3 pKs1 = 15 pKs2 = 38 Constante globale de formation de complexe : Fe(CN)64- Fe(CN)63- log( 1) = 24 log( 2) = 31 Potentiel standard d'oxydoréduction : Fe2+/Fe 0 E1 = - 0,44 V · Fe3+/Fe2+ 0 E2 = 0,77 V H+/H2 0 E3 = 0 V O2/H2O 0 E4 = 1,23 V Applications numériques : RTln10/F = 0,06 log(2) log(3) log(4) log(5) 0,3 0,5 0,6 0,7 6/15 Dissolution de KCN III-1 Donner la définition d'un acide et d'une base de Brönsted. A quelle condition un acide peutil être considéré comme fort dans l'eau ? III-2 Comment qualifier les propriétés acides d'une part et basiques d'autre part du couple HCN/CN- ? III-3 En supposant qu'une espèce A est négligeable devant une espèce B dès que [A] 10 [B], déterminer les domaines de pH de prédominance des ions H3O+ et HO-. Ces domaines de pH permettront de négliger l'autoprotolyse de l'eau devant les autres réactions chimiques dans le cas d'une solution d'acide ou de base. III-4 Calculer le nombre de moles n du sel KCN totalement soluble à dissoudre dans un litre d'eau pure pour obtenir une solution de pH = pKa. Comment s'appelle une telle solution et quelles sont ses propriétés ? III-5 On dissout à présent une quantité n0 = 5.10-2 mol de KCN dans un litre d'eau pure. Calculer le pH de la solution (solution S0). Vérifier l'ensemble des approximations et donner les concentrations de tous les ions en solution ainsi que [HCN]. Dissolution du fer III-6 Déterminer l'expression du potentiel standard d'oxydoréduction E50 du couple Fe3+/Fe en fonction de E10 et E20. On prendra comme résultat numérique E50 = - 0,04 V. III-7 Une attaque par l'acide chlorhydrique d'une quantité nFe = 1,0.10-3 mol de fer métallique est réalisée en milieu aqueux. On obtient 1 litre d'une solution (S1) jaune, de pH égal à 1, où le fer a été totalement dissous. a) Calculer le pH d'apparition des précipités d'hydroxydes de fer(II) et de fer(III) pour une concentration en espèce soluble CFe = 1,0.10-3 mol.L-1. Compte-tenu des domaines d'existence de ces précipités, que peut-on conclure sur la nature de l'espèce soluble majoritaire issue de la dissolution du fer métallique dans la solution (S1) ? b) Quelles réactions sont susceptibles de se produire lors de l'attaque du fer métallique par l'acide chlorhydrique (on écrira ces réactions pour une mole de fer) ? S'accompagnentt-elles d'un dégagement gazeux ? Si oui, préciser sa nature. c) On donne 0,44/0,03 = 14,7. Calculer les grandeurs pK associées aux constantes d'équilibre des réactions précédentes. En déduire l'espèce aqueuse majoritaire issue de la dissolution du fer métallique dans la solution (S1). III-8 La solution (S1) est portée à un pH de 11 sans variation de volume (solution (S2)) et perd sa coloration. Que peut-on dire de la concentration totale en espèce soluble du fer dans cette solution (S2) ? Sous quelle forme se trouve l'élément fer ? Mélange des solutions issues de KCN et du fer III-9 On ajoute progressivement à la solution précédente (S2), la solution cyanhydrique (S0) préparée au III-5. On obtient une solution (S3) jaune de volume final égal à 2 litres, exempte de tout précipité. a) Ecrire la réaction prépondérante qui se produit lors de ce mélange et calculer sa constante d'équilibre. Donner le nom de la nouvelle espèce soluble du fer formée (responsable de la coloration de la solution). 7/15 Tournez la page S.V.P. b) Déterminer le pH de la solution (S3). III-10 Déterminer l'expression du potentiel standard E60 du couple Fe(CN)63-/ Fe(CN)64-. Calculer et commenter sa valeur. IV- Cinétique chimique d'oxydation de l'acide ascorbique On étudie la cinétique d'oxydation de l'acide ascorbique (vitamine C) noté H2Asc en milieu acide par l'ion complexe Fe(CN)63-. La réaction globale s'écrit : 2 Fe(CN)63- + H2Asc = 2 Fe(CN)64- + Asc + 2 H+ Le mécanisme réactionnel proposé est le suivant : k1 + - H 2 Asc H + HAsc k-1 3- 6 k 2 Fe(CN) + HAsc Fe(CN) 64- + HAsc· - k 3 HAsc · H + + Asc ·- k-3 3- 6 k 4 Fe(CN) + Asc Fe(CN) 64- + Asc ·- IV-1 Justifier pourquoi la réaction globale précédente ne peut pas décrire un acte élémentaire. IV-2 Déterminer l'expression littérale de la constante de première acidité Ka de l'acide ascorbique en fonction des constantes de vitesse du problème. IV-3 En appliquant l'approximation de l'état quasi-stationnaire (AEQS) à HAsc· et Asc·-, exprimer la loi de vitesse de la réaction d'oxydation de l'acide ascorbique en fonction notamment des espèces Fe(CN)63-, H2Asc et H+. IV-4 Diverses expériences menées à un pH imposé ont conduit à une loi expérimentale du type = K[Fe(CN)63-][H2Asc]. Indiquer les conditions opératoires qui permettent d'obtenir une loi expérimentale de cette forme. Dans ces conditions, donner l'expression littérale de K. IV-5 La constante k2 a été déterminée à diverses températures. Les valeurs sont reportées dans le tableau ci-dessous. T(K) 293 298 303 k2 (S.I.) 8,6.102 10,0.102 11,6.102 Quelle est l'unité de k2 dans le système international SI ? De quelle loi, dont on précisera l'expression générale et les grandeurs caractéristiques, témoignent vraisemblablement les évolutions constatées ? 8/15 L'oxydation de l'acide ascorbique a été réalisée à température constante T = 298 K dans divers tampons pH. Les résultats sont représentés dans le graphique ci-dessous. 25 + K= 0,118/[H ] 20 K (S.I.) IV-6 15 10 5 0 0 50 100 150 200 + 1/[H ] (S.I.) Déduire de ces expériences la valeur de la constante de première acidité Ka de l'acide ascorbique. 9/15 Tournez la page S.V.P. Partie B : « Synthèse diastéréosélective d'un précurseur de l'acide berkelique » L'acide berkelique 1 est un produit naturel isolé en 2006. C'est un métabolite secondaire d'une espèce de pénicillium qui se développe dans un lac du Montana. Ce composé présente une inhibition marquée vis-à-vis de certaines métalloprotéases et une sélectivité vis-à-vis des cancers ovariens. Une structure a été proposée : O O MeO CO2H O O Me OH Et Me O (±)-acide berkelique 1 C5H11 Depuis, plusieurs synthèses ont été élaborées. La rétrosynthèse proposée par une équipe de chercheurs américains (Org. Lett. 2010,13,118) est présentée sur le schéma ci-dessous : R2 O Me I R2 I O O 3 OR1 HO OR1 + Me I HO O O OR1 O O (±)-2 4 ClMgO O R1 et R2 sont des groupes protecteurs non définis Schéma 1 10/15 5 I- Synthèse de l'éther d'énol 3 L'éther d'énol 3 est préparé en 7 étapes à partir de la cyclopropyllactone 6 (une lactone est un ester cyclique) (Schéma 2, schéma 3). A une solution de 6 dans le diméthylformamide (DMF) est ajouté le cyanure de sodium, NaCN. La solution obtenue est chauffée à 50 °C pendant une nuit puis hydrolysée par une solution de NH4Cl 1 mol.L-1 et extraite par de l'acétate d'éthyle. Le solvant est évaporé et la cyanolactone brute 7 obtenue est méthylée (Schéma 2). Y NC O NC NaCN, DMF O O ? HCl, AcOH O 60 °C,96 % 50 °C, 75% MeO Me MeO Me O O MeO A O O O O O 6 7 8 9 Schéma 2 I-1 Donner la formule de Lewis de l'ion cyanure CN-. Quel est le site nucléophile de cet ion ? I-2 Préciser les réactifs nécessaires à la transformation de 7 en 8. Ecrire le mécanisme de la réaction. Justifier la régiochimie de la réaction. Donner le nom des fonctions présentes dans le composé 8. La lactone 8, en solution dans l'acide acétique (AcOH), est traitée par HCl concentré et la solution obtenue est chauffée à 60 °C pendant une nuit. Après hydrolyse et extraction par l'acétate d'éthyle, le solvant est évaporé. Les traces d'acide acétique contenues dans le produit brut 9 sont éliminées par distillation azéotropique avec du toluène. L'évaporation du solvant fournit 9, qui est transformé en 4 étapes en éther d'énol 3. Chaque étape de la synthèse de l'éther d'énol est suivie par chromatographie sur couche mince (CCM) (Schéma 3). HO Y O Me RO ? 2 protection 1 O Me O Me O 9 RO 4 3 ? O 3 Me O O 10 11 12 Schéma 3 I-3 Les deux groupes fonctionnels acycliques du composé 8 subissent un ensemble de transformations par action de HCl/AcOH suivie d'un léger chauffage. Donner le nom de ces transformations et représenter l'intermédiaire formé A. I-4 En raisonnant par analogie avec la synthèse malonique, proposer un mécanisme justifiant la formation du composé 9 à partir de l'intermédiaire A. I-5 Rappeler le principe de la distillation azéotropique à minimum de température à l'aide d'un schéma. Quels avantages présente-t-elle par rapport à une simple distillation ? 11/15 Tournez la page S.V.P. I-6 Quel type de réaction est mis en jeu dans la transformation de 9 en 10 ? Proposer un réactif pour ce type de réaction. Quelle autre fonction peut être transformée dans ces conditions ? I-7 Proposer un réactif pour former 12 à partir de 11. Ecrire l'équation-bilan de la réaction. Quelle est la force motrice de la réaction ? I-8 Rappeler le principe de la chromatographie sur couche mince. Quels avantages présente cette technique pour le suivi d'une réaction ? I-9 Les principales bandes des spectres infrarouge des composés formés, enregistrés dans le dichlorométhane CH2Cl2, sont présentées dans le Tableau 1. composé (cm-1) 7 2985, 2249, 1782, 1732 10 3423, 2970, 2933, 1770 Tableau 1 Attribuer chacune des valeurs aux bandes correspondantes. Sont-elles en accord avec les structures des différents composés ? I-10 Donner la configuration absolue des atomes de carbone asymétriques du composé 10 en justifiant (utiliser la numérotation proposée). II- Synthèse de l'énantiomère 6' de la cyclopropyllactone 6 La stéréochimie de l'acide berkelique n'étant pas complètement déterminée lors de sa synthèse, les auteurs préparent l'énantiomère 6' de la cyclopropyllactone 6 pour obtenir l'énantiomère de l'éther d'énol 3. L'énantiomère 6' est synthétisé à partir de la (R)-épichlorohydrine, elle-même obtenue en plusieurs étapes à partir d'un sucre, le (+)-D-mannitol (représenté sous forme ouverte dans le Schéma 4). Le (+)-D-mannitol, en solution dans le 1,2-diméthoxyéthane (glyme), est traité par le 2,2-diméthoxypropane, notée B, en présence de chlorure d'étain (SnCl2) à reflux. Après évaporation du solvant, le résidu 13 est mis en solution dans le tétrahydrofurane (THF), puis traité par un réactif analogue au periodate de sodium (NaIO4) pour conduire à la formation de l'intermédiaire C. Le mélange, après filtration, est ajouté goutte à goutte à une solution aqueuse de borohydrure de sodium (NaBH4). Après traitements classiques et distillation, le (+)-(S)-2,2-diméthyl-1,3-dioxolane4-méthanol, 14, est obtenu. Trois étapes, non décrites, conduisent à la (R)-épichlorohydrine (Schéma 4). HO O HO O HO B OH OH OH (+)-D-mannitol HO Cl HO SnCl2, glyme, reflux NaIO4 OH THF, 0 °C NaBH3 C O O O H2O, 4 % NaOH O H O 13 14 Schéma 4 12/15 (R)-épichlorohydrine II-1 Représenter la molécule de 1,2-diméthoxyéthane. Quelles sont les propriétés de ce solvant ? Proposer une explication pour l'utilisation de ce solvant. II-2 Quelle est la fonction présente dans le 2,2-diméthoxypropane B ? Préciser les conditions expérimentales et les réactifs nécessaires pour obtenir le composé B. Ecrire le mécanisme de la réaction. Donner son nom. II-3 En vous inspirant du mécanisme précédent, expliquer le rôle de SnCl2 dans la transformation du (+)-D-mannitol en composé 13. Quel est l'intérêt de cette étape ? II-4 Représenter l'intermédiaire C obtenu après action de NaIO4. Quel est le rôle de NaBH4 dans l'étape suivante ? La (R)-épichlorohydrine est transformée en cyclopropyllactone 6'. Le sodium est ajouté au méthanol absolu sous azote, refroidi à 0 °C. Le malonate de diméthyle est ajouté à température ambiante puis la (R)-épichlorohydrine est additionnée goutte à goutte en agitant vigoureusement. Le mélange obtenu est chauffé au reflux. La suspension après refroidissement est filtrée. L'énantiomère 6' est obtenu après extraction à l'éther et purification par chromatographie (schéma 5). Cl H CO2Me Na, MeOH O CO2Me + O 6' CO2Me CO2Me reflux (R)-épichlorohydrine D Schéma 5 II-5 Qu'appelle-t-on méthanol absolu ? Ecrire l'équation-bilan de l'action du sodium sur le méthanol absolu. II-6 Quels sont les trois sites d'attaque nucléophile de l'épichlorohydrine ? Proposer un mécanisme pour la formation de l'intermédiaire D. II-7 Représenter la formule spatiale de 6'. Ecrire le mécanisme de sa formation à partir de D. III- Synthèses de l'isochromanone 5 et du précurseur 2 L'isochromanone 5 est préparée à partir du 3-oxopentanedioate de diéthyle. L'action du sodium dans le méthanol absolu, suivi d'un traitement à la soude à 10 % puis addition d'acide sulfurique concentré conduit au composé 15. Il est transformé en 3 étapes en composé 16 qui conduit à l'isochromanone 5 en deux étapes (Schéma 6). 13/15 Tournez la page S.V.P. I EtO HO O O OH I H(e)O OR1 1- Na, MeOH, 140 °C; NaOH, 10 % 1O H(a) 2-H2SO4 Cé OMe + 3-H , MeOH H(d) H(b) O 3-oxopentanedioate de diéthyle HO OR1 2-HCl 2M OCH3(f) O H(c) O EtO ? O 15 O 5 16 Schéma 6 III-1 A quel type d'hydrocarbure appartient le cycle formé dans le composé 15 ? Justifier. III-2 Justifier la différence d'acidité entre le phénol [C6H5OH, pKa = 9,9] et le cyclohexanol [C6H11OH, pKa = 18]. III-3 Quel(s) produit(s) est (sont) formé(s) par action du chlorométhane en présence d'un catalyseur sur le phénol ? Justifier en explicitant le mécanisme. Quel catalyseur est nécessaire ? Donner le nom de cette réaction. III-4 Représenter le produit obtenu lors d'un traitement identique du résorcinol, en justifiant. HO OH résorcinol III-5 Le spectre RMN (Résonance Magnétique Nucléaire) 1H (400 MHz) enregistré dans CDCl3 (chloroforme deutéré) du composé 16 présente les signaux suivants (Tableau 2) : (ppm) Multiplicité Intégration 3,71 Singulet 3H 3,88 Singulet 2H 6,43 Singulet 1H 10,00 Singulet 1H 13,21 Singulet 1H ppm = partie par million Tableau 2 Attribuer chacun des protons du composé 16 aux signaux correspondants en justifiant la multiplicité (présenter impérativement les résultats sous forme de tableau en utilisant les notations du schéma 6). III-6 Quel est le nom de la fonction formée dans le composé 5 ? Proposer un réactif pour la 1ère étape de la transformation de 16 en 5. Quel est le rôle de HCl dans la 2ème étape ? 14/15 L'action du chlorure de t-butylmagnésium dans le THF (tétrahydrofuranne) à - 78 °C sur l'isochromanone 5 forme un intermédiaire non isolé 4 sur lequel réagit l'éther d'énol 3 pour conduire au précurseur 2 de l'acide berkelique (Schéma 7). R2 I I HO OR1 1- O OR1 O Me 3 t-BuMgCl, THF - 78 °C à TA O Et2O O 2 2- H2O ClMgO O 5 4 Schéma 7 III-7 Quelles sont les propriétés du chlorure de t-butylmagnésium ? III-8 Quel est le produit attendu lors de l'action du chlorure de t-butylmagnésium sur un ester de type R-COOEt ? Préciser le schéma réactionnel. III-9 Le produit obtenu dans ce cas est en réalité l'intermédiaire 4. Proposer un mécanisme pour expliquer sa formation à partir du composé 5. III-10 Représenter le schéma mécanistique expliquant la formation du composé 2 à partir des composés 3 et 4. Donner le nom de cette réaction. Données spectrales RMN 1H : gamme de déplacements chimiques protons CH3-C- -CH2-CH2- -CH2-CO- R-COOCH- C-H arom R-CHO PhO-H (ppm) 0,9 - 1,3 1,55 - 2,10 2,0 - 3,0 3,5 - 4,5 8,0 - 6,0 11,0 - 9,0 14,0 - 8,0 INFRAROUGE : nombre d'onde de vibration de quelques groupes fonctionnels groupes fonctionnels (cm-1) C RO-H alcool RCOO-H acide C-H alcane 3200 - 3650 2500 - 3300 2800 - 2970 N nitrile C=O cétone 2220 - 2260 1705 - 1725 Fin de l'énoncé. 15/15 C=O ester saturé C=O lactone 1730 - 1750 1735 - 1800