Centrale Chimie PC 2020
| Thème de l'épreuve | Biomimétisme |
| Principaux outils utilisés | solutions aqueuses, cinétique chimique, chimie organique |
| Mots clefs | catalyseur bifonctionnel, hydroxypyridine, mutarotation, catalyse, résorcinarène, ITC, titrage calorimétrique isotherme, biomimétisme, acétonitrile, chime supramoléculaire |
Corrigé
: 👈 gratuite pour tous les corrigés si tu crées un compte👈 l'accès aux indications de tous les corrigés ne coûte que 5 € ⬅ clique ici
👈 gratuite pour tous les corrigés si tu crées un compte
- - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - -
Énoncé complet
(télécharger le PDF)







Rapport du jury
(télécharger le PDF)



Énoncé obtenu par reconnaissance optique des caractères
Chimie
PC
CONCOURS CENTRALE-SUPÉLEC 4 heures Calculatrice autorisée
2020
Biomimétisme
Sous le terme biomimétisme sont regroupées toutes les ingénieries inspirées du
vivant. Il ne s'agit pas de copier le
vivant mais bien de s'inspirer des solutions inventées par la nature et
sélectionnées au cours de milliards d'années
d'évolution, et d'en transposer les principes ou processus. Pour relever les
défis liés à la transition écologique et
énergétique et réduire les coûts environnementaux, les chimistes mettent au
point des alternatives aux processus
industriels actuellement utilisés en concevant, par exemple, des catalyseurs
bio-inspirés. À partir d'une réaction
catalysée par une enzyme, les chercheurs déterminent le site actif de l'enzyme
où a lieu la transformation, leur
l'objectif étant d'en reproduire les propriétés exceptionnelles, telles que la
sélectivité et l'efficacité. Par exemple,
le site actif des métalloenzymes, comme les hydrogénases capables de
transformer de l'eau en dihydrogène,
est constitué d'un ou plusieurs ions métalliques et d'un environnement chimique
spécifique à sa réactivité. Le
chimiste va utiliser ses outils de synthèse pour élaborer un environnement
chimique (en général des ligands)
autour des mêmes ions métalliques pour reproduire le plus fidèlement possible
la réactivité du site actif de
l'enzyme.
Ce sujet comporte deux parties indépendantes. La première porte sur l'étude
d'un catalyseur bifonctionnel,
analogue de certaines enzymes, la 2-hydroxypyridine. La seconde s'intéresse à
l'hydratation de l'acétonitrile
catalysée par un complexe du zinc, inspiré de métallo-enzymes produites par
certaines bactéries.
Certaines questions, peu ou pas guidées, demandent de l'initiative de la part
du candidat. Il est alors demandé
d'expliciter clairement la démarche, les hypothèses et de les illustrer, le cas
échéant, par un(des) schéma(s).
Toute démarche engagée, même non aboutie, et toute prise d'initiative seront
valorisées. Le barème prend en
compte le temps nécessaire à la résolution de ces questions.
Ce texte et accompagné d'un document réponse à rendre avec la copie. Les
données utiles sont regroupées dans
ce document.
I Étude d'un catalyseur bifonctionnel
L'objectif de cette partie est d'étudier les caractéristiques de la
2-hydroxypyridine (écrite de manière simplifiée
HP), catalyseur bifonctionnel dont l'activité catalytique est très proche de
celle des enzymes.
K OH
A ù
Figure 1 Formule de la 2-hydroxypyridine
Les catalyseurs bifonctionnels agissent sur le substrat par deux de leurs sites
en relation tautomérique et de
façon concertée. Leur activité catalytique, plus importante que celle des
catalyseurs monofonctionnels, peut être
attribuée à la capacité à échanger leur proton sans former d'ion dipolaire de
haute énergie. La 2-hydroxypyridine,
est un exemple de catalyseur bifonctionnel dont l'activité catalytique a été
très largement étudiée dans de
nombreuses réactions, en particulier la mutarotation du
2,3,4,6-tétraméthyl-D-glucopyrannose (TMG), substrat
dérivé du glucose, et certaines substitutions nucléophiles.
Cette partie débute par une étude cinétique de la mutarotation du glucose, avec
ou sans catalyse acido-basique,
puis se prolonge par celle de la mutarotation du TMG en présence de catalyseurs
acide et basique monofonc-
tionnels et du catalyseur bifonctionnel HP. Elle s'achève par une substitution
nucléophile aromatique du fluor
par la pipéridine catalysée par l'HP.
I.A -- Étude cinétique de la mutarotation du glucose, avec ou sans catalyse
La forme ouverte du D-glucose est représentée figure 2.
En réalité, le glucose existe très majoritairement sous forme hémiacétal
cyclique, nommé D-glucopyrannose, cet
hétérocycle comportant six chainons.
L.A.1) Hémiacétalisation du D-glucose
Q 1. Écrire, en catalyse acide, le mécanisme de l'hémiacétalisation du
D-glucose.
Q 2. Représenter la structure plane de la forme cyclique du D-glucopyrannose
produit lors de cette hémia-
cétalisation.
2020-04-30 07:46:17 Page 1/12 CHE
Figure 2 Forme ouverte du D-glucose
Q 3. Ce D-glucopyrannose existe sous forme de deux stéréoisomères de
configuration : l'a-D-glucopyrannose
et le 5-D-glucopyrannose. Représenter ces deux stéréoisomères en adoptant pour
le cycle une conformation chaise.
Q 4. Le 5-D-glucopyrannose est la forme la plus stable. Identifier cette forme
parmi ces deux stéréoisomères.
I.A.2) Équilibre entre les deux stéréoisomères cycliques du D-glucose
Les pouvoirs rotatoires spécifiques des deux stéréoisomères dans l'eau à 25 °C
et à la longueur d'onde À = 589 nm
sont respectivement [a], = 112°-g l.em°-dm ! pour le a-D-glucopyrannose et {al
8 = 18.7°-8 l.cm°-.dm !
pour le 5-D-glucopyrannose. Lorsqu'on introduit une solution aqueuse
fraichement préparée contenant du
a-D-glucopyrannose à la concentration de 0,1 g-cm * à 25 °C dans la cuve de
largeur 2 dm d'un polarimètre, on
constate que le pouvoir rotatoire de la solution diminue progressivement
jusqu'à atteindre la valeur constante
de 10,5°. Inversement, si on réitère la même expérience dans les mêmes
conditions en remplaçant au départ
l'a-D-glucopyrannose par le 5-D-glucopyrannose, on constate que le pouvoir
rotatoire de la solution augmente
jusqu'à atteindre 10,5°.
Q 5. Déterminer la valeur de la constante thermodynamique d'équilibre associée
à la réaction d'équation
a-D-glucopyrannose = 5-D-glucopyrannose
On pourra négliger la quantité de D-glucose présente sous forme ouverte.
I.A.3) Étude cinétique de la mutarotation du glucose
Des mesures d'évolution temporelle du pouvoir rotatoire permettent l'étude
cinétique de la réaction précédente
qui peut être modélisée au niveau microscopique par deux actes élémentaires,
l'un dans le sens direct de constante
vi inv vi _1.
de vitesse k, et l'autre dans le sens inverse de constante de vitesse k_,
k_;
a-D-glucopyrannose -- 6-D-glucopyrannose
k
On effectue des mesures, à différentes dates {, du pouvoir rotatoire a d'une
solution aqueuse comportant ini-
tialement de l'a-D-glucopyrannose à la concentration de 0,182 g-cm *, placée
dans une cuve de largeur 2 dm,
maintenue à la température de 25 °C. Les résultats sont consignés dans le
tableau 1.
t (s) 120 240 300 370 520 650 850 1020 | 3600
a (°) 34,5 30.6 28.9 27.4 24.6 23.3 21,4 20,5 19,0
Tableau 1 Pouvoir rotatoire de la solution aqueuse comportant
initialement de l'a-D-glucopyrannose à la concentration de 0,182 g-cm *
Q 6. Déduire, de ces résultats expérimentaux, les valeurs des constantes de
vitesse k, et k£_.. Ces valeurs
sont-elles compatibles avec la valeur obtenue à la question 5 ?
I.A.4) Catalyse acido-basique de la mutarotation du glucose
En solution aqueuse, la réaction est très sensible à l'action catalytique des
ions oxonium H;,07 et hydroxyde
HO. En partant du a-D-glucopyrannose, l'état d'équilibre est atteint avec une
loi de vitesse du premier ordre,
la constante de vitesse k s'exprimant sous la forme
k -- ko + k, [H30*] + k,,(HO°|
où ko, k, et k,, sont des constantes dépendant seulement de la température et
[H30*] et [HOT] représentent la
concentration molaire des ions correspondants.
Q 7. Interpréter chacun des termes de l'expression de la constante de vitesse k.
Q 8. Montrer que la constante de vitesse Æ passe par une valeur minimale pour
une certaine valeur du pH
dont on donnera l'expression littérale et interpréter l'existence de ce minimum.
I.B --- Propriétés acido-basiques et forme tautomère de la 2-hydroxypyridine
La 2-hydroxypyridine est une base 10% fois plus faible que la pyridine et un
acide 10° fois plus faible que le
phénol.
2020-04-30 07:46:17 Page 2/12 CJEXES
Q 9. Déterminer, selon la valeur du pH, les formes acido-basiques prédominantes
de la 2-hydroxypyridine
en solution aqueuse. Présenter la réponse sur un axe gradué en pH.
La 2-hydroxypyridine (ou forme lactime), représentée figure 1 et notée La,
présente un équilibre de tautomérie
avec une forme lactame (ou amide cyclique), la 2-pyridone, notée 1b. De
nombreuses études de l'équilibre
de tautomérie ont été effectuées, par diverses techniques d'analyse dont les
spectrophotométries infrarouge et
ultraviolette. L'analyse montre que la 2-hydroxypyridine 1 existe
majoritairement en phase gazeuse sous la
forme lactime 1a, le rapport entre les formes lactime La et lactame 1b étant de
2,5/1. En solution, la constante
d'équilibre de tautomérie entre la forme lactime la et la forme lactame 1b est
estimée à 1000 dans l'eau et 10
dans le cyclohexane.
Q 10. Représenter la structure tautomère de la 2-hydroxypyridine, sous forme
lactame 1b.
Q 11. Déterminer, en phase gazeuse, la valeur de l'enthalpie standard de la
réaction 1a -- 1b. Peut-on, à
partir de cette valeur, justifier l'existence prédominante de la forme lactime
1a en phase gazeuse ? Argumenter.
L'équilibre de tautomérie de la 2-hydroxypyridine est étudié par
spectrophotométrie ultraviolette. Les spectres
d'absorption de différentes solutions sont enregistrés :
-- solution à 6,01 X 10° mol-L! de 2-hydroxypyridine 1 dans le chloroforme à
différentes températures com-
prises entre 5 et 45 °C :
-- solution de 2-méthoxypyridine 4 à 4,30 X 10° mol-L! dans le chloroforme à
une température de 25 °C :
-- solution de N-méthylpyridone 5 à 7,34 X 10° mol-L_! dans le chloroforme à
une température de 25 °C.
O
NT CH SA
N N
FT F7 CH,
Figure 3 Formules de la 2-méthoxypyridine 4 et de la N-méthylpyridone 5
Les résultats sont rassemblés figure 4.
0,0
250 300 350
Longueur d'onde (nm)
Figure 4 Spectre d'absorbance de la 2-hydroxypyridine 1, de la
2-méthoxypyridine 4 et de la
N-méthylpyridone 5. Les nombres figurant à proximité des spectres correspondent
à des maxima ; par
exemple l'espèce 4 présente deux bandes d'absorption de maxima 274 nm et 281 nm
Les formes rigides de la 2-méthoxypyridine 4 et N-méthylpyridone 5 servent de
modèles de référence respective-
ment pour la 2-hydroxypyridine et la 2-pyridone car leurs transitions
électroniques sont très proches.
Q 12. Interpréter ces résultats en termes d'équilibre de tautomérie dans le
chloroforme.
IC --- Activité catalytique bifonctionnelle de la 2-hydroxypyridine
En transformant en éthers méthyliques l'ensemble des fonctions alcools du
D-glucopyrannose, on obtient le
TMG (2,3,4,6-tétraméthyl-D-glucopyrannose) qui présente l'avantage d'être plus
soluble que le D-glucose dans
les solvants organiques.
La mutarotation du TMG, effectuée en solution benzénique à 25 °C, est catalysée
par les acides et les bases.
Une étude cinétique permet de comparer l'efficacité du phénol et de la
pyridine, pris comme catalyseurs, sur la
vitesse de mutarotation du TMG. Le pouvoir catalytique du mélange
pyridine-phénol a également été testé ct
confronté à celui de la 2-hydroxypyridine, notée HP. Les résultats obtenus pour
les constantes de vitesse Æ sont
données dans le tableau 2.
2020-04-30 07:46:17 Page 3/12 CETTE
OMe
HO OMe
OMe
Figure 5 Formule de la structure cyclique du TMG
[TMG] (molL 1) 0,09 | 0,09 | 0,09 | 0,09 | 0,091 | 0,091
[Phénol] (mol-L*) 0,1 0,1
[Pyridine| (mol-L--?) 0,1 0,1
HP] (mol.L-1) 0,000 99 | 0,099
106 & (5-1) 1,3 1,7 6,1 131 143 | 3000
Tableau 2 Valeurs des constantes de vitesse de mutarotation
du TMG pout différents catalyseurs et mélanges de catalyseurs
Q 13. Quelles propriétés du phénol d'une part et de la pyridine d'autre part
interviennent pour rendre
compte de leur effet catalytique dans la mutarotation du TMG.
Q 14. Proposer un mécanisme réactionnel rendant compte, dans la mutarotation du
TMG, de l'aspect concer-
té dans l'action du catalyseur bifonctionnel HP. On fera intervenir la forme
lactime sur la forme cyclique du
TMG.
Q 15. Interpréter, de manière précise, les résultats expérimentaux obtenus
pour les différents types de cata-
lyseurs.
ID --- Méthylation de la Z-hydroxzypyridine
Pour étudier l'activité catalytique de la 2-hydroxypyridine, il est d'abord
nécessaire de réaliser sa méthylation.
Selon les conditions opératoires utilisées pour la méthylation, deux produits
sont susceptibles de se former : la
2-méthoxypyridine ou la N-méthylpyridone. Pour analyser la régiosélectivité de
cette réaction, on étudie, dans
un premier temps, la C- et la O-méthylation des ions énolate.
I.D.1)
La méthylation de l'ion énolate dérivé de la propanone peut conduire à deux
isomères de constitution : la
butanone qui est le produit de C-alkylation (produit PC) et le produit de
O-alkylation (produit PO) dont la
formule topologique est donnée figure 6.
1
Figure 6 Produit PO
Alklyation des ions énolate
Q 16. Déterminer les deux sites nucléophiles de l'ion énolate issu de la
propanone qui justifient sa réactivité
nucléophile ambidente.
Q 17. Justifier la nature du produit majoritaire (PC ou PO) dans l'hypothèse
où la réaction d'alkylation est
sous contrôle orbitalaire. Comment pourrait-on interpréter la formation
majoritaire de l'autre produit ?
I.D.2)
Le protocole de la synthèse mis en oeuvre au laboratoire est décrit ci-après.
Dans un ballon de 50 mL, introduire 200 mg de HP (2,1 mmol), 580 mg de
carbonate d'argent, Ag, CO; (2,1 mmol),
ct 10 mL d'hexane (716,1 mmol). Ajouter deux millilitres d'iodométhanc et
adapter un réfrigérant. Agiter le
contenu du ballon à l'obscurité pendant 24 heures puis chauffer pendant
quelques minutes à 50 °C pour chasser
l'excès d'iodométhane. Filtrer le carbonate d'argent sur Büchner garni de
célite. Ajouter de l'eau et traiter trois
fois le milieu au dichlorométhane puis au sulfate de magnésium anhydre. Après
filtration et évaporation du
solvant, 43,5 mg de 2-méthoxypyridine (0,4 mmol) sont recucillis sous forme
d'un liquide incolore.
Q 18. Préciser le rôle de chaque espèce chimique présente dans le ballon.
Montrer que l'iodométhane est
introduit en excès.
Q 19.
Q 20.
Synthèse de la 2-méthoxypyridine
Expliquer le rôle des traitements au dichlorométhane et au sulfate de magnésium
anhydre.
Déterminer la valeur du rendement de synthèse de la 2-méthoxypyridine.
Commenter.
CIEL
2020-04-30 07:46:17
Page 4/12
L.D.3) Obtention de la Nméthylpyridone
Le traitement de l''HP par du sulfate de diméthyle, (CH;),S0,, en présence de
potasse, KOH, alcoolique conduit
majoritairement à la Mméthylpyridone.
Q 21. Expliquer la formation de la Nméthylpyridone.
LE - Étude cinétique d'une substitution nucléophile catalysée par la
2-hydroxypyridine
La réaction étudiée est la substitution nucléophile aromatique du fluor par la
pipéridine, notée Pip, sur le
2-fluoro-5-nitrobenzonitrile 3 dans le chloroforme à 25 °C. L'équation
modélisant la substitution est donnée
figure 7.
F
CN
N
+ ------+ + HF
CN
N
H
NO;
NO;
3 Pip 6
Figure 7 Substitution du fluor par la pipéridine
Cette réaction de substitution procède d'un mécanisme d'addition-élimination.
Deux mécanismes compétitifs
entrent simultanément en jeu : le premier (mécanisme À, figure 8) ne fait pas
intervenir le catalyseur HP,
contrairement au second (mécanisme B, figure 9). Les constantes de vitesses k;,
correspondent aux différents
actes élémentaires dont les molécularités sont indiquées. IR représente un
intermédiaire réactionnel.
F
CN
k. ko N
+ ------ IR --_---- + HE
k_; CN
N
H
NO;
NO,
Figure 8 Mécanisme À
F
CN
k
+ IR
k_;
N
H
NO;
K ka N K
IR + --_--_----+ + HF +
Lu CN DZ
N OH N OH
HP HP
NO;
Figure 9 Mécanisme B
2020-04-30 07:46:17 Page 5/12 CETTE
Q 22. Proposer une structure pour l'intermédiaire réactionnel IR, commun aux
deux mécanismes et obte-
nu par addition nucléophile de la pipéridine Pip sur le
2-fluoro-5-nitrobenzonitrile 3. Expliquer pourquoi les
substituants CN et NO, favorisent cette addition : on pourra écrire quelques
formules limites explicites de cet
intermédiaire pour argumenter.
Q 23. Montrer que, moyennant certaines hypothèses, la vitesse de cette réaction
s'exprime sous la forme
0 = kapp [3] [Pip]. On appliquera notamment l'approximation de l'état quasi
stationnaire à l'intermédiaire IR
pour les deux mécanismes et on exprimera k,,, en fonction des constantes de
vitesse et de [HP}, la concentration
en catalyseur bifonctionnel HP.
k_;
k; + k:[HP]
Q 25. Expliquer comment le tracé du graphe k,,, = f ([HP]) permet d'accéder à
l'efficacité du catalyseur,
c'est-à-dire au rapport k:/ko.
Q 24. Montrer que, selon les valeurs du rapport , le catalyseur HP est efficace
ou pas.
Le suivi cinétique de cette substitution nucléophile aromatique s'effectue par
spectrophotométrie UV à une
longueur d'onde de 370 nm où seul le produit 6 absorbe. On mélange, dans une
cuve d'un spectrophotomètre
thermostaté à 25 °C, 1 mL de la solution chloroformée de Pip à la concentration
[Pip]y = 4,8 x 10 * mol-L |,
une quantité de HP variable puis on ajoute 1 mL de la solution chloroformée de
3 à 2,67 x 10-* mol-L-* en
déclenchant le chronomètre. On relève les valeurs d'absorbance À du mélange
toutes les 30 secondes pendant
une heure. On obtient alors le graphe de la figure 10 représentant l'évolution
temporelle de l'absorbance du
mélange à 370 nm.
0,08
longueur d'onde : 370 nm
T : 25°C ; solvant : chloroforme
Absorbance
=
E
T
0,00 1
0 1800 3600
Temps (s)
Figure 10 Évolution temporelle de l'absorbance du mélange à 370 nm et 25 °C
Q 26. Montrer qu'en début de réaction, les modèles mécanistiques prévoient
l'expression de l'évolution tem-
porelle de l'absorbance suivante : À = k,,, [Piplo Ai t.
Q 27. Cette étude expérimentale permet-elle de valider la loi de vitesse
établie précédemment ?
Q 28. Conclure sur l'efficacité du catalyseur bifonctionnel HP dans cette
substitution.
II Hydratation de l'acétonitrile catalysée par un complexe du zinc
L'atome de carbone fonctionnel d'un nitrile R--CN a un caractère électrophile
peu marqué et l'eau est un mauvais
nucléophile. L'hydratation d'un nitrile pour donner un amide, modélisée par la
réaction d'équation
ne peut être réalisée qu'en imposant des conditions opératoires vigoureuses. De
plus, dans ces conditions, l'amide
obtenu est lui-même hydrolysé pour donner, selon le pH, l'acide carboxylique ou
l'ion carboxylate correspondant.
L'hydratation contrôlée d'un nitrile pour former un amide représente donc un
véritable défi.
Les nitrile hydratases, enzymes produites par certaines bactéries, sont des
métallo-enzymes à base de fer ou de
cobalt. La coordination du nitrile au centre métallique de cette enzyme permet
d'en réaliser l'activation et de
catalyser son hydratation en amide. On se propose, dans cette partie, d'étudier
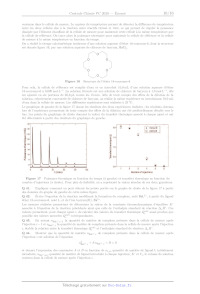
un complexe du zinc dont la
structure est représentée figure 11, qui s'est révélé être un catalyseur de la
réaction d'hydratation de l'acétonitrile
CH;--CN en éthanamide CH;CONH,; .
2020-04-30 07:46:17 Page 6/12 CETTE
Figure 11 Structure du complexe [Rim,ZnS}?* ; le groupe R est le
groupe pentyle ; S représente une molécule de solvant ou un autre ligand
Pour l'écriture des réactions et des mécanismes on pourra utiliser des
écritures simplifiées des espèces chimiques
mises en jeu en ne faisant intervenir que les parties concernées.
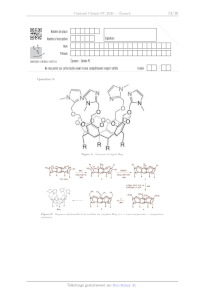
IT.A -- Synthèse du ligand Rim,
Dans cette sous-partie, on se propose d'étudier la synthèse du ligand Rim,,
dont la structure est donnée figure A
du document réponse, à partir du C-pentylcalix{[4resorcinarène 1 (figure B du
document réponse). Le groupe
R est le groupe pentyle.
IL.A.1) Passage de 2 à 3
Cette étape fait intervenir du carbonate de potassium et du bromochlorométhane.
Q 29. Représenter un schéma de Lewis pour l'ion carbonate COS. Proposer, en
justifiant, un encadrement
pour la valeur de la longueur de la liaison CO et une valeur pour l'angle OCO.
Q 30. Écrire les équations des quatre réactions successives permettant de
rendre compte de la formation de
3 à partir de 2. Préciser leur nature et justifier leur ordre de succession.
II.A.2) Passage de 3 à 4
Le buthyllithium, nBulLi, réagit avec les dérivés bromés et iodés pour former
le composé organolithien. L'équation
de la réaction correspondante est la suivante :
RO L: + R--X + RS + R-L
Cette réaction permet la préparation de divers organolithiens.
Q 31. Expliquer la stratégie de synthèse mise en place pour obtenir 4 à partir
de 3. Commenter soigneusement
la réponse en termes de réactivités comparées. Préciser quelle réaction
parasite est envisageable.
IL.A.3) Passage de 4 à 5
Q 32. Proposer les conditions opératoires pour obtenir 5 à partir de 4, en
précisant, en particulier, le(s)
réactif(s) à utiliser, les étapes à mettre en oeuvre, la nature des solvants à
employer.
II.A.4) Passage de 5 au ligand Rim,
La synthèse du ligand Rim, s'effectue à partir du tétra(alcool)cavitand 5 selon
le protocole opératoire suivant.
Sous atmosphère inerte et à 0 °C, dissoudre 420 mg (soit 0,45 mmol) de
tétra(alcool)cavitand 5 dans 8 mL de
DMF anhydre (figure 12). Ajouter goutte-à-goutte la solution obtenue à une
suspension de 544 mg d'hydrure de
sodium à 60% dans le DMF anhydre. Agiter pendant 30 min à 0 °C puis pendant 2 h
à température ambiante.
Ajouter, à O°C et à 15 min d'intervalle, 606 mg (soit 3,6 mmol) de
2-(chlorométhyl)-1-méthyl-1 imidazole
(figure 12) en quatre fractions. Agiter la suspension orange obtenue à
température ambiante pendant toute une
nuit. Après hydrolyse puis diverses opérations de lavage et de purification, on
obtient 389 mg d'un solide blanc
cassé, soit un rendement de 64%.
|
N
: TSI ur
\ / CI
N
Figure 12 Structure du DMF (à gauche) et du 2-(chlorométhyl)-1-méthyl-1
H-imidazole (à droite)
Q 33. Rappeler les caractéristiques du solvant DMF et justifier son
utilisation lors de cette étape de la
synthèse du ligand Rim,.
Q 34. La dernière étape dans le traitement du produit de la synthèse consiste
en la recristallisation du solide
obtenu dans un mélange éthanol/cau dans les proportions 50/50 en volume.
Préciser l'objectif ainsi que le
principe de la recristallisation.
Q 35. Déterminer la valeur du rendement de la synthèse totale du ligand Rim, à
partir de 1.
Le tableau 3 donne les signaux du spectre de résonance magnétique nucléaire du
proton du ligand Rim, enregistré
à 600 MHZ dans le chloroforme deutéré CDCI..
2020-04-30 07:46:17 Page 7/12
Ô (ppm) multiplicité constante de couplage intégration relative
7,03 singulct AH
6,93 singulct 4H
6,89 singulct 4H
5,97 doublet 2J = 7,2 Hz 4H
4,70 triplet 3J = 8,4 Hz 4H
4,56 singulet SH
4,20 singulet SH
4,16 doublet 2J = 7,2 Hz 4H
3,02 singulet 12H
2,13 multiplet SH
1,34 multiplet 24H
0,88 triplet 3J = 7,2 Hz 12H
Tableau 3 Signaux du spectre de RMN du ligand Rim,
Q 36. Sur la figure À du document réponse, identifier, sans chercher à les
distinguer, les protons associés
aux signaux se trouvant à 7,03 ppm, 6,93 ppm et 6,89 ppm.
Q 37. Justifier la multiplicité des signaux se trouvant à 3,62 ppm et 5,57 ppm.
ITI.B -- Synthèses de complexes [Rim,ZnS|(ClO, );
Le ligand Rim, obtenu, on s'intéresse à présent à la synthèse de complexes
[Rim,ZnS|** en solution et de solides
[Rim,ZnS|(ClO,), formés avec l'ion perchlorate.
II.B.1) Synthèse du complexe |[Rim,Zn(EtOH)|(CIO, );
Pour synthétiser le complexe [Rim,Zn(EtOH)|(CIO, );, 46 mg du ligand Rim, sont
dissous dans 1 mL d'éthanol.
La solution ainsi préparée est ajoutée goutte-à-goutte à une solution obtenue
en réalisant la dissolution de
13 mg de perchlorate de zinc hexahydraté Zn(CIO, ), : 6H,0 dans 1 mL d'éthanol.
On observe la formation d'un
précipité blanc. Après lavage à l'éthanol et séchage, on obtient 48 mg d'un
solide blanc cassé.
Q 38. Écrire l'équation de la synthèse du complexe [Rim,Zn(EtOH)](CIO, )..
Afin d'en réaliser le spectre de résonance magnétique nucléaire du proton, le
solide est dissous dans l'acétonitrile-d,
acétonitrile deutéré de formule CD;CN. L'éthanol est alors remplacé dans le
complexe par l'acétonitrile deutéré.
La figure 13 montre les deux positions envisageables de l'acétonitrile deutéré
dans le complexe : Gido EURt Gex:
Figure 13 Positions Go et Ga dans le complexe
endo
Le spectre de résonance magnétique nucléaire du proton, enregistré à 500 MHz,
du complexe est représenté
figure 14.
Q 39. Expliquer la présence sur le spectre des signaux notés « EtOH free ».
Q 40. Déterminer si l'acétonitrile se trouve en position 6,4 où GL au sein du
complexe.
2020-04-30 07:46:17 Page 8/12
T m co e n"n © oO Fr Len © nm [Fa]
[+2 e om a" + © Oo M" al q oO Ni
a) -- nn "mn nn IN 4 tm en + m Lea)
[EN nn © un + + + + mn (ua + ©
LE À S [|
]
J | il X
Figure 14 Spectre de résonance magnétique nucléaire du proton du complexe
II.B.2) Étude de la formation du complexe [Rim,Zn(CH,CN)}?* par titrage
calorimétrique iso-
therme
La formation du complexe [Rim,Zn(CH;CN)]* à également été étudiée par titrage
calorimétrique isotherme,
technique dont le principe va être étudié dans un premier temps.
a) Principe du titrage calorimétrique isotherme
Le titrage calorimétrique isotherme est une technique de choix pour déterminer
les grandeurs thermodynamiques
associées à une réaction de complexation. En plus de sa stooechiométrie, il est
ainsi possible de déterminer la
valeur de la constante thermodynamique d'équilibre et de l'enthalpie standard
de la réaction de complexation.
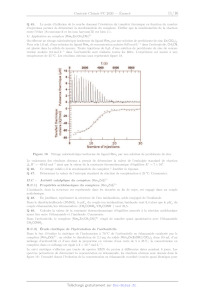
Le schéma de principe du dispositif permettant de réaliser un titrage
calorimétrique isotherme est donné figure 15.
Le dispositif est constitué de deux cellules en matériau conducteur placées
dans une enceinte calorifugée. Un
capteur de température permet de mesurer la différence de température entre :
-- Ja cellule de référence qui est remplie de solvant :
-- Ja cellule de mesure qui est remplie d'une solution du réactif à titrer.
Avant d'ajouter le réactif titrant à travers le tube d'injection, les éléments
chauffant permettent d'amener les
deux cellules à la même température.
enceinte calorifugée --+
tube d'injection
élément chauffant élément chauffant
capteur de température ------#%#----{: dispositif d'agitation
cellule de référence cellule de mesure
Figure 15 Schéma de principe du dispositif de titrage calorimétrique isotherme
L'élément chauffant de la cellule de référence dissipant une puissance
constante, un volume précisément connu
de la solution de réactif titrant est ajoutée, à intervalles de temps
réguliers, à la solution de réactif à titrer
2020-04-30 07:46:17 Page 9/12
contenue dans le cellule de mesure. Le capteur de température permet de
détecter la différence de température
entre les deux cellules due à la réaction entre réactifs titrant et titré, ce
qui permet de réguler la puissance
dissipée par l'élément chauffant de la cellule de mesure pour maintenir cette
cellule à la même température que
la cellule de référence. On trace alors la puissance nécessaire pour maintenir
la cellule de référence et la cellule
de mesure à la même température en fonction du temps.
On a réalisé le titrage calorimétrique isotherme d'une solution aqueuse d'éther
18-couronne-6, dont la structure
est donnée figure 16, par une solution aqueuse de chlorure de baryum, BaCI,.
[°2
ee
Lo
Figure 16 Structure de l'éther 18-couronne-6
Pour cela, la cellule de référence est remplie d'eau et on introduit 10,0 mL
d'une solution aqueuse d'éther
18-couronne-6 à 0,020 mol-L*. La solution titrante est une solution de chlorure
de baryum à 1,0 mol-L"?, elle
est ajoutée en six portions de 65,6 ul toutes les 15 min. Afin de tenir compte
des effets de la dilution de la
solution, relativement concentrée de chlorure de baryum, on réalise la même
expérience en introduisant 10,0 mL
d'eau dans la cellule de mesure. Les différentes expériences sont réalisées à
25 °C.
Le graphique de gauche de la figure 17 donne les résultats des deux expériences
réalisées ; les résultats obtenus
lors de l'expérience permettant de tenir compte des effets de la dilution ont
été artificiellement décalés vers le
bas. Les points du graphique de droite donnent la valeur du transfert thermique
associé à chaque ajout et ont
été déterminés à partir des résultats du graphique de gauche.
40 T T T T
2.0 £
= 35- | Ô © e mesuré
2 Q calculé
-- 30- - ne ©
v S
2 Y 1.5-
© 25 >
E É
LL
u 20° D
£ ©
D £ 1,0-
U 15- .
C ®
© 10- - -
n ©
N 0.5+
4 FF
& s/ ©
L k À
À À À À À À 0.0 @ CE
l 1 l l
0 20 40 60 80 100 1 2 3 . $ 6
t (min) Nombre d'injections
Figure 17 Puissance thermique en fonction du temps (à gauche) et transfert
thermique en fonction du
nombre d'injections (à droite). Pour plus de lisibilité, on a représenté la
valeur absolue de ces deux grandeurs.
Q 41. Expliquer comment on peut obtenir les points portés sur le graphe de
droite de la figure 17 à partir
des données du graphe de gauche de cette même figure.
Q 42. Écrire l'équation de la réaction modélisant la formation du complexe,
noté BaL?+, à partir du ligand
éther 18-couronne-6, noté L, et de l'ion baryum(Il), Ba°*.
Les mesures réalisées permettent de déterminer la valeur de la constante
thermodynamique d'équilibre K°
associée à l'équation de la réaction précédente ainsi que celle de l'enthalpie
standard de réaction A,.H°. Ces
valeurs permettent, pour chaque ajout ?, de calculer des valeurs du transfert
thermique Qcarc aussi proches que
possible des valeurs mesurées Q% correspondantes.
Q 43. En notant ng,,2;_1 la quantité de matière de complexe présente dans la
cellule de mesure après
l'injection à -- 1 et ng,,2 ; la quantité de matière de complexe présente dans
la cellule de mesure après l'injection
à, établir la relation entre le transfert thermique QC et l'enthalpie standard
de réaction À, H°.
A4. Montrer que la quantité de matière np.12+,; de complexe présente dans la
cellule de mesure après
BaL