X/ENS Chimie PC 2020
| Thème de l'épreuve | Synthèse d'un complexe de platine(II). Synthèse d'un alcaloïde. |
| Principaux outils utilisés | solutions aqueuses, cinétique chimique, thermodynamique, chimie organique, orbitales moléculaires, chimie de coordination |
| Mots clefs | platine, cystéine, alcaloïde |
Corrigé
: 👈 gratuite pour tous les corrigés si tu crées un compte👈 l'accès aux indications de tous les corrigés ne coûte que 5 € ⬅ clique ici
👈 gratuite pour tous les corrigés si tu crées un compte
- - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - -
Énoncé complet
(télécharger le PDF)














Rapport du jury
(télécharger le PDF)




Énoncé obtenu par reconnaissance optique des caractères
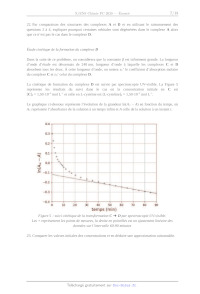
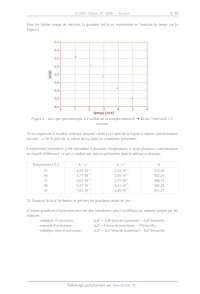
ÉCOLE POLYTECHNIQUE - ESPCI ÉCOLES NORMALES SUPERIEURES CONCOURS D ADMISSIO N 2020 MARDIZ2IAVRIL 2020 - 14h00 - 18h00 FILIÈERE PC - Epreuven 4 CHIMIE À (XEULC) Durée: d heures L'utilisation des calculatrices n estpas autorisée pour cette épreuve Ce sujet comprend deux parties À et B, indépendantes l'une de l'autre. Des données permettant sa résolution figurent en annexe. Un soin tout particulier est attendu dans la précision et la concision des réponses apportées. Partie À : Synthèse d'un complexe de platine (II) Les complexes de platine (II) sont des composés utilisés depuis 1978 en tant que composés anti- tumoraux. Le premier composé de cette famille est, historiquement, le cis-platine, dont les propriétés ont été étudiées par B. Rosenberg. En 1960, il découvre par hasard que des produits d'électrolyse du platine peuvent inhiber la division cellulaire. Dans ce problème, la synthèse d'un complexe de platine (IT) (noté D dans la suite de ce problème) impliquant un atome de soufre est présentée. La présence de l'atome de soufre est importante, car les propriétés de l'ion central sont modifiées par l'interaction ainsi créée. La structure du complexe D ainsi que ses propriétés électroniques sont étudiées, et des résultats cinétiques concernant la formation de ce complexe sont utilisés pour donner des informations sur le mécanisme de sa formation. Structure électronique du platine et d'un de ses complexes 1. Donner la structure électronique de l'ion platine (IT) en la justifiant à partir de celle de l'atome. Les complexes tétravalents du platine (IT), tels que PtCl;" (A), présentent généralement une géométrie plan carré. Le complexe PtCl; sera modélisé pour les quatre questions suivantes par PtH."_. Les orbitales du système H, plan carré sont représentées sur la Figure 1 ainsi que le système d'axes utilisé dans ce problème. X1 X2 X3 X4 repère Z + n Figure 1 : orbitales moléculaires du fragment H, et repère utilisé dans le problème 2. Classer les orbitales x; (pour i variant de 1 à 4) par ordre croissant d'énergie. Justifier que les orbitales y, et x; possèdent la même énergie. 1/17 3. Représenter les orbitales d du platine dans le même repère. En utilisant des règles de symétrie, donner les interactions possibles entre les orbitales d de valence du platine et les orbitales du fragment H,. Montrer ainsi que, parmi les orbitales du fragment H:, deux orbitales ne peuvent pas interagir avec les orbitales d du platine. 4. Montrer, toujours en utilisant les règles de symétrie, que chacune des orbitales non- interagissantes de la question précédente peut interagir avec une, et une seule, orbitale p de valence du platine, et que ces orbitales n'interagissent pas avec l'orbitale s de valence du platine. Propriétés d'un acide aminé ligand du platine Le cation Pt" peut former un complexe avec, entre autres, la L-cystéine. La L-cystéine est un acide aminé naturel représenté sur la Figure 2 sous forme protonée et sous forme acétylée. Les valeurs des pK, mesurés pour la L-cystéine en solution aqueuse sont respectivement 1,9, 9,1 et 10,3. Lorsque la L-cystéine est acétylée sur l'amine (Figure 2b), les pK, mesurés en solution aqueuse sont respectivement 3,2 et 9,5. O O ST 0 So NHz SY (a) CH; (D) Figure 2 : L-cystéine protonée (ou L-cystéinium) (a) et forme acétylée de la L-cystéine (b) 5. Donner les couples acido-basiques auxquels correspondent la plus petite valeur de pK, pour la L- cystéine libre et la L-cystéine acétylée. 6. Confronter les valeurs de pK, à celles habituellement mesurées pour ces couples, et commenter. 7. Justifier la différence de pK, entre les deux couples étudiés question 5. 8. Donner la forme prédominante de la L-cystéine à pH = 4. La Figure 3 représente le suivi par pH-métrie du titrage de 20,0 mL d'une solution aqueuse de chlorure de L-cystéinium à une concentration de 1,0-10 * mol L'' par une solution aqueuse d'hydroxyde de sodium à la concentration de 1,0:10 * mol L". 2/17 © T Î 0 2 4 6 8 10 Viiaon (ML) S Figure 3 : suivi par pH-métrie du titrage d'une solution aqueuse de chlorure de L-cystéinium par une solution aqueuse d'hydroxyde de sodium 9, Analyser le plus précisément possible la courbe de titrage en relation avec les réactifs mis en jeu dans la réaction support du titrage et leurs pK. 10. Donner l'allure schématique de la courbe qui serait obtenue lors du suivi de ce même titrage par conductimétrie en justifiant les évolutions relatives et les points particuliers. 11. Comparer avec le résultat du dosage pH-métrique. On s'intéresse dans la suite à la formation du complexe D à partir du complexe PtCl;" (A). Le composé D comprend deux ligands dont la L-cystéine. Ce complexe est préparé en trois étapes selon le schéma reporté sur la Figure 4. Les produits secondaires éventuellement formés ne figurent pas sur ce schéma. 3/17 PtCL* D (A) + (C,.H,;N,O,SPT) h À " H,0 H,O 2 ke: à ? \ 50 °C, 12h L-cystéine | 55°C. 2h N NH Y _ _ _ 4 H H N N T AgCIO, (2,1 équiv.) Y 7 Ho N" \ NH 2 \.-NH, Pr température LA Pt ur 3 ambiante, 12h 0;Cr SO: CO; C204 HO CIO4 Ag" 2,7 9,8 4,8 11,1 11,0 7,7 --0,8 12. Détailler le rôle du cation Ag" dans la transformation B = C. 13. Justifier le caractère faiblement coordinant de l'anion CIO, à l'aide de structures de Lewis. 14. En déduire les raisons du choix du composé AgCIO, et des quantités utilisées lors de la deuxième étape. Étude de la formation du complexe D par la méthode des variations continues Les composés formés par réaction du complexe EUR avec la L-cystéine ou avec son dérivé acétylé dans les mêmes conditions possèdent des structures similaires dans lesquelles le ligand introduit se fixe en mode bidente. La constante de formation de D, supposée grande et notée B, est associée à la réaction d'équation : C (aq) + n L-cystéine (aq) = D(aq) + y H0 (1) La stoechiométrie du complexe D a été déterminée par spectroscopie UV-visible en utilisant la méthode des variations continues, présentée dans les questions suivantes. Plusieurs solutions du 4/17 complexe C et de L-cystéine en proportions variables sont préparées et leur absorbance est mesurée à 266 nm dans une cuve de chemin optique L. À cette longueur d'onde, seul D absorbe significativement, son coefficient d'absorption molaire est noté & et ceux des autres espèces présentes dans le milieu sont négligés. Dans ces mélanges, la somme c+ des concentrations initiales (avant réaction de complexation) en C et en L-cystéine est constante, mais la proportion entre ces deux concentrations initiales varie. Les notations suivantes seront utilisées : C Cu = [Ch + [L--cystéine, et x = < L tot Les résultats obtenus figurent dans le tableau ci-dessous. X 0,25 0,33 0,50 0,67 0,75 0,202 0,231 0,257 0,232 0,209 Afin d'alléger les expressions, la concentration standard c° pourra être omise dans les expressions des questions suivantes. 15. En considérant que x est proche de 0, exprimer l'absorbance A, de chaque mélange en fonction de EUR», L, X et Ci. 16. En considérant que x est proche de 1, exprimer l'absorbance A4 de chaque mélange en fonction de &p, 1, n, x et Ci. 17. Montrer que À, et Ai se croisent pour une valeur x* telle que : « 1 X = l+n 18. Commenter la pertinence des valeurs particulières de x utilisées pour l'expérience. Indiquer si d'autres valeurs auraient été judicieuses. 19. Confirmer, à l'aide d'une représentation graphique schématique A(Xx), la valeur de n obtenue grâce la formule brute de D. 20. Préciser l'influence de la valeur de B sur le schéma tracé à la question précédente. 21. Donner la structure du composé D formé dans ces conditions en faisant apparaître l'organisation des ligands autour du platine (l'environnement du platine reste plan carré). Dénombrer et représenter les isomères se formant éventuellement et, le cas échéant, préciser la (les) relation(s) de stéréochimie entre eux. 9/17 22. Par comparaison des structures des complexes A et D et en utilisant le raisonnement des questions 2 à 4, expliquer pourquoi certaines orbitales sont dégénérées dans le complexe A alors que ce n'est pas le cas dans le complexe D. Étude cinétique de la formation du complexe D Dans la suite de ce problème, on considérera que la constante f est infiniment grande. La longueur d'onde d'étude est désormais de 240 nm, longueur d'onde à laquelle les complexes C et D absorbent tous les deux. À cette longueur d'onde, on notera &c' le coefficient d'absorption molaire du complexe C et &." celui du complexe D. La cinétique de formation du complexe D est suivie par spectroscopie UV-visible. La Figure 5 représente les résultats du suivi dans le cas où la concentration initiale en C est [Cl = 1,50:10 " mol L 'et celle en L-cystéine est [L-cystéine]o = 1,50-10 ° mol L *. Le graphique ci-dessous représente l'évolution de la grandeur In(A+ -- À) en fonction du temps, où A. représente l'absorbance de la solution à un temps infini et À celle de la solution à un instant t. 0.4 0.3 + QG? - ALT 0.0 + + In(Ax -- À) 0 + | LT 0 2 - ah --(} 3 + | | | | | | | nn --(],4 T 1 T 1 1 T 1 T Ü 10 20 30 4) 50 60 40 80 90 temps (min) Figure 5 : suivi cinétique de la transformation C = D par spectroscopie UV-visible. Les + représentent les points de mesures, la droite en pointillés est un ajustement linéaire des données sur l'intervalle 60-90 minutes 23. Comparer les valeurs initiales des concentrations et en déduire une approximation raisonnable. 6/17 L'approximation ainsi déterminée pourra être faite dans toute la suite du problème. 24. En exploitant la Figure 5, montrer que la transformation C + D n'est pas un acte élémentaire. 25. Expliquer, sans calcul, que la présence d'un intermédiaire LE entre les complexes C et D est compatible avec les données ci-dessus. On admet que le mécanisme réel est plus complexe et peut s'écrire sous la forme : K k, k, C + L--cystéine = I1 = 12 > D On notera la constante d'équilibre de la première réaction K, et les constantes de vitesse associées aux deux étapes suivantes k: et k: Dans ce mécanisme, la coordinence de tous les complexes impliqués, y compris les intermédiaires, est la même. 26. Montrer que, sous des hypothèses raisonnables à expliciter, une constante apparente, notée kops et dont l'expression doit être donnée explicitement, suffit à décrire au niveau macroscopique pendant les temps courts de la réaction les deux premières étapes de cette séquence réactionnelle selon le schéma : k k, C = 12 = D 27. Exprimer alors l'évolution de la concentration en complexe C au cours du temps. 28. Établir et résoudre l'équation différentielle décrivant l'évolution de la concentration en intermédiaire L2 au cours du temps. 29, En déduire simplement l'évolution de la concentration en complexe D au cours du temps. L'évolution de l'absorbance peut ainsi être exprimée sous la forme : As -- À = a'exp(---kops t) + d>exp(-k t) dans laquelle que a. et a ne dépendent que de constantes et de la concentration initiale en [C]. On admettra dans la suite que la constante k; est plus petite que la constante ks. 30. En supposant le modele cinétique proposé valide et à l'aide de la Figure 5, donner une estimation (en min ', à 30 % près) de la valeur de k> dans les conditions présentées. La grandeur À est définie par la relation : À = (A4 -- À) - @'exp(-k t) 7717 Pour les faibles temps de réaction, la grandeur In(A) est représentée en fonction du temps sur la Figure 6. 1.1 --1 4 4 --1,5 e --] 6 4 1.7 - In(A) --1,8 - --] 9 - -- 7? 0 - --2.1 T 3 4 _ temps (min) Ee Figure 6 : suivi par spectroscopie UV-visible de la transformation C = D sur l'intervalle 1-5 minutes 31 En supposant le modèle cinétique proposé valide et à l'aide de la Figure 6, donner une estimation (en min ", à 30 % près) de la valeur de k+, dans les conditions présentées. L'expérience précédente a été reproduite à plusieurs températures et pour plusieurs concentrations en réactifs différentes, ce qui a conduit aux valeurs présentées dans le tableau ci-dessous. Température (°C) k./s" k/s" K 25 2,93-10 2,34:10 ° 325,49 30 3,77:10 * 2,85:10 ° 342,19 35 5,03:10 * 3,57:10 ° 366,21 40 6,27:10 4,31:10 ° 382,18 45 7,81:10 * 5,45:10 ° 411,27 32. Enoncer la loi d'Arrhenius et préciser les grandeurs mises en jeu. D'autres grandeurs d'activation peuvent être introduites, que l'on définira de manière simple par les relations : - enthalpie d'activation : - entropie d'activation : - enthalpie libre d'activation : AH = AtH°(état de transition) - AHH(réactifs) A,S* = S'(état de transition) -- S'(réactifs) AÀ,G* = A;G'(état de transition) -- A;G°(réactifs) 8/17 Dans les relations précédentes, l'indice f fait référence aux réactions de formation. Les grandeurs d'activation introduites peuvent être manipulées comme les grandeurs thermodynamiques habituelles. En particulier, les relations liant les grandeurs thermodynamiques seront considérées ici comme valables pour les grandeurs d'activation. Les variations de A.H° et de A,S* avec la température seront négligées. Dans ce cadre, la relation d'Eyring, donnée ci-dessous, est utilisée de manière similaire à la relation d'Arrhenius. LL KT sr: À G° RT où kë est la constante de Boltzmann, T la température, h la constante de Planck et R la constante des gaz parfaits. À partir des valeurs expérimentales obtenues par variation de la température, les enthalpies et entropies d'activation pour les étapes conduisant à la formation des intermédiaires [1 et F2 ont été déterminées : AH; = 34,70 kJ mol ! AH; = 29,26 kJ mol ! AS; = --173,02 J mol * K* AS; = ---232,19 J mol ' K* 33. Montrer qu'il est possible à l'aide de l'équation d'Eyring d'exprimer le facteur pré-exponentiel de l'équation d'Arrhenius en fonction d'un terme exponentiel indépendant de la température. Proposer alors une interprétation du facteur pré-exponentiel. 34. Proposer un traitement des données expérimentales ayant pu conduire à la détermination des enthalpie et entropie d'activation pour chaque étape. Le raisonnement ainsi que la discussion d'éventuels graphiques éventuels à tracer seront détaillés, mais aucun calcul numérique n'est attendu. Le complexe I2 est un composé dans lequel l'une des molécules d'eau du complexe C a été remplacée par l'atome de soufre de la L-cystéine. 35. Préciser le type de transformation conduisant de l'intermédiaire 12 au complexe D. 36. Proposer, à partir de l'interprétation au niveau microscopique du signe de A;S,, un mécanisme pour cette dernière étape et en déduire que l'hypothèse d'un acte élémentaire pour I2 = D est raisonnable. 9/17 Partie B : Quelques étapes de la synthèse d'un alcaloide L'objectif de ce problème est l'étude de la synthèse de l'alcaloïde 15. Ce composé possède des propriétés pharmaceutiques intéressantes, et la construction de sa structure complexe représente un défi pour les chimistes spécialistes de synthèse en chimie organique. En effet, le contrôle de la stéréochimie de chaque étape, en particulier sur les trois carbones quaternaires (quatre substituants hors atomes d'hydrogène) présents dans la structure, est important et sera étudié attentivement dans la suite. 15 COOMe COOMe Dans tout ce problème, la notation N+ signifie que le composé N est un mélange de deux énantiomères. Dans ce cas, la structure d'un seul des énantiomères peut être donnée, mais cette structure doit être cohérente avec celles présentées pour les questions précédentes et suivantes. Certaines étapes sont suivies d'une hydrolyse non-présentée sur le schéma mais mentionnée dans le texte. Un soin particulier est attendu dans l'écriture des mécanismes réactionnels. Les questions assorties d'un astérisque (*) après leur numéro exigent des réponses pour lesquelles les formules des différentes espèces, réactifs ou intermédiaires, se conforment aux régles de représentation de Lewis et font apparaître les doublets non liants, les lacunes électroniques et les charges, ainsi que les formes mésomères s'il y a lieu. Certains groupes pourront être écrits sous forme abrégée si les notations sont clairement introduites ou si elles figurent dans l'énoncé. La première partie d'une voie de synthèse du composé 15 est présentée sur la Figure 7. 10/17 O SO -- CE À +: (XC &_ COOE \ COOEt COOMe boome 2' boome TIPS CH NBus, F° AZ . ° ho 2 et 2 ES -- = 4+ me DE sans solvant THF ji À) 120°C, 3h --60°C ; 20 min. ' [ toluène -TIPS = -Si(CH(CH.).). reflux, 3h nf PE 5+ > THF --/8°C, 45 min. £ COOE COOMe Figure 7 : premières étapes de la synthèse du composé 15 37. Proposer des conditions expérimentales permettant de préparer le composé 2 à partir du composé 1 en utilisant tout réactif organique comportant au plus quatre atomes de carbone, et en détaillant les conditions expérimentales nécessaires. 38. Donner la relation de stéréoisomérie qui lie les composés 2 et 2". A l'aide de formes mésomères représentatives, expliquer pourquoi un équilibre peut s'établir entre ces deux stéréoisomères. L'isomère 2 est le seul à réagir significativement dans les conditions aboutissant au composé 3. On note à la proportion de 2 parmi les deux isomères 2 et 2", c'est-à-dire : n(2) n(2) + n(2') OEA -- Le mélange des composés 2 et 2° est par la suite soumis à des conditions de réaction sans solvant, ce qui conduit à la formation du produit 3+ sous la forme d'un mélange de deux énantiomères. L'interprétation du spectre de RMN du proton de ces composés montre que la régiosélectivité de la transformation est due à un contrôle stérique. 39. Préciser l'influence de la valeur de « sur le rendement de l'étape 2 et 2° = 3+. 11/17 40*. Donner la structure du composé 3+. Donner le mécanisme impliqué, préciser le rôle de chaque réactif et représenter clairement les aspects stéréochimiques. La structure de l'état de transition de cette transformation devra en particulier être donnée. 41. Déterminer, en le justifiant, le nombre d'isomères du composé 3+ formés dans ces conditions. Le composé 3+ est soumis aux conditions de réaction présentées sur la Figure 7, suivies par un lavage par une solution saline aqueuse concentrée et une purification. Le composé 4+ est alors obtenu. Cette étape de déprotection convertit un alcool protégé R-OTTIPS en alcool libre R-OH. On donne dans le tableau ci-dessous quelques énergies moyennes de liaison. C-H O-Si Si-Si O-H Si-F < E liaison > 413 398 222 366 610 (kJ mol ') 42. Donner la structure du composé 4+. Proposer une équation de la réaction chimique rendant compte de sa formation et, à partir des données, justifier le choix de l'ion fluorure pour cette déprotection. Le composé 4+ est alors soumis aux conditions de réaction de la Figure 7. Après lavage par une solution saline aqueuse concentrée et purification, le composé 5+ est obtenu. Les signaux suivants sont relevés sur le spectre de RMN 'H du composé 5+ effectué dans CDCH. Au voisinage d'atomes de carbone stéréogènes, les signaux correspondant à des hydrogènes portés par un même atome de carbone peuvent parfois présenter des déplacements chimiques différents. es | Déplacement chimique Nature du signal et . Référence du signal ' Intégration (ppm) couplage éventuel (Hz) A 0,60 t (7,2) 3 B 1,81-2,16 m D C 2,68 t (13,6) 1 D 3,61-3,72 m 2 E 3,72-3,81 m 1 F 3,87 S 3 G 3,93-4,03 m 4 H 7,16-8,11 m 4 43*, Donner la structure du composé 5+ et écrire le mécanisme réactionnel de la transformation D+ > 6+. 44, Préciser les propriétés que doit respecter le solvant dans cette transformation. 12/17 45. Reproduire la structure du composé 5+ et attribuer les signaux À, D, F et H. Proposer une attribution pour les signaux E et G. Du bromure d'allyle-magnésium est, par la suite, ajouté à une solution de composé 5+ dans le tétrahydrofurane. Après réaction, le milieu réactionnel est traité par une solution aqueuse de chlorure d'ammonium, puis purifié. Cette transformation est diastéréosélective et aboutit au produit 6+. 46. Justifier la chimiosélectivité de la transformation 5+ = 6+. La structure spatiale la plus stable des deux énantiomères du composé 5+ peut être représentée, selon l'énantiomère retenu, sous l'une des formes présentées sur la Figure 8. à RS Figure 8 : représentations abrégées de la structure spatiale des énantiomères du composé 5 47*, Recopier la structure spatiale cohérente avec l'énantiomère retenu du composé 5+ en précisant les groupes R', R°, R°, R° et R°. Proposer un mécanisme réactionnel décrivant la transformation 5+ > 6+ en faisant apparaître clairement les aspects stéréochimiques. 48. Justifier le fait que le composé 6 est toujours présent sous la forme d'un mélange racémique. La suite de la synthèse est présentée sur la Figure 9. NalO, ; OsO, H3C ou CH3 B(C.F.); ; (CH.),SIiCN SL G+ > 7+ té 8+ CH,CI, dioxane/eau --29 CG, en LA fn NaBH, HCI (2 mol L"?) 8+ > 9+ cl 10+ MeOH/THF THF/H,0 0°C, 10 min. 45°C, 4,5h Figure 9 : étapes intermédiaires de la synthèse du composé 15 Le composé 7+ est formé par réaction du composé 6+ avec B(C&F;): et (CH:):3Si-CN (noté dans la suite TMS-CN), suivie d'une hydrolyse par une solution saline aqueuse concentrée. Cette transformation est stéréospécifique. 13/17 49. Donner une structure de Lewis de B(C&F;); faisant apparaître d'éventuels doublets non-liants et lacunes électroniques. En déduire la réactivité de cette molécule et préciser le rôle des atomes de fluor. 50%. Justifier le fait que TMS-CN peut être considéré comme un donneur d'ions cyanure, CN. Proposer alors un mécanisme réactionnel pour la transformation 6+ 7+ en tenant compte de la stéréochimie de la transformation et donner la structure du composé 7+. Le composé 7+ est placé dans les conditions du schéma de réaction présenté sur la Figure 9, puis est hydrolysé par une solution de thiosulfate de sodium. Après purification, le composé 8+ est isolé. Ce composé est ensuite soumis à l'action de tétrahydruroborate de sodium, suivie d'une hydrolyse par une solution de chlorure d'ammonium. Le composé 9+ est par la suite isolé. 51. Donner la structure du composé 8+. Préciser le rôle de chacune des espèces ajoutées dans le milieu et les conditions expérimentales les plus appropriées pour cette transformation. 52. Préciser la chimiosélectivité de la transformation conduisant au produit 9+ et en déduire la structure de ce composé. Le composé 9+ est par la suite dissous dans du THE, et de l'acide chlorhydrique (2 mol L) est ajouté. Après réaction et hydrolyse par une solution de sulfate de sodium, le composé 10+ est obtenu. 53. Donner la structure du produit 10+. 54. Discuter, du point de vue de la stratégie de synthèse, l'intérêt de la conversion 4+ + 5+, ainsi que l'ordre des étapes conduisant du composé 6+ au composé 10+. Le composé 10+ est soumis à plusieurs étapes de conversion (non étudiées dans ce problème) qui aboutissent au composé 11+. La suite de la synthèse est décrite sur la Figure 10. Le composé 11+ est converti en deux étapes (hors hydrolyses éventuelles) en 12+. Dans les meilleures conditions étudiées, le rendement est de 49 %, en raison de la formation deux produits secondaires principaux notés 13+ et 14+. Dans la plupart des conditions étudiées lors de l'élaboration de la synthèse, le composé 13+ était prédominant par rapport au composé 12+. Le composé 14+ ne sera pas étudié dans ce problème. 14/17 " dl 12+ OH ! OMs COOEt 114 OMs : OSO,CH, 12+ ----__+Ù 15+ COOMe COOMe Figure 10 : dernières étapes de la synthèse du composé 15 55. Proposer des réactifs permettant de préparer le composé 12+. Si la proposition envisagée comporte plus de deux étapes, les décrire. 56. Sachant que le composé 13+ se forme par des mécanismes réactionnels très proches de ceux conduisant à la formation du produit 12+, proposer une structure pour le composé 13+. Un composé comprenant un groupe nitrile (R--CN) peut être hydrolysé sans autre modification de la chaïne carbonée en acide carboxylique (R---COOH) dans des conditions que l'on notera « hydrolyse nitrile » et que l'on n'explicitera pas. Cette « hydrolyse nitrile » n'affecte pas d'autres groupes caractéristiques présents dans les différents intermédiaires de cette synthèse. 57. Proposer une voie de synthèse, utilisant en particulier les conditions « hydrolyse nitrile », permettant de préparer le composé 15+ à partir du composé 12+. 58. Le composé 15+ est ici obtenu sous forme d'un mélange racémique. Expliquer le principe d'une procédure permettant de l'obtenir sous forme énantiomériquement pure. Déterminer à quel stade (à partir du composé 11+) cette procédure pourrait être appliquée pour un maximum d'efficacité. 15/17 Données 1. RMN 'H : déplacements chimiques (en ppm par rapport au signal du TMS) phénols Se alcools -- alcènes I D aromatiques ii. alcynes mu EEE acides carboxyliques CH--NR; pis CHr--SiR: LL mu ldéhydes CH---OR = Ci cétones 5 D» | CH--CRI a 110 100 9,0 80 70 60 50 40 30 5 7 10 00 2. Valeurs typiques de pK; Fonction acide du couple acide/base Valeurs typiques (extrapolées si > 14) Acide carboxylique 3,0 -- 5,0 Phénol 8,0 -- 10,5 Ammonium 9,0 -- 11,0 Thiol 10,0 -- 13,0 Alcool 16,0 -- 18,0 Amine 25,0 -- 40,0 Alcane 40,0 -- 55,0 16/17 3. Tableau périodique des éléments : numéro atomique et symbole H He 3 4 5 6 7 8 9 10 Li | Be B|IC|IN|O|F Ne 11 12 13 14 15 16 17 18 Na | Mg AISil P|S |CI | Ar 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 K | Ca! Sc} Ti V | Cr Mn Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr 37 38 39 40 41 42 43 44 45 46 47 48 49 50 51 52 53 54 Rb | Sr | Y | Zr | Nb | Mo Tec | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe 55 56 72 73 74 75 76 77 78 79 80 81 82 83 84 85 86 Cs | Bal " | Hf| Ta W | Re | Os | Ir | Pt | Au | He | T1 | Pb | Bi | Po | At | Rn 87 88 104 105 106 107 108 109 110 111 112 113 114 115 116 117 118 Fr | Ra |" | Rf | Db | Se | Bh | Hs | Mt | Ds | Re | Cn | Nh | F1 | Mc Lv | Ts | Og 57 58 59 60 61 62 63 64 65 66 67 68 69 70 71 * | La | Ce | Pr | Nd | Pm | Sm Eu | Gd | Tb Dy | Ho | Er | Tm | Yb | Lu 89 90 91 92 93 94 95 96 97 98 99 100 101 102 103 "| Ac | Th | Pa | U | Np | Pu |Am|Cm|Bk | Cf | Es | Fm Md|No |1r 17/17