CCINP Chimie MP 2014
| Thème de l'épreuve | Séquestration minérale du dioxyde de carbone dans les olivines |
| Principaux outils utilisés | cristallographie, diagrammes binaires, thermochimie, solutions aqueuses |
| Mots clefs | olivines, forstérite, fayalite, solution solide, perovskite, pompe à CO2 |
Corrigé
:👈 gratuite pour tous les corrigés si tu crées un compte
👈 l'accès aux indications de tous les corrigés ne coûte que 1 € ⬅ clique ici
👈 gratuite pour tous les corrigés si tu crées un compte
- - - - - - - - - - - - - - -
👈 gratuite pour ce corrigé si tu crées un compte
- - - - - - - - - - - - -
Énoncé complet
(télécharger le PDF)





Rapport du jury
(télécharger le PDF)



Énoncé obtenu par reconnaissance optique des caractères
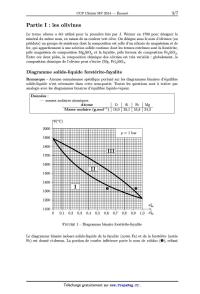
SESSION 2014 MPCH009 flâ:_ CONCOURS COMMUNS -=- POLYTECHNIQUES EPREUVE SPECIFIQUE - FILIERE MP CHIMIE Durée : 2 heures N.B. : Le candidat attachera la plus grande importance à la clarté, a la précision et a la concision de la rédaction. Si un candidat est amené à repérer ce qui peut lui sembler être une erreur d 'e'nonce', il le signalera sur sa copie et devra poursuivre sa composition en expliquant les raisons des initiatives qu 'il a été amené à prendre. \ Les calculatrices sont autorisées Le sujet est un problème composé de deux parties indépendantes. Toute démonstration illisible ou incompréhensible sera considérée comme fausse. 1/7 Séquestration minérale du dioxyde de carbone dans les olivines Il est indéniable que la teneur en gaz a effet de serre dans l'atmosphère et notamment le dioxyde de carbone ÛO2, responsable a près de 63 % de cet effet, a crû de façon continue et importante depuis 150 ans et le début de l'industrialisation. La teneur en CO2 est ainsi passée de 280 ppm a 382 ppm fin 2006. La moyenne des valeurs observées dans le passé est clairement dépassée et l'on ne peut que constater que cette augmentation de la concentration atmosphérique est directement liée a l'augmentation des émissions de CO2 par l'homme durant le même temps (rapport GIEC, 2007). Même si l'on adopte une position prudente quant aux conséquences sur le climat d'une telle évolution, car les paramètres sont multiples et les modèles très discutés, un consensus se dégage sur la nécessité de stabiliser le niveau de dioxyde de carbone dans l'atmosphère a 500 ppm a l'horizon 2050 puis progressivement de le diminuer. Parmi les solutions envisagées pour réduire ces teneurs, la filière capture et stockage géologique du CO2 émis industriellement est jugée comme très prometteuse. Plusieurs formations géologiques sont considérées classiquement comme réservoirs potentiels pour le CO2 : les champs d'hydrocarbures appauvris (pétrole, gaz), les gisements de charbon inexploités ou les aquifères salins profonds. Des travaux récents ont cependant montré que les formations de roches basiques et notamment les olivines, pouvaient jouer un rôle majeur dans la séquestration du dioxyde de carbone. Elles jouent un rôle majeur dans le cycle du carbone, notamment en réagissant naturellement avec le CO2 atmosphérique produisant des carbonates qui vont pouvoir retenir le carbone pendant plusieurs millions d'années, soit une durée compatible avec une rééquilibration de l'at-- mosphère terrestre. L'extension de ces formations ainsi que leurs propriétés physico--chimiques en font des candidats sérieux pour le stockage a long terme du ÛO2. Remarques importantes autour du sujet Ce problème s'articule autour des olivines et se divise en deux parties. La partie 1 comporte deux sous-parties indépendantes et traite de quelques propriétés physico--chimiques des olivines. Composée de deux sous-parties indépendantes, la partie Il propose l'étude du processus de carbonatation. Toutes les données nécessaires se trouvent au début de chaque sous-partie. Tous les gaz seront considérés comme parfaits, les solutions idéales et les solides idéaux. 2/7 Partie I : les olivines Le terme olivinc a été utilisé pour la première fois par J. Werner en 1790 pour désigner le minéral du même nom, en raison de sa couleur vert olive. On désigne sous le nom d'olivines (ou péridots) un groupe de minéraux dont la composition est celle d'un silicate de magnésium et de fer, qui appartiennent a une solution solide continue dont les termes extrêmes sont la forstérite, pôle magnésien de composition Mg28iO4 et la fayalite, pôle ferreux de composition FeQSiO4. Entre ces deux pôles, la composition chimique des olivines est très variable : globalement, la composition chimique de l'olivine peut s'écrire (Mg, Fe)QSiO4. Diagramme solide--liquide forstérîte-fayalîte Remarque -- Aucune connaissance spécifique portant sur les diagrammes binaires d'équilibre solide--liquide n'est nécessaire dans cette sous--partie. Toutes les questions sont a traiter par analogie avec les diagrammes binaires d'équilibre liquide--vapeur. Données : -- masses molaires atomiques Atome lO \ Si \ Fe lMg Masse molaire (g.mol_l) \ 16,0 \ 28,1 \ 55,8 \ 24,3 9(°Û) 2000 1900 1800 1700 1600 1500 1400 1300 1200 OEîâa 1100 0 0,1 0,2 0,3 0,4 0,5 0,6 0,7 0,8 0,9 1,0 æÊa FIGURE 1 -- Diagramme binaire forstérite--fayalite Le diagramme binaire isobare solide--liquide de la fayalite (notée Fa) et de la forstérite (notée Fo) est donné ci--dessus. La portion de courbe inférieure porte le nom de solidu3 (0), reliant 3/7 la température 9(°Û) et la fraction molaire de fayalite dans la phase solide 33%. La portion supérieure porte le nom de liquidu3 (@), reliant la température 9(°Û) et la fraction molaire de fayalite dans la phase liquide æfga. I.1. D'après l'allure du diagramme, peut--on dire que la fayalite Fe28iO4 et la forstérite MgZSiO4 sont miscibles ou non miscibles a l'état solide ? I.2. Indiquer le nombre et la nature des phases présentes dans les domaines numérotés (I, II et III). I.3. Quel composé a la température de fusion la plus faible ? I.4. Donner l'allure de la courbe de solidification (ou courbe d'analyse thermique 9 : f(t)) donnant l'évolution de la température du système au cours du temps lors d'un refroi-- dissement régulier de 1 800 °C a 1 300 °C d'une olivine contenant 0,40 mole de fayalite Fe28iO4 par mole de liquide. Indiquer sur chaque partie de la courbe les événements physico--chimiques et les phases en présence. On considère une olivine contenant, en première approximation, 8,55 g de fayalite Fe28iO4 et 11,45 g de forstérite Mg28iO4 a température ambiante. I.5. Calculer la fraction molaire a:Ëa en fayalite FeZSiO4. I.6. On chauffe désormais ce mélange. A quelle température apparaît la première goutte de liquide? Quelle est sa composition? I.7 . Le mélange précédent est porté a une température 9 = 1 640 °C. Déterminer les quantités de matière des phases en présence et la masse de fayalite FeZSiO4 dans la phase liquide a cette température. Etude cristallographique Les olivines ferro--magnésiennes sont, sous diverses formes, le composant majeur du manteau terrestre. Mais cet assemblage chimique ne conserve pas la même structure cristallographique selon la profondeur a laquelle il se situe car cette structure dépend des conditions de tempé-- rature et de pression. Ainsi, vers 660 km de profondeur, sous une température de 1830 K, l'olivine (phase y) ou ringwoodite se transforme en silicate de magnésium MgSiO3 de structure perovskite et en magnésiowüstite assimilable a l'oxyde de magnésium MgO. La magnésiowüstite MgO possède la même structure cristallographique que le chlorure de so-- dium NaCl. Les ions seront assimilés a des sphères parfaites. Données : -- rayons ioniques Ions \ Mg2+ \ 02_ \ Si4+ Rayons (pm) \ 70 l 140 l 41 I.8. Donner une représentation de la maille de la magnésiowüstite MgO. I.9. Déterminer la plus petite distance d entre deux ions de signes opposés ainsi que le para-- mètre de maille al. I.10. Exprimer, en fonction des rayons ioniques, puis calculer la compacité de la structure. 4/7 La structure perovskite est la structure adoptée par le minéral du même nom, CaTi03. Cette structure usuelle a donné son nom a un type structural adopté par de nombreux matériaux synthétiques de type ABX3. La structure cristallographique d'une perovskite parfaite peut être décrite de la façon suivante : -- le cation A occupe les sommets du cube; -- le cation B occupe le centre du cube; -- les anions X occupent les centres des faces du cube. 1.11. Représenter la structure cristallographique décrite ci--dessus. 1.12. La description de la maille est--elle en accord avec la formule proposée pour la perovskite résultant de la décomposition de la ringvvoodite ? Le facteur de tolérance de Goldschmidt t rend compte de l'influence des rayons ioniques sur la structure cristalline adoptée par les composés du type ABX3. Ce facteur exprime la condition de tangence simultanée : -- entre l'ion B au centre de la maille et l'ion X au centre d'une face; -- entre l'ion A au sommet de la maille et ce même ion X. Le facteur de tolérance t est un indicateur de stabilité pour les structures de type perovskite. Il est défini par : 7°A + 7°X ": \/îX(TB+TX)' 1.13. Etablir les deux relations traduisant la condition de tangence en faisant intervenir le paramètre de maille (12 dans le cas d'une perovskite parfaite. 1.14. Quelle est la valeur de t dans le cas d'une perovskite parfaite ? 1.15. La structure de la perovskite MgSiO3 est--elle parfaite ? Commenter la valeur de t obtenue en indiquant quels ions peuvent être éventuellement en contact. Partie 11 : processus de carbonatation des olivines Aspect thermodynamique Données : -- R = 8,314 J.mol_1.K_1 -- grandeurs thermodynamiques : Composés MgCOBMgZSiO4(S) SiOZCOZ(g) AfH° (kJ.mol_l) -- 1 090 -- 2 170 -- 905 -- 394 S,,Yn (J.mol_l.K_l) 65,5 95,0 43,4 214,0 où AfHO et 831 sont respectivement l'enthalpie molaire standard de formation et l'entropie molaire standard absolue des espèces considérées a 298 K. Le gaz carbonique Û02 rejeté par les activités humaines est la principale cause de l'effet de serre, donc de l'augmentation de la température moyenne du globe. Il a été proposé, pour empêcher ce gaz de se répandre dans l'atmosphère, de le faire réagir avec un minéral riche en magnésie MgO dans le but de fabriquer du carbonate de magnésium MgÛ03, produit naturel 5/7 (totalement inoffensif ) connu sous le nom de magnésite. Pour ce faire, les olivines représentent de bons candidats. Nous assimilerons, dans un souci de simplification, les olivines a la forstérite MgZSiO4. L'équation de la réaction envisagée est donc la suivante : II.1. Calculer a 298 K, l'enthalpie standard A,HÏ(298 K) et l'entropie standard A,SÏ(298 K) de la réaction (1). Interpréter le signe de A,SÏ(298 K). II.2. Déterminer alors l'expression de l'enthalpie libre standard de la réaction (1) A,.GÏ en fonction de la température T dans le cadre de l'approximation d'Ellingham. En quoi consiste cette approximation ? II.3. Sachant que les solides sont seuls dans leurs phases et incompressibles, établir une ex-- pression de l'affinité chimique A1 du système siège de la réaction (1) en fonction de T et Foo, II.4. Déterminer les conditions nécessaires de température T afin que la réaction (1) soit ther-- modynamiquement possible sous une pression partielle en dioxyde de carbone égale a _ --4 12002 _ 10 bar. Altération chimique de la forstérite et contrôle du dioxyde de carbone atmosphérique L'altération chimique de la forstérite par une eau saturée en dioxyde de carbone est un phé-- nomène très lent qui pompe du dioxyde de carbone atmosphérique pour le transformer dans le cas de la forstérite en carbonate de magnésium MgCO3 également appelé magnésite. Quatre grandes étapes interviennent dans ce processus long de plusieurs dizaines de millions d'années. Etape n°1 -- Dissolution du dioxyde de carbone atmosphérique ÛO2(g) modélisée par l'équilibre ci--dessous : g) ami-) En solution, le dioxyde de carbone manifeste alors des propriétés acido--basiques : cog(aq_, + 2 H20(,, : HCOg(aq_) + Hgo+( K1 : 10-6»4 à 298 K aq.) a HCOg(aq_) + H20(,, = coâ--(aq, + Hgo+( K 2 = 10--10»3 à 298 K. aq.) a 11.5. Tracer le diagramme de prédominance des différentes espèces acido--basiques du dioxyde de carbone en solution aqueuse. II.6. Donner l'expression de la constante K . Que dire de la concentration [COZ< sous une aq.)l pression partielle de dioxyde de carbone gazeux fixe et égale a 12002 = 10_4 bar (valeur constatée dans l'atmosphère) ? II.7 . Justifier le caractère acide d'une eau saturée en dioxyde de carbone et maintenue sous une pression égale a 12002 = 10_4 bar. Pour cela, écrire la réaction acido--basique prépondérante, puis déterminer la valeur du pH de cette eau. Commenter la valeur obtenue. Etape n°2 -- En présence d'eau et de dioxyde de carbone gazeux, la forstérite (MgZSiO4) solide subit ce que l'on appelle communément une altération chimique conduisant a la formation de cations magnésium, de silice aqueuse (H4SiO4(aq_)) et d'ions hydrogénocarbonate (HÛOQ(aq_)). 6/7 II.8. Ecrire l'équation de la réaction traduisant l'altération chimique de la forstérite MgZSiO4. On notera cette équation de réaction (2). Justifier l'appellation de << pompe a Û02 » attribuée a la forstérite. Etape n°3 -- Transferts des substances dissoutes vers la mer (étape non étudiée dans le cadre de ce problème). Etape n°4 -- Dans un milieu de sédimentation avec des conditions très précises, on assiste a la formation des carbonates solides et notamment le carbonate de magnésium MgCO3(S) dont on souhaite étudier la solubilité. 11.9. 11.10. 11.11. 11.12. 11.13. 11.14. 11.15. Ecrire la réaction de dissolution du carbonate de magnésium MgCO3(S) dans l'eau. A 298 K, le produit de solubilité KS du carbonate de magnésium est égal a 3,5 >< 10--8. Calculer la solubilité 81 du carbonate de magnésium dans l'eau pure en négligeant les pro-- priétés acido--basiques de l'ion carbonate ÛOÊ_(aq_). Cette hypothèse est--elle acceptable? En tenant compte cette fois--ci des propriétés acido--basiques de l'ion carbonate COÊ_(aq_), écrire la nouvelle réaction prépondérante de dissolution du carbonate de magnésium dans l'eau pure et calculer le pH de la solution saturée. Cette nouvelle hypothèse est--elle dé-- sormais acceptable? Justifier qualitativement votre réponse. On s'intéresse désormais a la solubilité du carbonate de magnésium en présence de dioxyde de carbone dissous. Dans une solution saturée en carbonate de magnésium, on fait barbo-- ter du dioxyde de carbone gazeux sous une pression de 1 bar (conditions qui se rapprochent du processus de séquestration minérale qui utilise du dioxyde de carbone dans un état supercritique). Donner l'équation de la nouvelle réaction prépondérante notée (3). Exprimer la constante K3 de cet équilibre en fonction de K8, KOE1 et Ka2. Calculer K3 a 298 K. Déterminer alors les nouvelles valeurs de solubilité 83 du carbonate de magnésium et de pH de cette solution saturée. Déduire a partir des équations de réaction (2) et (3) que, bien que la précipitation de la magnésite s'accompagne d'un rejet de dioxyde de carbone, l'altération chimique de la forstérite Mg28iO4 contribue a faire diminuer la teneur en dioxyde de carbone atmosphé-- rique. Fin de l'énoncé 7/7