Mines Chimie MP 2009
| Thème de l'épreuve | L'or |
| Principaux outils utilisés | cristallographie, atomistique, thermochimie, oxydoréduction |
| Mots clefs | solution solide, recyclage de l'or, pyrométallurgie en milieu chlorure, hydrométallurgie, électrolyse à anode soluble |
Corrigé
:👈 gratuite pour tous les corrigés si tu crées un compte
👈 l'accès aux indications de tous les corrigés ne coûte que 1 € ⬅ clique ici
👈 gratuite pour tous les corrigés si tu crées un compte
- - - - - - - - - - - - - - - - - - - -
👈 gratuite pour ce corrigé si tu crées un compte
-
Énoncé complet
(télécharger le PDF)



Rapport du jury
(télécharger le PDF)

Énoncé obtenu par reconnaissance optique des caractères
A 2009 Chimie MP
ECOLE NATIONALE DES PONTS ET CHAUSSEES.
(&2/(6 1$7,21$/(6 683(5,(85(6 '( /¶$(521$87,48( (7 '( /¶(63$&(
DE TECHNIQUES AVANCEES, DES TELECOMMUNICATIONS,
DES MINES DE PARIS, DES MINES DE SAINT-ETIENNE, DES MINES DE NANCY,
DES TELECOMMUNICATIONS DE BRETAGNE.
ECOLE POLYTECHNIQUE ( Filière TSI ).
&21&2856 '¶$'0,66,21
EPREUVE DE CHIMIE
Filière : MP
'XUpH GH O¶pSUHXYH : 1 heure 30 minutes
/¶XVDJH G¶RUGLQDWHXU RX GH FDOFXODWULFH HVW LQWHUGLW
Sujet mis à la disposition des concours : Télécom SudParis (ex INT), ENSTIM,
TPEEIVP.
Les candidats sont priés de mentionner de façon apparente sur la première page
de la copie :
CHIMIE 2009-Filière MP
Cet énoncé comporte 5 pages de texte.
6L DX FRXUV GH O¶pSUHXYH XQ FDQGLGDW UHSqUH FH TXL OXL VHPEOH rWUH XQH HUUHXU
G¶pnoncé, il est invité à le
VLJQDOHU VXU VD FRSLH HW j SRXUVXLYUH VD FRPSRVLWLRQ HQ H[SOLTXDQW OHV UDLVRQV
GHV LQLWLDWLYHV TX¶LO DXUD
été amené à prendre.
'(%87 '( /¶(121&(
/¶25
Des données utiles pour la résolution du problème sont fournies à la fin de
O¶pQRQFp
1(QRQFHU OHV UqJOHV JpQpUDOHV SHUPHWWDQW G¶pWDEOLU OD FRQILJXUDWLRQ
pOHFWURQLTXH G¶XQ
DWRPH GDQV O¶pWDW IRQGDPHQWDO HW OHV DSSOLTXHU j O¶DWRPH G¶RU ,GHQWLILHU OHV
pOHFWURQV GH
YDOHQFH GH O¶RU
2/¶RU FRQVWLWXH XQH H[FHSWLRQ j O¶DSSOLFDWLRQ GH FHs règles. Une stabilisation
énergétique assez forte se produit si les orbitales d sont totalement remplies.
En déduire la
FRQILJXUDWLRQ pOHFWURQLTXH UpHOOHPHQW REVHUYpH SRXU O¶DWRPH G¶RU GDQV O¶pWDW
IRQGDPHQWDO
3/¶RU PpWDOOLTXH FULVWDOOLVH GDQV XQ UpVHDX cubique à faces centrées (C.F.C.).
Les
DWRPHV G¶RU RFFXSDQW OHV QRHXGV GH FH UpVHDX VRQW VXSSRVpV rWUH GHV VSKqUHV
ULJLGHV GH UD\RQ
R(Au). Fournir une représentation perspective de la maille conventionnelle.
Situer
SUpFLVpPHQW OHV DWRPHV G¶RU
4La structure est dite compacte. Que signifie cette affirmation ? Calculer
numériquement le paramètre de maille a associé à la maille conventionnelle.
Page 1/5
Tournez la page S.V.P.
Chimie 2009 -- Filière MP
5- Préciser le positionnement des sites octaédriques dans la maille
conventionnelle de
l'or. Calculer le rayon de ces sites, conclure sur la possibilité
d'introduction du nickel à
l'intérieur de ces sites.
6- En fait cet alliage peut être décrit à l'aide d'une maille cubique
conventionnelle CFC.
dans laquelle un atome de nickel remplace un atome d'or sur chaque sommet.
Comment
nomme--t--on ce genre d'alliage ?
7- La masse volumique de cet alliage est notée p'. Exprimer la valeur du
paramètre de
maille a ' relatif àla nouvelle maille conventionnelle en fonction de M(Au),
M(Ni) et p'.
8- La masse volumique de l'alliage est d'environ 10% inférieure à celle de
l'or. En
déduire a' avec une précision raisonnable.
En solution aqueuse, outre l'or métallique, on rencontre l'or au degré
d'oxydation ] et au
degré d'oxydation HI.
9- En considérant les valeurs des potentiels standard, quel équilibre chimique
peut--on
écrire entre ces différentes espèces ? Comment s'appelle cette réaction ?
En présence d'ions cyanure, les ions de l'or forment les complexes :
[Au{CN)2] ' et [Au(CNM'
10- Calculer les potentiels standard des couples :
[Au(CN)g] ' /Au (noté E" 1) et [Au(CN)4] 7[Au(CN)g] ' (noté E°'2).
Quel est l'effet des ions cyanure sur la stabilité de Au+ en solution aqueuse ?
Les déchets électroniques (ou scraps) sont considérés comme des matériaux
intéressants à
recycler car ils contiennent d'une part des métaux précieux : Au ( 2 à 3 g/
tonne), Ag, Pt....et
d'autre part des métaux lourds, dangereux pour l 'environnement A titre de
comparaison, la
teneur moyenne des minerais naturels d'or ont une teneur moyenne de 5 g /
tonne...
Après démantèlement, suivi d 'un traitement mécanique, un des procédés de
recyclage de l 'or a
partir de scraps consiste en un traitement hydrométallurgique.
Lixiviation cyanurée :
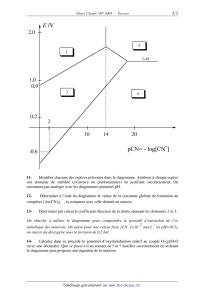
Le diagramme E-pCN de l'or est un analogue des diagrammes E-pH. Il est adapté a
l'étude
de phénomènes engageant l'or ou ses ions en milieu cyanuré (CN ). En abscisse
figure la
- -3
valeur de pCN=-log[ CN ]. La concentration de tracé est prise égale à c,...=10
mol.L". La
température est fixée à 25°C.
Page 2/ 5
Chimie 2009 ± Filière MP
E /V
2,0
2
1
1,44
1,0
0,9
3
4
0,2
2
10
14
20
pCN= - log[CN-]
-0,6
11Identifier chacune des espèces présentes dans le diagramme. Attribuer à
chaque espèce
son domaine de stabilité (existence ou prédominance) en justifiant
succinctement. On
raisonnera par analogie avec les diagrammes potentiel-pH.
12'pWHUPLQHU j O¶DLGH GX GLDJUDPPH OD YDOHXU GH OD FRQVWDQWH JOREDOH GH
IRUPDWLRQ GX
±
complexe [Au(CN)4] , la comparer avec celle donnée en annexe.
13-
Déterminer par calcul le coefficient directeur de la droite séparant les
domaines 2 et 3.
2Q FKHUFKH j XWLOLVHU OH GLDJUDPPH SRXU FRPSUHQGUH OH SURFpGp G¶H[WUDFWLRQ GH
O¶RU
-2
métallique des minerais. On opère pour une valeur fixée [CN ]=10 mol.L-1 (et
pH=10,5),
on injecte du dioxygène sous la pression de 0,2 bar.
14&DOFXOHU GDQV FH SURFpGp OH SRWHQWLHO G¶R[\GRUpGXFWLRQ UHODWLI DX FRXSOH
22(g)/H2O
(avec une décimale). Que se passe-t-LO DX FRQWDFW GH O¶RU ? Justifier
succinctement en utilisant
le diagramme puis proposer une équation de la réaction.
Page 3/5
Tournez la page S.V.P.
Chimie 2009 -- Filière MP
15- Du zinc métallique en poudre est ensuite ajouté à la solution. Ecrire
l'équation--bilan
de la réaction . Cette réaction est--elle quantitative ? (On justifiera sans
calcul).
16- En pratique l'or formé se dépose sur des particules de zinc qui ne sont pas
totalement
consommées par la réaction précédente. Proposer un moyen pour éliminer ce zinc
métallique
résiduel et récupérer ainsi l'or. Ecrire l'équation-bilan de la réaction.
Pré-afiina ge :
L'or ainsi récupéré peut encore contenir jusqu 'a 5 % d impuretés (Ag, Zn... ).
Le procédé Miller consiste a injecter du dichlore gazeux dans l 'alliage (Au,
Ag, Zn... ) en
fusion (à 1400 K)
A partir des constituants de l 'alliage on peut envisager, par réaction avec le
dichlore gazeux,
la formation des chlorures suivants: AgCl ; ZnClz . L'or ne réagit pas dans ces
conditions.
Par analogie avec les diagrammes d 'Ellingbam, on peut tracer le diagramme AÏG°
= f( T) des
chlorures.
17- Rappeler en quoi consiste l'approximation d'Ellingham.
18- Ecrire l'équation de la réaction d'oxydation de Ag en AgCl à 1400 K,
rapportée à une
mole de dichlore.
19- Etablir l'expression de ArG° = f(T) pour cette réaction dans l'intervalle
de température
[1300 K; 1500 K], grâce aux valeurs des grandeurs thermodynamiques données en
fin
d' énoncé.
20- Calculer, à 10% près, la pression de dichlore satisfaisant à l'équilibre
(Ag/AgCl) à
1400 K. Conclusion ?
21- En considérant les températures de changement d'état de l'or et des
différents
chlorures, expliquer comment le traitement de l'alliage en fusion par Clz
permet d'affiner l'or.
Afiina ge gar électrolyse à anode soluble.
L'or ainsi obtenu a un titre supérieur à 995/1000 . Pour obtenir de l'or de
grande pureté, on
opère par électrolyse à anode soluble.
Cette méthode permet d'obtenir de l 'or a 999, 9/1000.
On admettra que le métal a purifier contient uniquement Au et Ag, et que l
'électrolyte est une
solution aqueuse contenant : H20, H +, Cl _ et Au3+
22- Expliquer à l'aide d'un schéma le principe de l'affinage par électrolyse à
anode
soluble dans le cas de l'or. De quoi sont respectivement constituées l'anode et
la cathode ?
23- Pour une densité de courant de 600 A.m'2, on applique une différence de
potentiel de
0,64 V. Déterminer la consommation massique d'énergie, c'est--à--dire l'énergie
nécessaire au
raffinage de 1 kg d'or. Pour simplifier on considérera que le rendement
faradique pf : 1.
Page 4/ 5
Chimie 2009 -- Filière MP
Données :
Constante d'Avogadro : NA= 6,01023 mol--1.
RT
Constante de Nemst a 298 K : ln 10>< ? = 0,06 V . . , . 10 7 Approx1matwns numeriques : { z 7 { z 4 Numero atomique : Z(Au)=79 Masse molaire : M(Au)=l97 g.mol'1 , M(Ni)=58 g.mol'1 Rayon atomique : R(Au)= 144 pm, R(Ni)= 124 pm Chimie des solutions : Potentiels standard à 298 K: E°(Au3+/Au(s))=l,50 V. E°(Au3+/Au+)= 1,41 V. E°(AuWAu(s))= 1,68 V. E°(02(g) /H20)= 1,23 V. E°(Zn2+ /Zn(s))= --0,76 V. E°(Zn(CN)Æ' /Zn(s))= --1,26 V. E°(AgCl(s)/Ag(s))=O,22 V. E°(Ch/Cl)=l,36 V Constantes globales de formation: @ ([Au(CN)fl _) =1038 B([Au(CN)4] _) =1056 B([Au(Cl)4] _) =1022 ___-_- (K) (K) (kJ/mol) (kJ/mol) (J.K'l.mol'l) 1234 2485 ------ 1338 3080 ------ AgCl 1823 __" 1180 ------ 1029 ------ cu ___-- FIN DE L'ENONCE Page 5/5 Tournez la page S.V.P.