Mines Chimie MP 2013
| Thème de l'épreuve | Le plomb |
| Principaux outils utilisés | cristallographie, diagrammes d'Ellingham, diagrammes E-pH, oxydoréduction, solutions aqueuses |
| Mots clefs | plomb, accumulateur au plomb, peinture |
Corrigé
:👈 gratuite pour tous les corrigés si tu crées un compte
👈 l'accès aux indications de tous les corrigés ne coûte que 1 € ⬅ clique ici
👈 gratuite pour tous les corrigés si tu crées un compte
- - - - - - - - - - - - - - - - - -
👈 gratuite pour ce corrigé si tu crées un compte
Énoncé complet
(télécharger le PDF)




Rapport du jury
(télécharger le PDF)


Énoncé obtenu par reconnaissance optique des caractères
A 2013 Chimie MP
ECOLE DES PONTS PARISTECH,
SUPAERO (ISAE), ENSTA PARISTECH,
TELECOM PARISTECH, MINES PARISTECH,
MINES DE SAINT-ETIENNE, MINES DE NANCY,
TELECOM BRETAGNE, ENSAE PARISTECH (FILIERE MP)
ECOLE POLYTECHNIQUE (FILIERE TSI)
CONCOURS D'ADMISSION 2013
EPREUVE DE CHIMIE
Filière : MP
Durée de l'épreuve : 1 heure 30 minutes
L'usage d'ordinateur ou de calculatrice est interdit
Sujet mis à la disposition des concours :
Cycle International, ENSTIM, TELECOM INT, TPE-EIVP.
Les candidats sont priés de mentionner de façon apparente sur la première page
de la copie :
CHIMIE 2013-Filière MP
Cet énoncé comporte 6 pages de texte.
Si au cours de l'épreuve, un candidat repère ce qui lui semble être une erreur
d'énoncé, il est invité à le
signaler sur sa copie et à poursuivre sa composition en expliquant les raisons
des initiatives qu'il aura
été amené à prendre.
DEBUT DE L'ENONCE
LE PLOMB
Des données utiles pour la résolution du problème sont fournies à la fin de
l'énoncé.
Le plomb a été largement utilisé depuis 500 av-JC sous sa forme métallique, pur
ou dans les
alliages (bronze, par exemple} mais aussi sous forme oxyde'e dans les
peintures, pesticides,
additifs dans les essences, accumulateurs... Toutefois c 'est l'un des métaux
les plus nocifs
pour la santé, d 'ou la recherche constante de produits de substitution. Depuis
son interdiction
dans les peintures puis les essences, son utilisation dans les accumulateurs au
plomb reste la
seule application grande consommatrice de plomb (3/4 de la consommation totale).
Ce sujet s'intéresse a différents aspects de la chimie du plomb, en
sous--parties relativement
indépendantes, toutefois certaines données ou résultats peuvent être exploités
d 'une partie a
l 'autre.
Page 1/6 Tournez la page S.V.P.
Chimie 2013 - Filière MP
A) Etude structurale
1- Justifier l'ordre de grandeur de la masse molaire du plomb par rapport à
Z(Pb).
2- Définir les énergies de première et de deuxième ionisation du plomb. Sachant
que
leurs valeurs respectives sont 715 kJ.mol'1 et 1450 kJ.mol", si on soumet des
atomes de
plomb à un rayonnement électromagnétique de longueur d'onde X=120nm, peut-on
observer
la première ionisation ? La deuxième ?
3- L'oxyde de plomb PbO a une structure cristalline de type CsCl: les anions
forment une
structure cubique simple, les cations occupent le centre de la maille cubique.
En nommant r+
le rayon des cations et r- celui des anions, donner en la justifiant la
relation permettant de
calculer la masse volumique de PbO, qu'on notera p.
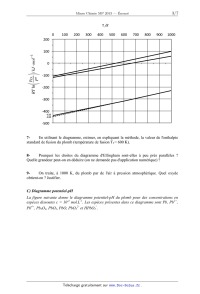
B) Oxydes de plomb: diagramme d 'Ellingham.
Le diagramme d 'Ellingham ci-après a été construit en prenant le coefficient
stoechiométriqae
du dioxygène égal à 1 pour les réactions considérées.
4- Rappeler en quoi consiste l'approximation d'Ellingham, justifier le fait que
le
diagramme d'Ellingham est constitué d'un ensemble de segments de droites.
Les oxydes de plomb à considérer dans le diagramme d 'Ellingham sont: PbO,
Pb304, Pb02.
5- Donner la valeur du nombre d'oxydation du plomb dans ces oxydes.
6- Reproduire schématiquement le diagramme d'Ellingham suivant et placer en
justifiant
les différentes espèces du plomb.
Page 2/ 6
Chimie 2013 - Filière MP
T/K
0 100 200 300 400 500 600 700 800 900 1000
200
100
--| /
'N - /
% o //4;/
| | | | /ÿ/ | | |
3 - /ç/
\ /4/
N 0 -100 ,
Q 0-- _
É -200
_ /
°: /
-300
//
_ //
-400 //
--438 _____
--448 --'
-500
7- En utilisant le diagramme, estimer, en expliquant la méthode, la valeur de
l'enthalpie
standard de fusion du plomb (température de fusion Tf= 600 K).
8- Pourquoi les droites du diagramme d'Ellingham sont--elles à peu près
parallèles ?
Quelle grandeur peut-on en déduire (on ne demande pas d'application numérique) ?
9- On traite, à 1000 K, du plomb par de l'air à pression atmosphérique. Quel
oxyde
obtient-on ? Justifier.
C) Diagramme potentiel--pH
La figure suivante donne le diagramme potentiel--pH du plomb pour des
concentrations en
espèces dissoutes c = 104 mol.L'l. Les espèces présentes dans ce diagramme sont
Pb, Pb2+,
Pb4+, Pb3O4, PbOg, PbO, Pb0£' et HPbO{.
Page 3/6 Tournez la page S.V.P.
Chimie 2013 - Filière MP
EN
n,2 ... 1 6 \
10- Affecter les espèces dans les domaines correspondants. On expliquera
brièvement le
raisonnement.
11- Déterminer par calcul la pente séparant les domaines 2 et 4.
12- Le segment vertical AB coupe l'axe des abscisses à pH = 9. Calculer la
valeur du
produit de solubilité correspondant.
D) Accumulateur au plomb.
L'accumulateur au plomb fait intervenir les couples PbOg(S)/PbSO4(S) et
PbSO4æ/Pbæ. En
pratique il est constitué de plaques de plomb spongieux et de plaques de plomb
dont les
alvéoles sont tapissées de PbOg, immergées dans une solution concentrée d'acide
sulfurique
(pH proche de 0). On considérera que PbSO4(S) est insoluble et que l'activité
des ions sulfate
est égale a 1 .
13- Faire un schéma du montage en situation de décharge. Indiquer les
demi--équations aux
électrodes, l'équation bilan, le sens du courant, la cathode et l'anode.
14- A l'aide du diagramme potentiel-pH de la partie précédente, estimer les
potentiels
standard des couples PbOg/Pb2+ et Pb2+/Pb.
15- Estimer la valeur de la force électromotrice d'un accumulateur chargé, en
expliquant la
démarche et les hypothèses.
16- Pourquoi met-on PbO2 sur du plomb métal ? Quel inconvénient cela peut-il
présenter ?
Quels phénomènes peuvent limiter la durée de vie de l'accumulateur ?
Page 4/ 6
Chimie 2013 - Filière MP
E) dosage du plomb contenu dans une peinture.
Si le plomb a été interdit en France dès 1949 dans les peintures utilisées par
les
professionnels du bâtiment, il en va tout autrement pour la vente aux
particuliers et
l'utilisation de peintures contenant du plomb (en l'occurrence de la céruse, un
carbonate de
plomb) n'a été réellement interdite dans les logements que par l'arrêté du 1 er
février 1993. Si
on ajoute à cela la possibilité que les lois ne soient pas toujours strictement
respectées, il
reste d 'actualité de contrôler la teneur en plomb des peintures.
On prélève sur une tôle des éclats de peinture antirouille que l'on introduit
dans un bécher.
En travaillant sous une hotte ventilée, on verse sur la peinture de l'acide
nitrique concentré,
pour faire passer le plomb en solution. Lorsque le dégagement gazeux a cessé,
on obtient une
solution S.
On prélève 5 mL de solution S que l'on introduit dans un tube à essais, puis on
verse dans le
tube 0,5 mL d 'une solution de iodure de potassium & 1mol.L". Il apparaît un
précipité jaune.
17- Donner l'équation--bilan de la réaction, et indiquer la concentration
minimale en plomb
(en mol.L") dans S ainsi détectée (seuil de précipitation).
On prélève 10 mL de la solution S, que l'on introduit dans un bécher. On y
ajoute environ 10
mL d'une solution de nitrate de chrome 111 (Cr3+, 3 NO3_) & 0,1 mol.LJ et 10 mL
d'une
solution de bromate de potassium (K+, BrO{) & 0,2 mol.L'l.
Après avoir ajusté, avec quelques gouttes de soude concentrée, le pH & 4,5 et
porté la solution
à ébullition pendant une minute, on obtient un précipité de chromate de plomb :
PbCrO4.
Le précipité est ensuite redissous par ajout de 170 mL d'acide chlorhydrique &
la solution
précédente, on obtient la solution S 1.
18- Donner les équations-bilans des réactions faisant intervenir le chrome (on
ne prendra
pas en compte le caractère basique de CrO42').
Une prise d'essai de 100 mL de S] est dosée par une solution de sel de Mohr de
concentration
[Fe2+] = 0,1 mol.L" en présence d 'un indicateur coloré, le diphénylsulfonate
de baryum. Le
changement de couleur de l'indicateur a lieu pour un volume versé égal à 12 mL.
19- Donner l'équation--bilan de la réaction de titrage et calculer sa constante
d'équilibre. La
réaction est-elle quantitative ?
20- Calculer la concentration en ion Pb2+ dans la solution S.
Page 5/6 Tournez la page S.V.P.
Chimie 2013 - Filière MP
Données :
La notation grandeur/unité, introduite par Guggenheim, signifie que la grandeur
prend la
valeur indiquée dans l'unité indiquée. Ainsi, p(X)/bar = 0,10 indique que la
pression partielle
de X vaut 0,10 bar.
Constante d'Avogadro : NA= 6,0.1023 mol'1.
Constante des gaz parfaits :R= 8,3 ] .K'1.rriol'1
Constante de Nernst à 298 K : %ln10 = 0,06V
Constante de Planck : h = 6.10"34 J.s
eélérité de la lumière: e=3.108 rn.s'1
Z(Pb)=82
M(Pb) % 207 g.mol'1
Ks(Pbb) = 1,3.10'8
Potentiels standard à pH = 0 : EO (Cr042' /Cr3+) = 1,33 V
E0 (Fe3+ / Fe2+) = 0,77 V
E0 (BrO{ /Br_) = 1,42 V
. . _ 1
Approxnnaüons numér1ques : \/Ï ... 70 f ...%
FIN DE L'ENONCE
Page 6/ 6
CHIMIE 2013 MP - Errata
Entre la question 17 et la question 18, remplacer le texte suivant :
Le précipité est ensuite redissous par ajout de 1 70 mL d'acide chlorhydrique à
la solution
précédente, on obtient la solution 51.
par :
Le précipité est ensuite extrait, lavé et dissous dans 200 mL d'acide
chlorhydrique, on
obtientla solution 51.
Donnée numérique manquante :
Ks(PbSO4) x 1.10"8