Mines Chimie MP 2022
| Thème de l'épreuve | Chimie et énergie |
| Principaux outils utilisés | cristallographie, thermodynamique, oxydoréduction, diagrammes E-pH, solutions aqueuses |
| Mots clefs | hydrogène, tétrahydruroborate, fer-titane, zinc-air, glucose, orange, dosage |
| Sujet jumeau | Mines Chimie PSI 2022 |
Corrigé
:👈 gratuite pour tous les corrigés si tu crées un compte
👈 l'accès aux indications de tous les corrigés ne coûte que 1 € ⬅ clique ici
👈 gratuite pour tous les corrigés si tu crées un compte
- - -
👈 gratuite pour ce corrigé si tu crées un compte
- - - - - - - - - - - - - - -
Énoncé complet
(télécharger le PDF)




Rapport du jury
(télécharger le PDF)


Énoncé obtenu par reconnaissance optique des caractères
A2022 --- CHIMIE MP
Cm
Concours commun
Mines-Ponts
ÉCOLE DES PONTS PARISTECH,
ISAE-SUPAERO, ENSTA PARIS,
TÉLÉCOM PARIS, MINES PARIS,
MINES SAINT-ÉTIENNE, MINES NANCY,
IMT ATLANTIQUE, ENSAE PARIS,
CHIMIE PARISTECH - PSL.
Concours Mines-Télécom,
Concours Centrale-Supélec (Cycle International).
CONCOURS 2022
ÉPREUVE DE CHIMIE
Durée de l'épreuve : 1 heure 30 minutes
L'usage de la calculatrice et de tout dispositif électronique est interdit.
Les candidats sont priés de mentionner de façon apparente
sur la première page de la copie :
CHIMIE - MP
L'énoncé de cette épreuve comporte 5 pages de texte.
Si, au cours de l'épreuve, un candidat repère ce qui lui semble être une erreur
d'énontcé, il le
signale sur sa copie et poursuit sa composition en expliquant les raisons des
initiatives qu'il est
amené à prendre.
Les sujets sont la propriété du GIP CCMP. Ils sont publiés sous les termes de
la licence
Creative Commons Attribution - Pas d'Utilisation Commerciale - Pas de
Modification 3.0 France.
Tout autre usage est soumis à une autorisation préalable du Concours commun
Mines Ponts.
Chimie et énergie
Ce problème comporte trois parties indépendantes.
Les données utiles à la résolution du problème sont fournies à la fin de
l'énoncé (page 5).
Partie 1. La filière hydrogène
Production de dihydrogène par hydrolyse catalytique du tétrahydruroborate de
sodium
« L'hydrogène est un des vecteurs énergétiques de demain même si les
complications liées à sa
production et à son stockage limitent son développement. L'hydrolyse, catalysée
du
tétrahydruroborate de sodium (NaBH), est une alternative intéressante pour le
stockage et la
production embarqués d'hydrogène car, en présence d'eau et d'un catalyseur, cet
hydrure chimique
produit de façon contrôlée de l'hydrogène pur et du métaborate de sodium.! »
En présence d'un catalyseur adapté, le tétrahydruroborate de sodium est
décomposé par l'eau pour
produire du dihydrogène selon l'équation suivante :
+ -- + --
Na + BH4 0 + 2H0 ---- Na + Bo: + 4 Ho
Q1- Donner la configuration électronique du bore dans son état fondamental.
Identifier les
électrons de valence et donner des quadruplets de nombres quantiques pouvant
caractériser ces
électrons.
Q2- Donner la représentation de Lewis de l'ion tétrahydruroborate BH. En
déduire sa
géométrie. Justifier.
Q3- Déterminer le volume {H2) de dihydrogène que l'on peut générer à partir de
V= 1,0 L de
solution aqueuse de concentration EUR = 10 mol:L'' en ions sodium Na' et en ions
tétrahydruroborate BHx«4 (on se placera dans les conditions standard de
température et de
pression : 7'= 25 °C et P= 1 bar).
Q4- La réaction d'hydrolyse peut être catalysée par des catalyseurs à base de
platine. Le volume
de dihydrogène obtenu serait-il plus élevé si on réalise la réaction en
présence de platine ? Justifier.
Stockage du dihydrogène
S'1l n'est pas préparé « à la demande » comme avec l'hydrolyse du
tétrahydruroborate de sodium, un
des problèmes de l'utilisation du dihydrogène comme vecteur énergétique est son
stockage. Des
alliages à base de fer et de titane permettent le stockage du dihydrogène. Dans
ces composés,
l'hydrogène est stocké sous forme atomique (H) et non pas moléculaire (H:).
L'alliage utilisé 1c1 à une
structure cubique dans laquelle les atomes de fer occupent les sommets de la
maille cubique et un
atome de titane son centre. Les sites octaédriques de la structure sont de deux
types : type À (situés au
milieu de chaque arête) et type B (situés au centre de chaque face).
lU.B. Demirci, Actualité Chimique 2008, 316,22-21.
Page 1/5
Q5- Représenter la maille cubique de l'alliage de fer/titane.
Q6- Calculer le paramètre de maille a associé à cette maille sachant que les
atomes de fer et de
titane sont en contact mais pas les atomes de fer entre eux.
Q7- Les sites octaédriques de type B sont-ils des octaèdres réguliers ?
Justifier. Ces derniers
seront-t-1ls déformés après introduction d'un atome d'hydrogène ? Justifier.
Q8- Des atomes d'hydrogène occupent la totalité des sites octaédrique de type
B. Indiquer le
nombre d'atomes de fer, de titane et d'hydrogène par maille. Justifier. En
déduire la formule de cet
« alliage hydrogéné ».
Q9- Calculer le volume molaire M du dihydrogène H: stocké dans ce composé en
supposant
qu'il en occupe tout le volume (on prendra pour valeur de a celle trouvée à la
question 6).
Comparer au volume molaire l, d'un gaz parfait à 7 = 25 °C et P= I bar.
Conclure.
Partie 2. Piles zinc-air
Les piles zinc-air sont des accumulateurs tirant leur énergie de l'oxydation du
zinc avec le dioxygène
de l'air ambiant (Figure 1). Ces piles possèdent de hautes densités
énergétiques et sont peu chères.
Leur format varie des piles boutons pour les audioprothèses à des formats
intermédiaires, pouvant être
utilisés dans des appareils tels les caméras, jusqu'aux grands formats
utilisables dans les véhicules
électriques.
À, et À: : revêtements métalliques, B : joint isolant, C :
orifice d'entrée d'air, D : membrane semi-splitéable,
E: dioxygène (air), F: membrane hydrophobe, G :
séparateur, H : poudre de zinc et électrolyte (solution
gélifiée de potasse).
Caractéristiques :
Force électromotrice : e= 1,6 V.
Réaction de fonctionnement :
2 ZN(s) + O2(o) > 2 ZnO4s)
Masse de zinc dans la pile : 0,65 g.
Masse de la pile : 1,0 g.
Intensité de fonctionnement : 0,80 mA.
Tension de fonctionnement : 1,5 V.
Figure I. Schéma et caractéristiques d'une pile bouton zinc-air.
Q10- Identifier l'anode et la cathode de cette pile et déterminer la polarité
de la pile. Justifier.
Q11- Calculer la force électromotrice standard e de cette pile à partir des
valeurs des potentiels
standards £° des couples redox.
Q12- Calculer l'enthalpie libre standard A;G de la réaction de fonctionnement
de la pile à 298 K
en utilisant les grandeurs thermodynamiques fournies (Annexe 3, page 5). En
déduire la valeur de
la constante Æ° de cette même réaction. Conclure.
Q13- Calculer la valeur de la force électromotrice standard à l'aide de la
valeur de A:@.
Q14- Calculer la durée théorique pendant laquelle cette pile peut fonctionner
sans être déchargée.
Q15- Calculer l'énergie que peut fournir cette pile.
Page 2/5
Partie 3 --- Energie du sportif
Le glucose, un sucre de formule brute CéH:06, est stocké chez les plantes sous
forme d'amidon et
chez les animaux sous forme de glycogène, qui peuvent être hydrolysés à tout
moment pour redonner
des molécules de glucose prêtes à être dégradées en fournissant de l'énergie
dès que la cellule en a
besoin. Nous allons nous intéresser au titrage du glucose dans un jus d'orange
selon le protocole
proposé dans le Document 1.
Document 1. Dosage du glucose présent dans du jus d'orange.
° Presser une demi-orange et filtrer sur Büchner sous pression réduite pour
récupérer le jus.
° Diluer 5 fois le jus d'orange. Cette solution est nommée (S1).
° En se plaçant en milieu basique, oxyder le glucose présent dans 1% = 20,0 mL
de la solution (SI) à
l'aide de 20,0 mL de solution aqueuse de diiode de concentration EUR = 5,00x10*
mol-L''. Dans cette
étape 1l se produit deux réactions :
Dismutation du diiode : 3 lag + 6 HO 9 7 5 lag + 103" (ag + 3 H204y
Réaction du glucose avec les ions iodates : 3 CéHi2O6ag + 103 (ag) 7 8
CéHi2O7(ag) + lag + 3 H204y
* Revenir en milieu acide pour reformer du diode par une réaction de
médiamutation :
6 Hag + 5 Pag + 103 (ay --7 8 lag + 8 H20(
* Titrer le diiode présent par une solution de thiosulfate de sodium à 0,100
mol-L-". On obtient un
volume équivalent Wa = 8,8 mL.
Q16- Déterminer le nombre d'oxydation de l'iode dans les trois espèces qui ont
pour formules DL,
I etIO;.
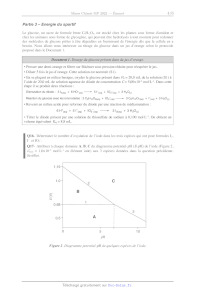
Q17- Attribuer à chaque domaine A, B, C du diagramme potentiel-bH (Æ-pH) de
l'iode (Figure 2,
Cirace = 1,/0X10* mol-L!' en élément iode) aux 3 espèces données dans la
question précédente.
Justifier.
0,68
0,5 -- À
0 5 10
PH
Figure 2. Diagramme potentiel-pH de quelques espèces de l'iode.
Page 3/5
Q18- Déterminer le coefficient directeur de la droite 2 à l'aide de la formule
de Nernst.
Q19- Écrire la réaction de titrage du diiode L: par les ions thiosulfate S>0:2.
Comment repère-t-on
l'équivalence du titrage ?
Q20- Calculer la concentration massique en glucose dans un jus d'orange.
Fin de l'épreuve
Page 4/5
Annexes
Annexe 1. Constantes usuelles et approximations de calcul.
Constante de Faraday : F = 10° C'mol!.
Constante d'Avogadro : MN, = 6.107 mol!.
Constante des gaz parfaits : R= 8 J-K '-mol !.
Approximations : V3 = 1,8 et V2 1,4.
Annexe 2. Données numériques.
Volume molaire d'un gaz parfait à 7= 25 °C et P= 1 bar: Wn = 24 L'mol ".
Numéro atomique : Z(B) = 5 ; Z(Fe) = 26 et Z(Ti) = 22.
Rayons métalliques : A(Fe) = 125 pm et A(Ti) = 145 pm.
Rayon atomique de l'hydrogène : R(H) = 35 pm.
Masses molaires : MZn) = 65 g-mol' ; Mglucose) = 180 g-mol.
Annexe 3. Données thermodynamiques à 298 K (valeurs arrondies).
Zn) O9) Zn0( H0(
AP (kJ-mol!)| 0 0 _350 300
S° (J-K'T-mol !) | 40 200 40 70
Potentiels redox standards à pH = 0 : £°(0,/H:0) = 1,23 V ; £(ZnO/Zn) = 043 V ;
F(S:06 /S20; )
= 0,08 V.
Page 5/5