CCINP Physique et Chimie MP 2015
| Thème de l'épreuve | Les aciers inoxydables et la corrosion. Autour de l'eau. |
| Principaux outils utilisés | thermodynamique, cristallographie, courbes courant-potentiel, diagrammes E-pH, thermodynamique |
| Mots clefs | loi de Newton, système ouvert, diagramme d'Amagat, coefficient compressibilité isotherme, diagramme de phase, échangeur thermique, isolation thermique, acier inoxydable, corrosion, corrosion intergranulaire, chrome, acier chromé, carbure de chrome |
Corrigé
:👈 gratuite pour tous les corrigés si tu crées un compte
👈 l'accès aux indications de tous les corrigés ne coûte que 1 € ⬅ clique ici
👈 gratuite pour tous les corrigés si tu crées un compte
- - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - -
👈 gratuite pour ce corrigé si tu crées un compte
- - - - - - - - - - - - - - - -
Énoncé complet
(télécharger le PDF)










Rapport du jury
(télécharger le PDF)




Énoncé obtenu par reconnaissance optique des caractères
SESSION 2015 MPPC003
_:â=_ CONCOURS COMMUNS
- - POLYTECHNIQUES
EPREUVE SPECIFIQUE - FILIERE MP
PHYSIQUE - CHIMIE
Durée : 4 heures
N.B. : le candidat attachera la plus grande importance à la clarté, a la
précision et a la concision de
la rédaction. Si un candidat est amené à repérer ce qui peut lui sembler être
une erreur d 'e'nonce', il le
signalera sur sa copie et devra poursuivre sa composition en expliquant les
raisons des initiatives
qu'il a été amené à prendre.
\ Les calculatrices sont autorisées
Le sujet est constitué de deux problèmes portant sur le programme de
physique--chimie.
NB : toute démonstration illisible ou incompréhensible sera considérée comme
fausse.
1/16
PROBLEME I. Les aciers inoxydables et la corrosion
Ce problème s'articule autour du rôle du chrome dans la corrosion
intergranulaire et se divise
en trois parties. La partie 1.A traite de quelques propriétés atomiques de
l'élément chrome.
La partie IB, composée de trois sous-parties indépendantes, propose l'étude du
processus de
corrosion intergranulaire. Enfin, la dernière partie porte sur l'étude
thermodynamique de la
formation des carbures de chrome.
Toutes les données nécessaires se trouvent au début de chaque partie. Tous les
gaz seront
considérés comme parfaits, les solutions idéales et les solides idéaux.
L'acier inoxydable est un alliage majoritairement composé de fer, de moins de
1,2 % (en masse)
de carbone et contenant également au moins 10,5 % (en masse) de chrome
nécessaire pour
garantir la formation d'une couche passive résistante a la corrosion. En effet,
au contact du
dioxygène, une couche d'oxyde de chrome va se créer a la surface du matériau.
Cette couche
protège alors l'acier et a la particularité de pouvoir s'auto--régénérer.
Bien que les aciers inoxydables résistent bien a la corrosion généralisée,
voire a la corrosion par
piqûres, ils peuvent effectivement présenter une forte sensibilité a une
attaque localisée le long
des joints de grains dans certains milieux : ce type d'attaque est appelé
corrosion intergranulaire.
Diverses causes peuvent être a l'origine de cette attaque mais le cas le plus
fréquemment ren--
contré est dû a l'état sensibilisé de l'acier : cet état est caractérisé par la
formation, contrôlée par
la diffusion, de composés riches en chrome, ce qui entraîne un appauvrissement
en cet élément
dans la matrice située de part et d'autre du joint de grain. Toutefois, un tel
état ne provoque
pas nécessairement une attaque : suivant le milieu en contact avec l'acier
inoxydable, il y a
ou non corrosion intergranulaire. Cela illustre bien que la sensibilité a ce
type de corrosion est
impérativement a associer a un couple matériau-milieu.
Partie 1.A. Autour de l'élément chrome
Données :
-- numéro atomique du molybdène Mo : Z = 42,
-- M(12C) : 12,0 g.mol_1,
-- nombre d'Avogadro NA : 6, 02.1023 mol--1.
1.1. Rappeler les règles quantiques usuelles pour établir une configuration
électronique d'un
atome dans son état fondamental.
1.2. Le chrome Cr se situe juste au--dessus du molybdène Mo dans la
classification périodique
des éléments. Déduire, en suivant les règles quantiques précédentes, la
configuration électronique
de l'atome dans son état fondamental et son numéro atomique Z. A quelle ligne
et a quelle
colonne de la classification périodique des éléments appartient le chrome ?
1.3. En réalité, la configuration électronique du chrome dans son état
fondamental fait ex--
ception a l'une des règles de remplissage et se termine par ns'(n -- 1)d5.
Justifier simplement
ce comportement particulier.
2/16
Le chrome existe sous plusieurs formes isotopiques dont les plus abondantes
sont données dans
le tableau ci--dessous :
Isotope 50Cr 52Cr 53Cr 54Cr
Abondance naturelle (%) 4,35 83,79 9,50 2,36
Masse atomique (u.m.a) 49,946 51,941 52,941 53,939
1.4. Définir le mot isotope. Donner la composition du noyau atomique de chacun
des isotopes
cités.
1.5. Calculer la masse atomique du chrome a l'état naturel. En déduire la
valeur de la masse
molaire atomique du chrome naturel en u.rn.a sachant que l'unité de masse
atomique (u.m.a)
représente 1 / 12 de la masse d'un atome de carbone 1âC.
Partie I.B. Corrosion intergranu]aîre d'un acier inoxy-
dable
Données :
-- a 298 K, on prendra : (RT/F)lnoe : 0,06 loga: en volt (V),
-- potentiels standards par rapport a l'électrode standard a hydrogène a 298 K :
+
Couples 02(g)/HZO HBO (aq_)/H2(g)
E0 (V) 1,23 0,00
-- R = 8,314 J.K_1.mol_l,
-- nombre d'Avogadro NA : 6, 02.1023 mol--1,
-- charge électrique élémentaire e = 1, 60.10_19 C,
-- masse volumique pc...-e,. : 8, 0.103 kg.rn_3,
-- rayons atomiques
Atome \ Ti \ C
Rayons (pm) \ 145 l 77 '
-- masses molaires atomiques
Atome \ Ti \ C \ Fe
Masse molaire (g.mol_l) \ 47,9 \ 12,0 \ 55,6
Dans un souci de simplification et de modélisation, l'acier inoxydable étudié
ici
sera uniquement composé de fer Fe, de carbone C et de chrome Cr avec une teneur
massique en chrome égale à 16,1 %.
Corrosion généralisée et acier inoxydable
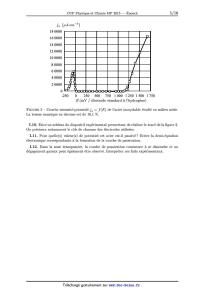
La figure 1, page 4, présente un diagramme simplifié potentiel -- pH du chrome
a 298 K. La
concentration des espèces dissoutes étant de 1 mol.L_1, ce dernier fait
intervenir 6 espèces :
Cr< Cr2+ Cr3+ Cr203(s),CrZO%_( )et CrOÎ< s)7 (aq.)7 (aq.)7 aq. aq.)' 3/16 A E (V) 2;)-- 15--- ---- -- -- -- -- __ -- -- -- -- -- -- -- ---- ---- ---- -- -- -- -- -- -- -- -- -- -- -- -- -- -- -- -- -- -- __ --_ ' _075 __ _170 __ ---L5---- }; ___ _270 __ _275 __ FIGURE 1 -- Diagramme simplifié potentiel -- pH du chrome a 298 K. 1.6. Indiquer pour chacun des domaines (A, B, C, D, E, F) du diagramme l'espèce chimique correspondante. 1.7. Sur ce diagramme ont été portées deux droites en pointillés délimitant le domaine de stabilité thermodynamique de l'eau. Rappeler les équations de ces deux droites en utilisant les conventions habituelles. 1.8. Discuter du comportement du chrome métallique dans une eau désaérée et dans une eau aérée. Une couche de passivation dite native se forme toujours a la surface d'un acier inoxydable. Lorsque celui--ci est en présence d'une solution dont la valeur du pH est égale a 6, l'acier inoxydable résiste toujours très bien a l'oxydation. 1.9. Quel oxyde de chrome est responsable de la passivation ? Quelle est la conséquence pour l'acier inoxydable étudié? Pour étudier le comportement de cet acier, on plonge un échantillon de matériau dans une solution aqueuse acide et on fait varier lentement le potentiel tout en mesurant l'intensité du courant électrique issue des réactions électrochimiques qui se produisent. On obtient le tracé de la courbe intensité--potentiel ja : f (E) (voir figure 2, page 5) sur laquelle 3 zones se distinguent nettement : une zone de corrosion, une zone de passivation et une zone dite transpassive. 4/16 ja (uA.cm_2) 18 0000 16 0000 E' 14 0000 / 12 0000 J/ 10 0000 ) 8 0000 /r( 6 0000 "' 4 0000 & F 2 0000 &: a £ 0 EüNfiOEJÛD-Ü-Üü-Ü -250 0 250 500 750 1000 1250 1500 1750 E (mV / électrode standard a l'hydrogène) FIGURE 2 -- Courbe intensité-potentiel ja : f (E) de l'acier inoxydable étudié en milieu acide. La teneur massique en chrome est de 16,1 %. 1.10. Faire un schéma du dispositif expérimental permettant de réaliser le tracé de la figure 2. On précisera notamment le rôle de chacune des électrodes utilisées. 1.11. Pour quelle(s) valeur(s) de potentiel cet acier est--il passivé? Ecrire la demi--équation électronique correspondante a la formation de la couche de passivation. 1.12. Dans la zone transpassive, la couche de passivation commence a se dissoudre et un dégagement gazeux peut également être observé. 1nterpréter ces faits expérimentaux. 5/16 Rôle du chrome dans la corrosion intergranulaire Document n0 1 - Corrosion intergranulaire et joints de grain Les joints de grains sont des zones particulières : elles séparent des grains d'orientation cris-- tallographique différente et constituent des sites favorables a la précipitation des carbures de chrome. Le cas le plus fréquent de corrosion intergranulaire est celui d'un alliage dit sensibilisé. Le phénomène de sensibilisation consiste en la précipitation, aux joints de grains, de composés riches en chrome : les carbures de chrome Cr23C6(S) dont la teneur massique est très élevée (95 % en chrome). La matière adjacente se trouve alors appauvrie en cet élément : sa teneur en chrome passant sous le seuil critique des 12 % reconnu comme un minimum pour pouvoir développer une passivité stable. La précipitation des carbures de chrome appauvrit en chrome les zones proches des joints de grain. En effet, en raison de leur plus grande taille, les atomes de chrome diffusent plus lentement que les atomes de carbone. Or, une faible teneur en chrome rend la passivation difficile. Ainsi, sous certaines conditions, les zones appauvries près des joints de grain deviennent alors actives, alors que le coeur du grain reste passif : il se forme ainsi une pile de corrosion. La sensibilisation de l'acier est la conséquence d'un chauffage et d'un maintien suffisamment long entre 500 et 800 0C, d'un traitement d'hypertrempe (chauffage vers 1 050 °C) suivi d'un refroidissement trop lent. Cette sensibilisation peut aussi être provoquée par l'opération de soudage dans une zone (ayant atteint une température comprise entre 500 et 800 °C) appelée zone affectée thermiquement (ZAT) ou zone affectée par la chaleur (ZAC). Grain d'acier inoxydable Joint de grain Le point A se trouve au sein d'un grain, le point B appar-- tient a un joint de grain (en présence de carbure de chrome), le point C se trouve a proxi-- mité d'un joint de grain et le point D appartient a un joint de grain (en l'absence de carbure de chrome). FIGURE 3 -- Photographie de la structure d'une pièce en acier inoxydable soumis a la corrosion intergranulaire. 6/16 Document n0 2 - Représentation de la déchromatisation aux joints de grain par suite de la précipitation de carbures de chrome l l 1-- "l: A% CI' |. __________ --------r -------------------- 95% \ II III II I , Domaines FIGURE 4 -- Evolution de la teneur en chrome dans une pièce d'acier inoxydable soumis a la corrosion intergranulaire (échelle des ordonnées non respectée). Document no 3 - Influence de la teneur en chrome dans un acier inoxydable ja (,uA.cm_2) 101xx1000 1000000 ,.- _\---"'. ., " 100 000 "'" ' | { {' f\. \ '. ,» ___:-- 10000 7'/\\"=' \ \\ ---- _-- 1000 _ '= '\' \- .___ .: \ '. \ . /.i 100 _ ""'. Q _.' 1g2%(1 10 \ -- -- ---" -------OEJ%Kä \\ ; ----11,7%Cr 1 \ _';;7 -- - ZM%ü ... \\__,, --"--3,5%Cr -250 0 250 500 750 1 000 1_250 1 500 1 750 E (mV / électrode standard à l'hydrogène) FIGURE 5 -- Courbes intensité--potentiel ja : f(E) d'aciers inoxydables en milieu aqueux acide en fonction de leur teneur en chrome. L'échelle utilisée sur l'axe des ordonnées est logarithmique. 7/16 Document n0 4 - Utilisation d'une échelle logarithmique Pour lire des valeurs sur une échelle logarithmique, on procède de la manière suivante : -- soit L la distance (cm, mm, m,...) entre deux graduations (1 a 10, 10 a 100, ..)., -- soit EUR la distance (cm, mm, m, . . .) de la graduation de gauche au point qui vous intéresse. On calcule désormais le terme 10É/L. En multipliant par la graduation de gauche (1, 10, 100, . . .) par 10" L , on trouve la valeur du point recherché. V L=5cmetë=3,4cm < > _X=10XNMÆ=48
10 X 100
FIGURE 6 -- Lecture sur une échelle logarithmique.
1.13. Sachant que le carbure de chrome est une espèce inerte, expliquer
pourquoi l'existence de
ce précipité au niveau du joint de grain est responsable de l'apparition d'une
pile de corrosion.
Préciser alors où se trouvent les zones anodique et cathodique a l'aide d'un
schéma succinct.
1.14. A quel(s) domaine(s) de la figure 4 (document no 2, page 7) appartiennent
les points
A, B et O relatifs au document no 1 (page 6) ? Justifier succinctement.
On souhaite fabriquer une pièce dont la durée de service en milieu acide est
estimée a 4 000 heures
et fonctionnant sous un potentiel de 750 mV/E.S.H. On définit a ce stade la
densité de courant
anodique ja et le volume du matériau V concerné lors de l'étude :
i
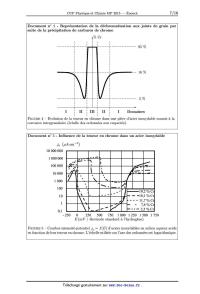
' = --a et V = S >< 5 Ja S 1.15. Exprimer l'épaisseur de fer dissout notée 5 en fonction notamment de la densité de courant anodique ja, de la masse volumique de l'acier pacier, de la durée de fonctionnement At et de la masse molaire du fer MPG. On supposera que le fer s'oxyde en ions fer 11 et la masse de fer oxydée sera assimilée a celle de l'acier. 1.16. Calculer alors l'épaisseur 5 de la couche attaquée après 4 000 heures de fonctionnement pour l'acier inoxydable étudié. 1.17. Sachant qu'une pièce en acier inoxydable n'est plus utilisable si l'épaisseur de la couche attaquée est de l'ordre de 100 mn, vérifier que la teneur en chrome de celle--ci est inférieure a 12 %. Prévenir le risque de corrosion intergranulaire La compréhension des mécanismes de corrosion intergranulaire des aciers inoxydables suggère plusieurs remèdes efficaces a mettre en oeuvre pour prévenir cette forme d'attaque localisée : 8/16 -- prolonger le traitement thermique pour homogénéiser la teneur en chrome et com-- bler le gradient de concentration au voisinage des joints de grain où les carbures de chrome peuvent se former. Cependant, cette solution implique des durées longues (1 000 heures) et non réalistes en pratique, -- réduire la teneur en carbone a une valeur suffisamment faible pour ne pas risquer une précipitation de carbures de chrome aux joints de grain : une teneur inférieure a 0,03 % en masse se révèle satisfaisante, -- ajouter des éléments dont l'affinité pour le carbone est supérieure a celle du chrome : c'est le cas du titane Ti, du niobium Nb, du vanadium V ou encore du tantale Ta qui peuvent donner naissance a des carbures. Le carbure de titane cristallise dans une structure où les atomes de titane Ti forment un réseau cubique a faces centrées et les atomes de carbone C sont localisés dans les interstices octaédriques. Les atomes seront assimilés a des sphères parfaites. I. 18. Donner une représentation de la maille du carbure de titane. En déduire la stoechiométrie de ce composé. 1.19. Calculer le paramètre de maille idéal & de la structure considérée. 1.20. Exprimer puis calculer la masse volumique du carbure de titane p. Partie I.C. Etude thermodynamique de la formation des carburesckachronua Données : -- R = 8,314 J.K_1.mol_l, -- Crandeurs thermodynamiques : Composés C(S) O2( CO(g) COZ(g) AfH° (kJ.mol_l) 0 0 -- 110,5 -- 393,5 Si,, (J.mol_l.K_l) 5,7 205,0 197,6 213,6 où AfHO et SS,, sont respectivement l'enthalpie molaire standard de formation et l'entropie molaire standard des espèces considérées a 298 K supposées indépendantes de la température. On se propose de déterminer les conditions de pression nécessaires pour obtenir du chrome Cr S) ou du carbure de chrome Cr23C6(S) a partir du sesquioxyde de chrome Cr203(8), a 1 273 K et en présence de carbone graphite. On considère pour cela les équilibres suivants : 1 î2Cr +--32() ==CrC) .A(ÿïT==-1]2OZW)+:Æ9sOE3T in...r4 (@ 2e) 2 3oe> r 1
2 23Cä -+6(3 ==Ck c zÀC?îT =-4u1130-3a6a3T in...rfl
@) (@ 23 «a r 2
1.21. Déterminer la valeur de la constante d'équilibre thermodynamique K1 a 1
273 K de la
réaction de formation du sesquioxyde de chrome Cr203(s). En déduire la pression
de dioxygène
pËÏ a l'équilibre.
1.22. Ecrire la réaction de formation du carbure de chrome Cr23C6(S), notée
(3), a partir du
sesquioxyde de chrome Cr203(s) et du carbone graphite C(S).
9/16
1.23. Etablir l'expression de l'enthalpie libre standard A,GË(T ) et la valeur
de la constante
d'équilibre thermodynamique K3 a 1 273 K. En déduire la pression de dioxygène
pË'î a l'équilibre.
1.24. Quelle est l'influence de la température sur la réduction du sesquioxyde
de chrome
Or2O3(S) par le carbone graphite O(S) ?
1.25. On impose une pression partielle en dioxygène p02 supérieure a la
pression en dioxygène
a l'équilibre (3). Quel est le signe de l'enthalpie libre de réaction associée
a (3) pour ce système ?
Déduire le sens d'évolution de ce dernier et préciser l'espèce chimique stable
du chrome a cette
température et sous cette pression.
1.26. Tracer le diagramme d'existence des espèces a base de chrome en fonction
de la pression
partielle en dioxygène 1902 en présence de carbone graphite. Commenter.
PROBLEME 11. Autour de l'eau
Oe problême comporte trois parties s'articulant autour d'un thème commun :
l'eau.
Dans la première partie du problème, on s'intéresse a quelques propriétés
générales de l'eau.
Dans la seconde partie, on étudie un échangeur, organe présent dans de
nombreuses installations
utilisant les propriétés thermiques de l'eau. Dans la troisième partie, on
cherche a isoler une
canalisation d'eau des pertes thermiques.
NB : il est recommandé de parcourir l'intégralité du problème avant de
commencer. Les parties
étant indépendantes les unes des autres, elles peuvent être abordées dans un
ordre quelconque.
Partie 11.A. Propriétés physiques de l'eau
11.1. Quelques propriétés de la glace
11.1.a. Dessiner le diagramme de phase p(T ) de l'eau en plaçant les domaines
solide, liquide
et gaz ainsi que les points triple et critique.
11.1.b. On donne :
-- les coordonnées du point triple de l'eau : TT : 273, 16 K; pT : 611 Pa;
-- la pression de fusion a TO : 273,15 K : po : 101 325 Pa.
En assimilant la courbe de fusion de l'eau a une droite d'équation pfus(en MPa)
: & >< T + b, déterminer les expressions de a et b en fonction de pT, po, TT et T 0 ainsi que leur valeur numérique. 11.1.c. Application : la glace d'une patinoire est a --5 0O. La pression exercée par un patineur est--elle suffisante pour former un film de liquide sur lequel les patins vont glisser? On attend une réponse se basant sur un raisonnement quantitatif, mettant en jeu des ordres de grandeur réalistes. Le cas échéant, expliquer qualitativement par quel(s) phénomènes(s) physique(s) se forme le film d'eau liquide. 11.2. Quelques propriétés de la vapeur d'eau 11.2.a. Donner l'équation d'état des gaz parfaits qui relie la pression p, le volume massique o, la masse molaire M, la température T et la constante des gaz parfaits R. 10/16 II.2.b. Afin de quantifier le caractère compressible de l'eau, on définit le coefficient de com-- _ _ _ , _ 1 Ô?) . . . . , press1b1hte isotherme : XT : ---- ô_ . Montrer que pour un gaz parfait la compressflmhte ?) p T isotherme est donnée par : XT,GP : 1/p. 11.3. Le document n°5 ci--dessous donne l'allure des isothermes de l'eau en coordonnées d'Ama-- gat, c'est--à--dire le graphe portant le produit p v en fonction de p, pour différentes températures. On se propose de justifier certaines affirmations données dans le texte accompagnant le graphe, marquées en gras. II.3.a. Justifier les affirmations ]1] et ]3] du document n°5 (ci--dessous). 1 Ô II.3.b. Montrer que : -- (Æ) : 1--X--T. Justifier alors l'affirmation ]2] du document @ Ôp ]. Xnop n°5 (ci--dessous). Document no 5 : isothermes en coordonnées d'Amagat }? ?) A T > Tcm't
\\
\
\
\
\
\
\' Courbe de Boyle Term;t
\\ |
' |
Il T < TCT"Ît z," --' \ Courbe de saturation > P
Texte accompagnant le graphe :
La représentation d'Amagat met particulièrement bien en évidence les écarts a
la loi des gaz
parfaits pour lesquels les isothermes sont des droites horizontales [1] . Quand
la pression
tend vers zéro, le gaz tend vers l'état parfait et l'ordonnée po a l'origine
est proportionnelle a
la température absolue T du fluide. On peut distinguer plusieurs zones par leur
température :
-- a très haute température, pv est une fonction croissante de p : le fluide
est moins
compressible qu'un gaz parfait [2].
-- a des températures plus basses, pv est une fonction de p qui présente un
minimum. Au
voisinage de ce minimum, pv varie peu et le fluide se comporte comme un
gaz parfait [3]. Le lieu des minima de po est une courbe d'allure parabolique,
appelée
courbe de Boyle.
11/16
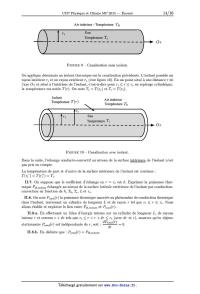
Partie II.B. Echangeur thermique
L'échangeur thermique est un organe fréquemment utilisé dans les installations
thermiques. On
le trouve dans des pompes a chaleur, des machines a froid ou certains cumulus
d'eau chaude.
Le principe d'un échangeur thermique est de permettre le transfert d'énergie
thermique entre
deux fluides. Dans l'étude menée ici, ce sont :
-- l'eau glycolée circulant dans le cumulus d'eau chaude d'une part;
-- l'eau a usage domestique d'une habitation d'autre part.
Ces deux liquides, supposés indilatables et incompressibles, sont mis en
contact thermique au
sein de l'échangeur via des canalisations dans lesquelles ils se déplacent en
sens opposé. C'est
dans la zone active de l'échangeur, représentée sur les figures 7 et 8
ci--dessous, que s'opère le
transfert thermique entre les deux fluides. Hormis sur leur surface commune,
les canalisations
sont calorifugées.
Zone actiüe de
T17h1731 / IDEbhangeü
Ecoüement \
dEéaDglü:olüe
_, '< Ecoüement düeaD Ecoulement ________________ d'eau glycolée ' T2) h27 52 -->
Ecoulement d'eau
/
4--
T47 h47 84
FIGURE 8 -- Echangeur a l'instant final.
On note alEUR et alg respectivement le débit massique d'eau et d'eau glycolée.
On note également
T,, h,, 8,- respectivement : la température, l'enthalpie massique, l'entropie
massique du fluide
désigné par 2' EUR {1,2;3;4}, sachant que :
-- 2' = 1 fait référence a l'entrée d'eau glycolée dans la zone active.
-- 2' = 2 fait référence a la sortie d'eau glycolée de la zone active.
-- 2' = 3 fait référence a l'entrée d'eau dans la zone active.
-- 2' = 4 fait référence a la sortie d'eau de la zone active.
Les écoulements sont supposés horizontaux et en régime stationnaire. On néglige
la variation
d'énergie cinétique des fluides lors de leur passage dans l'échangeur.
II.4. Bilan d'enthalpie
On donne l'expression du premier principe de la thermodynamique pour un système
ouvert en
écoulement permanent :
î: dk! hk/ -- î: dk hk = Pu +pth , (4)
He Sorties ke Entrées
12/16
où pu désigne la puissance massique échangée entre le système et les parois
mobiles qui le
délimitent et pt}, est la puissance massique échangée entre le système et
l'extérieur par transfert
thermique.
II.4.a. Donner la signification physique des termes du membre de gauche de
l'égalité (4).
II.4.b. On note cEUR et cg respectivement la capacité thermique massique de
l'eau et de l'eau
glycolée. Déterminer la relation entre : cg, ce, dg, de, T1, T 2, T 3 et T 4.
Il est attendu de définir
très clairement le système d'étude.
II.4.C. On donne : cg : 3, 29 kJ.kg_1.K_l, cEUR : 4, 18 kJ.kg_1.K_l, dg : 10,
0kg.s_1,
T1 : 10,0 OO, T2 : 15,0 OO, T3 : 15,0 0O et T4 : 12,0 OO. Calculer
numériquement le
débit massique d'eau de.
11.5. Bilan d'entropie
II.5.a. Ecrire une relation analogue a (4) traduisant le second principe de la
thermodyna--
mique pour un système ouvert en écoulement permanent et donner la signification
physique de
chacun des termes intervenant dans cette relation.
II.5.b. Déterminer l'expression du taux de création d'entropie par unité de
temps dans
l'échangeur. Effectuer l'application numérique et indiquer l'origine physique
de l'irréversibilité
le cas échéant.
Donnée : l'entropie d'un corps indilatable et incompressible, de capacité
thermique massique c
et de température T, est donnée, a une constante additive près, par : S(T ) :
clnT + cte.
Partie ILO. Isolation thermique d'une canalisation d'eau
Après avoir transité dans l'échangeur thermique, l'eau alimente le réseau d'une
habitation.
Afin de limiter les pertes thermiques dans les canalisations, on se propose,
dans cette partie,
d'étudier quelques solutions d'isolation thermique.
La canalisation est cylindrique, d'axe Oz, de rayon 7°,- et de longueur L >>
?",-. L'eau y circulant
est a la température T,. L'objectif de cette partie est de comparer les pertes
latérales de la
canalisation sans ou avec un isolant.
On adopte le modèle suivant :
-- seule la conduction thermique radiale, c'est--à--dire dans une direction
perpendiculaire a
l'axe Oz, est prise en compte. On néglige donc la conduction selon l'axe Oz;
-- la température de l'eau dans la canalisation est supposée uniforme. La
conduction radiale
s'opère donc pour 7° 2 7",- uniquement;
-- l'étude est menée en régime stationnaire;
-- on néglige l'épaisseur de la paroi de la canalisation.
Sans isolant (figure 9, page 14), la canalisation est en contact avec l'air
intérieur de l'habitation,
de température T @.
11.6. La densité surfacique de puissance thermique échangée par transfert
conducto--convectif
au niveau de la surface latérale de la canalisation est donnée par jê : h (T,-
-- T 0) u? (loi de
Newton), où h est une constante dimensionnée appelée coefficient d'échange et
u? le vecteur
unitaire radial de la base cylindrique. Exprimer la puissance thermique P...
transférée au niveau
de la surface latérale du système.
13/16
Air intérieur - Température TO
74 Eau
"&
Température T,;
FIGURE 9 -- Oanalisation sans isolant.
On applique désormais un isolant thermique sur la canalisation précédente.
L'isolant possède un
rayon intérieur 7°Z- et un rayon extérieur 7°EUR (voir figure 10). En un point
situé a une distance 7° de
l'axe 07: et situé a l'intérieur de l'isolant, c'est--à--dire pour 7°Z- $ 7° £
7°EUR en repérage cylindrique,
la température est notée T(7°). On note TEUR : T(7°e) et Ti : T(7°i).
ISOlEUR1ÏÏt Air intérieur
Temperature T("" )
Température TO
fre "
Température Ti
- -- -- -- ---------------------------------- Oz
FIGURE 10 -- Oanalisation avec isolant.
Dans la suite, l'échange conducto--convectif au niveau de la surface intérieure
de l'isolant n'est
pas pris en compte.
La température de part et d'autre de la surface intérieure de l'isolant est
continue :
T(7°5)=T(7°'") =Ti.
%
II.7 . On suppose que le coefficient d'échange en 7° : 7°EUR est h. Exprimer la
puissance ther--
mique Pth,isolant échangée au niveau de la surface latérale extérieure de
l'isolant par conduction--
convection en fonction de h, T 0, T 6, L et 7°EUR.
II.8. On note Pcond(7°) la puissance thermique associée au phénomène de
conduction thermique
dans l'isolant, traversant un cylindre de longueur L et de rayon 7° tel que
7°Z- $ 7° £ 7°EUR. Nous
allons établir et exploiter le lien entre Pth,isolant et Pcond(7°).
II.8.a. En effectuant un bilan d'énergie interne sur un cylindre de longueur L,
de rayons
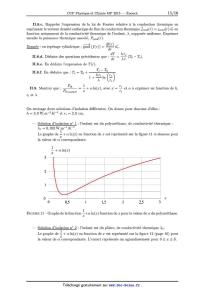
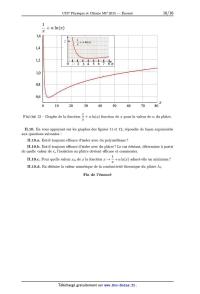
interne 7° et externe 7° + d7° tels que 7°Z- $ 7° < 7° + d7° £ 7°EUR (avec d7° << 7°), montrer qu'en régime chond(T) _ 0 d7° _ ' stationnaire Pcond(7°) est indépendante de 7°, soit : II.8.b. En déduire que : Pcond(7°) : Pth,isolant. 14/16 II.8.e. Rappeler l'expression de la loi de Fourier relative a la conduction thermique en exprimant le vecteur densité surfacique de flux de conduction thermique Îcond(7°) : jcond(7°) u? en fonction notamment de la conductivité thermique de l'isolant, À, supposée uniforme. Exprimer ensuite la puissance thermique associé, Pcond(7°). % d Donnée : en repérage cylindrique : grad (f (T)) : 20°) 75}. 7° dT h 6 II.8.d. Déduire des questions précédentes que : d_ : ÀT (T 0 -- T 6). 7° 7° II.8.e. En déduire l'expression de T (7°) T,- -- T II.8.f. En déduire que : TEUR : T0 + h7° 0 7° . 1 6 l --e + À n (72) Pth Te \ . . II.9. Montrer que : _ = -- + ozln(a:), avec a: = -- et oz a exprimer en fonction de h, th,isolant 33 T7 7°,- et À. On envisage deux solutions d'isolation différentes. On donne pour chacune d'elles : h = 3, OVV.m_2.K_1 et 7°,- : 2,0 cm. -- Solution d'isolation no 1 : l'isolant est du polyuréthane, de conductivité thermique : ,M;=oxn5vkm--äK--ë 1 Le graphe de -- + oz ln(a:) en fonction de a: est représenté sur la figure 11 ci--dessous pour la valeur de oz correspondante. 1 -- l æ + oz n(æ) 3 2 1 0 $ 0 0,5 1 1,5 2 2,5 3 1 FIGURE 11 -- Graphe de la fonction --+d ln(a:) fonction de a: pour la valeur de oz du polyuréthane. &: -- Solution d'isolation no 2 : l'isolant est du plâtre, de conductivité thermique À2. 1 Le graphe de -- + oz ln(a:) en fonction de a: est représenté sur la figure 12 (page 16) pour a: la valeur de oz correspondante. L'encart représente un agrandissement pour 0 S a: S 8. 15/16 1,0 0,8 0,6 ZE 0 10 20 30 40 50 60 70 80 1 FIGURE 12 -- Graphe de la fonction -- + ozln(a:) fonction de a: pour la valeur de oz du plâtre. &: 11.10. En vous appuyant sur les graphes des figures 11 et 12, répondre de façon argumentée aux questions suivantes : 11.10.21. Est--il toujours efficace d'isoler avec du polyuréthane? II.10.b. Est--il toujours efficace d'isoler avec du plâtre ? Le cas échéant, déterminer a partir de quelle valeur de re l'isolation au plâtre devient efficace et commenter. 1 11.10.c. Pour quelle valeur a:... de a: la fonction a: --> -- + oz ln(a:)
admet--elle un minimum ?
&:
11.10.d. En déduire la valeur numérique de la conductivité thermique du plâtre
À2.
Fin de l'énoncé
16/16
IMPRIMERIE NATIONALE -- 151312 -- D'aprèsdocumentsf0urnis