CCINP Physique et Chimie MP 2016
| Thème de l'épreuve | Étude thermique d'un bâtiment. L'eau de Javel. |
| Principaux outils utilisés | diffusion thermique, électricité, cristallographie, solutions aqueuses, cinétique chimique, oxydoréduction, diagrammes E-pH, thermodynamique |
| Mots clefs | isolation, résistance thermique, capacité thermique, Javel, eau de Javel, hypochlorite |
Corrigé
:👈 gratuite pour tous les corrigés si tu crées un compte
👈 l'accès aux indications de tous les corrigés ne coûte que 1 € ⬅ clique ici
👈 gratuite pour tous les corrigés si tu crées un compte
- - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - -
👈 gratuite pour ce corrigé si tu crées un compte
- - - - - - - - - - - - - - - - - - - - -
Énoncé complet
(télécharger le PDF)













Rapport du jury
(télécharger le PDF)






Énoncé obtenu par reconnaissance optique des caractères
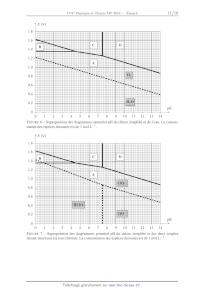
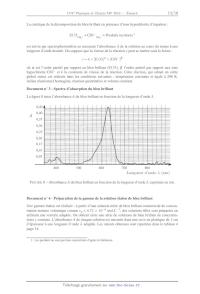
SESSION 2016 MPPC003 ! ! ! EPREUVE SPECIFIQUE - FILIERE MP! !!!!!!!!!!!!!!!!!!!!" ! PHYSIQUE - CHIMIE Mercredi 4 mai : 8 h - 12 h! !!!!!!!!!!!!!!!!!!!!" N.B. : le candidat attachera la plus grande importance à la clarté, à la précision et à la concision de la rédaction. Si un candidat est amené à repérer ce qui peut lui sembler être une erreur d'énoncé, il le signalera sur sa copie et devra poursuivre sa composition en expliquant les raisons des initiatives qu'il a été amené à prendre.! ! !!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!" " ! ! ! Les calculatrices sont autorisees ! ! ! ! ! ! ! Le sujet est compose de deux problemes independants. ! ! ! ! ! ! ! ! ! ! ! ! ! ! ! ! ! ! 1/15 A ! PROBLEME I - PHYSIQUE Etude thermique d'un batiment Avec les nouvelles normes environnementales et les diagnostics de performance energetique des batiments, la cartographie thermique permet de localiser les zones de deperdition thermique les plus importantes. On peut ensuite cibler les travaux d'isolation a effectuer en toute connaissance de cause. L'isolation peut s'effectuer par l'interieur ou l'exterieur avec des materiaux adequats. On pourra alors verifier, a reception des travaux, l'efficacite de ces derniers. F IGURE 1 Thermographie infrarouge. !"#$%&'(#)%"# *$+,#'%$)-%#')% 3&'(#)%"# +#,)2 .4,51-' )-'(#)%"# .-'(#)%"#$ /01"2 .4,51-' %&'(#)%"# !"#$)-'(#)%"# *$+,#'%$)-%#')% 3&'(#)%"# +#,)2 85"&$'0%#9):"% .-'(#)%"#$ /01"2 85"&$'0%#9):"% 16$ 76$ F IGURE 2 Isolation a) par l'interieur ou b) par l'exterieur. 2/15 Preambule I.1. Modelisation de la piece On etudie une piece parallepipedique de longueur a = 8 m, de largeur b = 5 m, de hauteur h = 2, 5 m et possedant un radiateur electrique de puissance maximale P = 2 kW. Dans l'ensemble du probleme, la piece sera supposee parfaitement isolee au niveau du sol et du plafond. La capacite thermique volumique de l'air est Cv = 1, 25 · 103 SI. On suppose ici que la piece est parfaitement calorifugee. I.1.a. Quelle est l'unite de la capacite thermique volumique ? Quelle est la valeur de la capacite thermique C de la piece ? I.1.b. A l'aide d'un bilan d'energie thermique applique a la piece, etablir l'equation differentielle regissant l'evolution de la temperature T (t) dans la piece en fonction de C et de P. I.1.c. Resoudre l'equation sachant que la temperature initiale de la piece est T0 = 10 C. Tracer T (t). Determiner la duree necessaire pour atteindre la temperature finale T f = 20 C. I.1.d. Proposer un modele electrique simple conduisant a une equation differentielle du meme type. Preciser quelles sont les grandeurs electriques associees aux grandeurs thermodynamiques que sont T (t), C et P. Dessiner le montage electrique analogue. I.2. Influence des murs La piece est constituee d'une enceinte en beton d'epaisseur L = 15 cm et de masse volumique = 2, 2 · 103 kg.m-3 . On note c = 1, 0 · 103 J.kg-1 .K-1 sa capacite thermique massique et sa conductivite thermique ( = 1, 5 SI). I.2.a. Exprimer l'aire S p de la surface en contact avec la piece en fonction de a, b et h, en negligeant l'epaisseur des murs. Faire l'application numerique. I.2.b. Exprimer le volume de beton Vb et la capacite thermique Cmur de l'enceinte en beton en fonction de S p , L, et c. Comparer numeriquement Cmur a la capacite thermique de la piece C. Par rapport a ces premiers resultats, quels commentaires pouvez-vous faire sur la duree de montee en temperature de la piece en prenant en consideration l'influence de la capacite thermique du mur ? Premiere partie : equation de la chaleur On etudie la conduction thermique dans le mur modelise par une barre de section S, de longueur L en contact avec deux thermostats de temperatures Tint et Text (voir figure 3, page 4). On note : J = j(x,t)ex le vecteur densite de flux thermique. 3/15 !"#$ %&'(!"# S Tint x x + dx 0 Text L x F IGURE 3 Modelisation du mur. I.3. Generalites I.3.a. Rappeler la loi de Fourier. Interpreter son signe. Donner une signification physique de j(x,t) et preciser son unite. Quelle est la dimension de la conductivite thermique ? En deduire son unite dans le systeme internationnal. I.3.b. A l'aide d'un bilan d'energie thermique sur la tranche comprise entre les abscisses x et x + dx du mur, etablir l'equation de diffusion thermique c'est-a-dire l'equation differentielle regissant l'evolution de la temperature T (x,t) a l'interieur du mur en fonction de , c, et . I.4. Etude du regime stationnaire I.4.a. Rappeler la signification de "regime stationnaire". I.4.b. Les temperatures de surface seront prises egales a celles des thermostats. Resoudre l'equation de la diffusion thermique et determiner alors T (x) la temperature a l'interieur du mur a l'abscisse x. Tracer T (x). I.4.c. Definir et exprimer la temperature moyenne du mur notee Tmoy . Indiquer la position particuliere x p ou la temperature est egale a la temperature moyenne. I.4.d. Exprimer la densite de flux j(x) qui traverse le mur. Que remarquez-vous ? I.4.e. Calculer la puissance P que le radiateur doit fournir afin de maintenir la temperature interieure a 20 C pour une temperature exterieure de 10 C. Commenter ce resultat par rapport au radiateur installe. I.5. Resistance thermique V On definit en electricite la resistance d'un conducteur ohmique en convention recepteur par R = I ou V est la difference de potentiels aux bornes de la resistance et I l'intensite du courant electrique qui traverse le conducteur (figure 4). I R V F IGURE 4 Resistance. 4/15 I.5.a. Rappeler l'expression de la loi d'Ohm locale pour un conducteur de conductivite electrique . En faisant l'analogie entre la loi d'Ohm et la loi de Fourier, indiquer a quelles grandeurs thermodynamiques sont analogues la conductivite electrique, la densite de courant electrique, le potentiel electrique et l'intensite du courant. Donner cette reponse sous la forme d'un tableau recapitulatif. I.5.b. Par analogie, donner l'expression de la resistance thermique Rmur du mur etudie. Preciser son unite et calculer sa valeur. Deuxieme partie : modelisation electrique Dans cette partie, on travaillera avec la temperature moyenne du mur. On modelise l'ensemble du systeme, compose de la piece, du mur et du radiateur, par un reseau electrique. Le but est d'etudier le comportement dynamique de ce systeme via sa fonction de transfert. I.6. Circuit electrique Dans l'approche electrique, la modelisation du systeme conduit au circuit electrique donne figure 5. R1 i(t) C1 R2 C2 u1 (t) u2 (t) F IGURE 5 Modele electrique. I.6.a. Justifier cette modelisation electrique par rapport a notre etude thermique de la premiere partie. Expliciter les valeurs de I, R1, R2 ,C1 ,C2 , u1 (t) et u2 (t), en fonction des grandeurs P, Rmur , C, Cmur , la temperature de la piece T (t), la temperature moyenne du mur Tmoy (t) et la temperature exterieure Text . I.6.b. Que devient ce circuit electrique en regime permanent continu ? Exprimer alors la tension u2 (t - ). Quelle valeur attribueriez-vous a R1 et a R2 en fonction de Rmur ? I.7. Etablissement de l'expression d'une impedance Afin d'etudier le comportement du circuit en regime variable, on se place en regime sinusoidal force x(t) de pulsation dont la grandeur complexe associee est notee x(t) et l'amplitude complexe est X avec : x(t) = X0 cos( t + ) = Re(x(t)) , x(t) = X0 e j( t+ ) = X e j( t) , X = X0 e j( ) . La reference de phase sera prise sur la grandeur i(t) delivree par le generateur de courant : i(t) = I0 cos( t) . 5/15 I.7.a. Exprimer l'impedance Z2 relative a l'association de la resistance R2 avec le condensateur de capacite C2 . I.7.b. Exprimer l'impedance Z1 relative a l'association de la resistance R1 avec l'impedance Z2 . I.7.c. Exprimer le lien i(t), u1 (t), Z1 , C1 et . I.7.d. En deduire que la relation reliant U1 ( j ) a I0 est donnee par : U1 ( j ) = R2 C2 1 + j RR11+R 2 1 + j((R1 + R2 )C1 + R2C2 ) - R1 R2C1C2 2 (R1 + R2 )I0 . (1) I.8. Exploitation I.8.a. Verifier la coherence entre la fonction donnee par (1) et les comportements du circuit pour les hautes et basses frequences. Exprimer en fonction des donnees, U10 , la valeur de U1 ( j ) pour = 0. I.8.b. Verifier les comportements limites lorsque C2 tend vers zero puis vers l'infini. I.8.c. On appelle fonction de transfert H( j ) = U1( j ) . Quelle est la nature du filtre ? U10 I.8.d. Exprimer la fonction de transfert H( j ) dans le cas ou R1 = R2 = 12 R et C2 = C1 = C. I.9. Diagramme de Bode I.9.a. Etablir les expressions des asymptotes de H( j ) en basse frequence et haute frequence. Tracer le diagramme de Bode asymptotique en precisant bien le point d'intersection. I.9.b. En pratique, pour = 200, on obtient le diagramme de Bode de la figure 10 du document reponse. Mettre clairement en evidence, sur le diagramme de la figure 10 du document reponse, des zones rectilignes. Interpreter ces zones et placer trois pulsations particulieres 1 < 2 < 3 . I.9.c. Sous quelle forme pourrait-on mettre H( j ) en fonction de , 1 , 2 et 3 ? I.9.d. Definir la pulsation de coupure du filtre et donner sa valeur. Estimer la duree du regime transitoire. Troisieme partie : isolation Afin de limiter sa consommation energetique, le proprietaire decide d'isoler la piece. I.10. Importance de l'isolation Le proprietaire peut disposer l'isolant a l'interieur ou a l'exterieur du mur. Pour cela, il recouvre les murs d'un isolant de faible capacite thermique, de conductance thermique i = 0, 05 SI et d'epaisseur e = 5 cm. I.10.a. Calculer la resistance thermique Ri relative a l'isolation de la piece. Comparer cette valeur a Rmur . Par la suite, on prendra Ri = Rmur avec = 10. 6/15 I.10.b. Modifier le schema electrique de la figure 5 (page 5) et proposer les deux montages correspondants. I.10.c. Determiner la puissance necessaire Pmin afin de maintenir une temperature dans la piece de 20 pour une temperature exterieure de 10 C. C I.11. Isolation interieure ou exterieure I.11.a. Choisir un type d'isolation interieure ou exterieure en precisant clairement votre choix sur la copie. I.11.b. Determiner, en regime permanent, les differents tensions U10 et U20 en fonction de , R et I0 . I.11.c. Donner la nouvelle expression de H( j ) en fonction de , , R, C et I0 . I.11.d. On obtient, comme diagrammes de Bode, les figures 11a) et 11b) du document reponse. Indiquer sur la copie et encadrer sur le document reponse celle qui correspond a votre choix d'isolation. Relever la pulsation de coupure correspondant a ce choix et en deduire le temps de reponse i de votre systeme. Commenter ce resultat par rapport au cas sans isolation et analyser votre choix sur le placement de l'isolant. Quatrieme partie : prise en compte des echanges a la surface On prend en consideration les echanges thermiques a la surface en contact avec l'air exterieur par la loi de Newton. On prendra pour le coefficient de transfert thermique de surface k = 10 SI. I.12. I.12.a. Rappeler la loi de Newton. Quelle peut etre l'unite du coefficient k ? I.12.b. Etablir la relation en x = L entre le flux sortant de l'habitation et les donnees k, S, Text et T (L). I.12.c. Modeliser l'echange thermique en x = L par une resistance thermique notee Re . Comparer numeriquement Re a Rmur et a Ri . I.12.d. Quelle est la consequence principale de Re sur l'installation ? Calculer la nouvelle puissance a delivrer afin de maintenir la temperature interieure a 20 C pour une temperature exterieure de 10 C. I.12.e. Comment modeliser la prise en consideration du sol de la piece ? Comment traduire l'influence de la presence d'une fenetre dans la piece ? Elaborer un modele electrique plus complet de la piece. I.12.f. En revenant sur les photographies de la figure 1, page 2, quel phenomene avons nous neglige ? 7/15 PROBLEME II - CHIMIE L'eau de Javel Toutes les donnees necessaires se trouvent au debut de chaque partie. Tous les gaz seront consideres comme parfaits, les solutions ideales et les solides ideaux. Premiere partie : generalites Etudiee particulierement a partir de 1775 par le chimiste francais Claude Louis Berthollet, dont la manufacture de produits chimiques a ete construite dans le quartier de Javel a Paris, l'eau de Javel est une solution aqueuse d'hypochlorite de sodium (Na+(aq.) + ClO-(aq.) ) et de chlorure de sodium (Na+(aq.) + Cl-(aq.) ), compose residuel du processus de fabrication, en presence d'un exces de soude. L'eau de Javel est donc oxydante et caustique (11,5 < pH < 12,5) : sa composition varie en fonction du pH d'utilisation et du temps ecoule depuis sa fabrication. Des especes minoritaires chlorees, chlorite de sodium (Na+(aq.) + ClO- ) et chlorate de sodium (Na+(aq.) + ClO- ), issues du processus de 2 (aq.) 3 (aq.) decomposition de l'eau de Javel peuvent etre aussi presentes. Donnees : -- numeros atomiques : Atome Numero atomique Oxygene 8 -- masses molaires atomiques : Atome Masse molaire atomique (g.mol-1 ) Chlore 17 Sodium 23,0 Chlore 35,5 II.1. Autour des elements chlore et oxygene II.1.a. Donner les configurations electroniques des atomes d'oxygene O et de chlore Cl et des ions oxyde O2- et chlorure Cl- dans leur etat fondamental. II.1.b. Donner une representation de Lewis des ions hypochlorite ClO- , chlorite ClO- 2 et chlorate - ClO3 (Cl est l'atome central pour les trois ions), de l'acide hypochloreux HClO (O etant l'atome central) et de la molecule de dichlore Cl2 . II.1.c. Quels sont les nombres d'oxydation du chlore dans les composes cites ? Donner cette reponse en recopiant et completant le tableau 1. Espece chimique Nombre d'oxydation du chlore Cl- Cl2 HClO ClO- TABLEAU 1 Tableau a recopier et completer. 8/15 ClO- 2 ClO- 3 II.2. Decomposition de l'acide hypochloreux HClO en phase gazeuse Donnees : -- R = 8,314 J.K-1 .mol-1 ; -- tables thermodynamiques a 298 K : Especes f H (kJ.mol-1) (J.K-1 .mol-1 ) Sm HClO(g) 236,6 Cl2 O(g) 80,3 266,1 H2 O(g) -241, 3 188,7 sont respectivement l'enthalpie molaire standard de formation et l'entropie ou f H et Sm molaire standard des corps consideres a 298 K. En phase gazeuse, l'acide hypochloreux, de pression partielle pHClO = 0, 060 bar, peut se deshydrater en formant de l'hemioxyde de chlore Cl2 O et de l'eau, en phase gazeuse dans ces conditions, suivant la reaction (1) d'equation : 2 HClO(g) = Cl2 O(g) + H2 O(g) K1 (298 K) = 11, 1 de constante d'equilibre (1) II.2.a. Calculer, a 298 K, l'entropie standard r S1 (298 K) de la reaction (1) et l'enthalpie libre standard r G1 (298 K) de la meme reaction. Le signe de r S1 (298 K) etait-il previsible ? II.2.b. En deduire la valeur de l'enthalpie standard r H1 (298 K) de la reaction (1). Commenter le resultat obtenu. Determiner enfin la valeur de l'enthalpie standard de formation de l'acide hypochloreux f H (HClO) en phase gazeuse a 298 K. II.2.c. Calculer, a 298 K, l'enthalpie libre de la reaction r G1 dans le cas ou initialement on dispose d'un systeme ferme de volume V contenant de l'acide hypochloreux HClO pur sous une pression partielle pHClO = 0,060 bar. Preciser alors le sens d'evolution du systeme. II.2.d. Preciser la composition du systeme obtenu a l'equilibre. II.2.e. Quelle est l'influence d'une augmentation de pression sur l'equilibre de deshydratation de l'acide hypochloreux a 298 K ? Justifier la reponse. II.3. Structure cristallographique du chlorure de sodium NaCl Donnees : -- masses molaires atomiques : Atome Masse molaire atomique (g.mol-1 ) Sodium 23,0 Chlore 35,5 -- rayons ioniques : Ions Rayons ioniques (pm) Na+ 102 Cl- 184 -- masse volumique du chlorure de sodium NaCl = 2 160 kg.m-3 ; -- nombre d'Avogadro NA = 6,02 × 1023 mol-1 . 9/15 Le chlorure de sodium NaCl, compose residuel du processus de fabrication de l'eau de Javel, cristallise dans une structure ou les ions chlorure Cl- forment un reseau cubique a faces centrees alors que les ions sodium Na+ occupent les interstices octaedriques. II.3.a. Donner une representation de la maille conventionnelle de chlorure de sodium. II.3.b. Definir, puis preciser la coordinence de chaque ion. II.3.c. Exprimer la masse volumique NaCl de ce solide ionique en fonction du parametre de maille a. En deduire une valeur approchee de a et la comparer a la double somme des rayons ioniques. Deuxieme partie : quelques proprietes chimiques des ions hypochlorite dans l'eau de Javel Donnees : -- constante d'acidite a 298 K du couple HClO/ClO- : Ka = 10-7,5 ; -- produit ionique de l'eau a 298 K : Ke = 10-14 ; RT × ln 10 0,06 V. -- on prendra F Document n 1 - Stabilite des ions hypochlorite La decomposition de l'eau de Javel avec formation de dioxygene O2 est favorisee par l'ajout de sels metalliques qui catalysent cette reaction, par une diminution du pH, une augmentation de la force ionique et une augmentation de la temperature. Cette decomposition, produisant un gaz, conduit dans des recipients fermes a une augmentation de la pression au-dessus du liquide et est donc a eviter pour des raisons de securite. L'eau de Javel est donc vendue dans des contenants en plastique etanches a la lumiere et non contamines par des ions metalliques. En l'absence de catalyseurs, la decomposition de l'ion hypochlorite en ion chlorate ClO- 3 (aq.) est beaucoup plus rapide que l'oxydation de l'eau (d'un facteur 10, ce qui correspond approximativement a 95 % de la perte d'ions hypochlorite ClO- ). Les ions chlorate ClO- 3 (aq.) presents dans le milieu ne possedent aucune propriete bactericide. Document n 2 - Superposition de diagrammes potentiel - pH La figure 6 (page 11) est la superposition des droites relatives au couple O2 (g) /H2 O et d'un diagramme simplifie de l'element chlore, c'est-a-dire dans une situation chimique sans presence d'ions chlorate. Les seules especes a envisager sont donc celles des couples du tableau 2 (page 12) pour lesquelles on indique la valeur du potentiel standard E par rapport l'E.S.H. (Electrode Standard a Hydrogene). La figure 7 (page 11) superpose au diagramme simplifie du chlore precedent les segments de droites traduisant les lois de Nernst de deux couples ou intervient l'ion chlorate conformement aux donnees du tableau 3 (page 12). 10/15 E (V) 1,8 1,6 C B 1,4 D 1,2 A 1,0 O2 0,8 0,6 0,4 H2 O 0,2 pH 0 0 1 2 3 4 5 6 7 8 9 10 11 12 13 14 F IGURE 6 Superposition des diagrammes potentiel-pH du chlore simplifie et de l'eau. La concentration des especes dissoutes est de 1 mol.L-1. E (V) 1,8 1,6 C B 1,4 D 1,2 A 1,0 ClO- 3 0,8 0,6 HClO 0,4 ClO- 0,2 pH 0 0 1 2 3 4 5 6 7 8 9 10 11 12 13 14 F IGURE 7 Superposition des diagrammes potentiel-pH du chlore simplifie et des deux couples faisant intervenir les ions chlorate. La concentration des especes dissoutes est de 1 mol.L-1. 11/15 Couples E (V/E.S.H.) O2 /H2 O 1,23 Cl2 /Cl- 1,36 HClO/Cl2 1,63 HClO/Cl- 1,49 ClO- /Cl- 1,73 TABLEAU 2 Potentiel standard des couples d'oxydoreduction. Couples E (V/E.S.H.) ClO- 3 /HClO 1,43 - ClO- 3 /ClO 1,32 TABLEAU 3 Potentiel standard des couples d'oxydoreduction. II.4. Fabrication de l'eau de Javel L'eau de Javel est commercialisee sous deux niveaux de dilution dans des bouteilles a 2,6 % de chlore actif (masse volumique 1 = 1,03 g.cm-3 ) et dans des berlingots a 9,6 % de chlore actif (masse volumique 2 = 1,15 g.cm-3 ). On definit le pourcentage de chlore actif par la masse de dichlore forme (suite a une acidification du melange equimolaire d'ions hypochlorite et chlorure) pour 100 g de solution. II.4.a. Indiquer, pour chacun des domaines (A, B, C, D) presents dans les diagrammes potentiel pH du document n 2, l'espece chimique correspondante. II.4.b. Preciser alors le principe de fabrication de l'eau de Javel a partir du dichlore Cl2 . Ecrire l'equation de la reaction mise en jeu pour une mole de dichlore Cl2 notee (2). II.4.c. Calculer alors la concentration molaire volumique en ions hypochlorite dans les solutions a 2,6 % et 9,6 %. II.4.d. Pourquoi est-il necessaire de refroidir le melange reactionnel ? On donne r H2 (298 K) = -103 kJ.mol-1. II.4.e. Ecrire l'equation des reactions, notees (3) et (4), responsables de la decomposition des ions hypochlorite. On utilisera les plus petits coefficients stoechiometriques entiers dans les reactions (3) et (4). II.4.f. Calculer les constantes d'equilibre K3 et K4 des deux reactions de decomposition des ions hypochlorite ClO- . Troisieme partie : suivi de la decomposition du bleu brillant en presence d'hypochlorite de sodium L'eau de Javel est une solution a base d'ions hypochlorite capable de decomposer de nombreuses substances organiques comme le bleu brillant (E133), colorant alimentaire frequemment rencontre dans les boissons et les sucreries de couleur bleue. 12/15 La cinetique de la decomposition du bleu brillant en presence d'ions hypochlorite d'equation : E133(aq.) + ClO- (aq.) = Produits incolores 1 est suivie par spectrophotometrie en mesurant l'absorbance A de la solution au cours du temps a une longueur d'onde donnee. On suppose que la vitesse de la reaction v peut se mettre sous la forme : v = k × [E133] × [ClO- ] ou est l'ordre partiel par rapport au bleu brillant (E133), l'ordre partiel par rapport aux ions hypochlorite ClO- et k la constante de vitesse de la reaction. Cette reaction, qui admet un ordre global entier, est realisee dans les conditions suivantes : temperature constante et egale a 298 K, milieu reactionnel homogene, reaction quantitative et volume constant. Document n 3 - Spectre d'absorption du bleu brillant La figure 8 trace l'absorbance A du bleu brillant en fonction de la longueur d'onde . !" A !" !"#$ !"#! !"%$ !"%! !"&$ !"&! !"!$ '!! $!! (!! )!! *!! Longueur d'onde (nm) F IGURE 8 Absorbance A du bleu brillant en fonction de la longueur d'onde exprimee en nm. Document n 4 - Preparation de la gamme de la solution etalon de bleu brillant Une gamme etalon est realisee : a partir d'une solution mere de bleu brillant commercial de concentration molaire volumique connue c0 = 4,72 × 10-6 mol.L-1, des solutions filles sont preparees en utilisant une verrerie adaptee. On obtient alors une serie de solutions de bleu brillant de concentrations c connues. L'absorbance A de chaque solution est mesuree dans une cuve en plastique de 1 cm d'epaisseur a une longueur d'onde adaptee. Les valeurs obtenues sont reportees dans le tableau 4 page 14. 1. Les produits ne sont pas bien caracterises d'apres la litterature. 13/15 c (10-6 A mol.L-1 ) 0 0 0,234 1,89 0,347 2,83 0,456 3,78 0,582 4,72 TABLEAU 4 Absorbances et concentrations des solutions. Document n 5 - Absorbance d'une solution Lorsqu'une solution est traversee par un rayonnement polychromatique, elle peut attenuer l'intensite des radiations a certaines longueurs d'onde : on dit qu'elle absorbe ces radiations. I0, IT, F IGURE 9 Representation d'une cuve traversee par un faisceau incident d'intensite I0, . Un faisceau transmis IT, en emerge. La longueur de la cuve traversee est de 1 cm. II.5. Suivi spectrophotometrique de la reaction Un faisceau de lumiere monochromatique (de longueur d'onde ) d'intensite incidente I0, traverse une longueur de solution limpide (phenomene de diffusion negligeable) placee dans une cuve (figure 9). Une partie de la radiation est absorbee par la solution, l'autre est transmise et son intensite est notee IT, . II.5.a. Definir l'absorbance A d'une solution. II.5.b. Quelle longueur d'onde de travail faut-il choisir pour realiser les mesures d'absorbance lors de la realisation de la gamme de solutions etalons ? Quel lien existe-t-il entre cette longueur d'onde et la couleur d'une solution de bleu brillant ? II.5.c. Detailler le protocole experimental a mettre en place pour preparer, a partir de la solution mere de bleu brillant, un volume V = 25,0 mL d'une solution de bleu brillant de concentration molaire volumique c = 1,89 × 10-6 mol.L-1 . II.5.d. Rappeler la loi de Beer-Lambert en precisant les differents termes et leurs unites respectives. Cette loi est-elle verifiee ? II.5.e. Avant de realiser des mesures d'absorbance, il est necessaire de realiser le blanc. Expliquer la necessite d'un telle operation. II.5.f. En quoi la spectrophotometrie est une technique de choix pour le suivi de cette reaction ? 14/15 II.6. Etude cinetique Protocole experimental - A l'instant t = 0 min, on place dans un becher de 50 mL un volume V1 = 25, 0 mL d'une solution aqueuse de bleu brillant de concentration molaire volumique c1 = 4,54 × 10-6 mol.L-1 et un volume V2 = 1,00 mL d'une solution aqueuse d'hypochlorite de sodium (ClO- (aq.) + Na+ (aq.) ) de concentration molaire volumique c2 = 1,33 × 10-2 mol.L-1 . II.6.a. Montrer que les conditions initiales utilisees vont permettre de determiner la valeur de l'ordre partiel par rapport au bleu brillant (E133). Dans quelle situation cinetique se trouve-t-on ? II.6.b. Montrer alors que la vitesse de reaction v peut se mettre sous une forme simplifiee. On notera kapp la constante apparente de vitesse. II.7. Etude experimentale Les resultats de l'etude experimentale menee a 298 K sont rassembles dans le tableau 5 ci-dessous. t (min) A 0 0,582 2,5 0,275 5 0,138 7,5 0,069 10 0,034 15 0,009 TABLEAU 5 Absorbance A mesuree a divers instants t. II.7.a. Montrer que si la reaction est d'ordre 1 par rapport au bleu brillant (E133), l'equation ci-dessous est verifiee : A ln = -kapp × t A0 ou A et A0 representent respectivement les valeurs de l'absorbance a l'instant t et a l'instant initial t = 0 min. kapp est la constante apparente de vitesse de la reaction. II.7.b. Determiner la valeur de kapp a 298 K. II.8. Afin de determiner l'ordre partiel , suppose non nul, par rapport aux ions hypochlorite ClO- , on realise le meme protocole experimental que precedemment en utilisant toutefois une solution aqueuse d'hypochlorite de sodium (ClO- (aq.) + Na+ (aq.) ) de concentration molaire volumique c3 = 6,65 × 10-3 mol.L-1. Les resultats de l'etude experimentale menee a 298 K sont rassembles dans le tableau 6 ci-dessous. t (min) A 2,5 0,389 5 0,275 7,5 0,195 10 0,138 12,5 0,097 15 0,069 TABLEAU 6 Absorbance A a differents instants t. II.8.a. Montrer alors que ces nouvelles conditions initiales s'averent suffisantes pour determiner la valeur de l'ordre partiel par rapport aux ions hypochlorite. II.8.b. En deduire la valeur de la constante de vitesse k de la reaction de decomposition du bleu brillant en presence d'ions hypochlorite. Fin de l'enonce 15/15 Document reponse a rendre avec la copie Question I.9.b F IGURE 10 Diagramme de Bode sans isolation Question I.11.d a) b) F IGURE 11 Diagrammes de Bode avec isolation. Il s'agit de determiner a quels choix d'isolation correspondent les courbes a) ou b). 1/1