CCINP Physique et Chimie MP 2024
| Thème de l'épreuve | Bienvenue dans les Landes ! |
| Principaux outils utilisés | éléctrocinétique, électromagnétisme, mécanique du solide, diffusion, cristallographie, solutions aqueuses, thermodynamique |
| Mots clefs | évapo-transpiration, distillation, marche, échasses, protection solaire, térébenthine, diiode, UV, plage, crème solaire, titane, pastis landais, levure, bicarbonate, bronzage, anti-oxydants, iodométrie |
Corrigé
:👈 gratuite pour tous les corrigés si tu crées un compte
👈 l'accès aux indications de tous les corrigés ne coûte que 1 € ⬅ clique ici
👈 gratuite pour tous les corrigés si tu crées un compte
- - - - - - - - - -
👈 gratuite pour ce corrigé si tu crées un compte
- - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - -
Énoncé complet
(télécharger le PDF)

















Rapport du jury
(télécharger le PDF)




Énoncé obtenu par reconnaissance optique des caractères
SESSION 2024 MP2PC
CONCOURS
COMMUN
INP
ÉPREUVE SPÉCIFIQUE - FILIÈRE MP
PHYSIQUE - CHIMIE
Durée : 4 heures
NB. : le candidat attachera la plus grande importance à la clarté, à la
précision et à la concision de la rédaction.
Si un candidat est amené à repérer ce qui peut lui sembler être une erreur
d'énoncé, il le signalera sur sa copie
et devra poursuivre Sa composition en expliquant les raisons des initiatives
qu'il a été amené à prendre.
RAPPEL DES CONSIGNES
« _ Utiliser uniquement un Stylo noir ou bleu foncé non effaçable pour la
rédaction de votre composition ; d'autres
couleurs, excepté le vert, bleu clair ou turquoise, peuvent être utilisées,
mais exclusivement pour les schémas
et la mise en évidence des résultats.
. Ne pas utiliser de correcteur.
« Écrire le mot FIN à la fin de votre composition.
Les calculatrices sont autorisées.
1/19
Bienvenue dans les Landes !
Sa forêt, ses traditions, ses plages
Photo 1 - Vue aérienne de la "Côte d'Argent", visible sur le site officiel du
Comité Départemental
du Tourisme des Landes : www.tourismelandes.com
On propose dans ce sujet une petite excursion scientifique en pays landais.
L'épreuve comporte cinq parties indépendantes de thématiques différentes,
listées ci-après :
Partie 1 : les besoins en eau du pin maritime (potentiel chimique et analogie
avec la conduction
dans un milieu ohmique).
Partie Il : la tradition du gemmage et ses applications (thermodynamique des
changements d'état
et thermodynamique chimique).
Partie I : la marche sur échasses du berger landais (mécanique du solide).
Partie IV : la préparation du pastis landais (chimie des solutions).
Partie V : le bronzage sur les plages landaises et la protection solaire
(électromagnétisme,
cristallographie et oxydoréduction).
Données :
Elément chimique H C (®) Na P S Ti |
Masse molaire
+ 1 12 16 23 31 32 48 127
(g'mol")
Constante molaire des gaz parfaits : R = 8,31 J. K=!.mol!
Température en kelvins : T(K)=8(°C)+273.
2119
Partie | - Les besoins en eau du pin maritime (ou pin des Landes)
La forêt des Landes de Gascogne est un massif forestier du Sud-Ouest de la
France situé en
Nouvelle-Aquitaine (figure 1). Bordée à l'Ouest par l'océan Atlantique (la Côte
d'Argent), elle
forme un vaste triangle d'une superficie de plus d'un million d'hectares, qui
s'étend sur trois
départements (la Gironde, les Landes et le Lot-et-Garonne).
" cd +
NL LANTATION
À
3 A A. DE LA FORÊT
Br ET Moue LANDAISE
a ne { a, --
VA = Nas À Y #
: LA, mdr 1 À L#
E ENT AL SX } Lnrasane
t ns nr, Ni ... TR | nn. " C/
* ©, ed 4 è > L_ \ : . |
oe æ Î { $
Y Fa D \ É
\ | \ SA É
+ qu LL, te s ? ss / np, le 7
a} )
NS }
| ES { S << F Æ À NS Sr, / \ ae. EUR & # TD Le | 2 " F4 À + ? Re $ 4 an ss \{ "É --" md | es, VA à Figure 1 - Position géographique des Landes de Gascogne et de sa forêt (www.centrecultureldupaysdorthe.com) Cette forêt a été plantée au XIX® siècle sous l'impulsion de Napoléon Ill, dans le but de lutter contre l'avancée des dunes menaçant les villages, d'assécher les marais nombreux dans le territoire et de développer une ressource de matières premières (bois d'oeuvre, poteaux télégraphiques, pâte à papier, solvants pour l'industrie chimique...). De nos jours, elle constitue aussi un atout considérable pour le tourisme vert. Hélas, plus de 32 000 hectares de ce précieux massif forestier ont été détruits au cours des gigantesques incendies de l'été 2022. Mouvements d'eau dans un végétal, potentiel hydrique et analogie électrocinétique Les végétaux terrestres prélèvent dans le sol l'eau et leurs nutriments qui sont des sels minéraux. Le liquide obtenu constitue la sève brute circulant dans la plante. Pour décrire cette circulation d'eau (depuis le sol vers l'atmosphère à travers les racines, la tige ou le tronc et les branches, puis les feuilles), l'outil adapté est le potentiel chimique de l'eau. Ce dernier caractérise les états de liaison de l'eau dans les différents milieux et tissus cellulaires constituant le continuum sol- plante-atmosphère (CSPA), qui comprend (figure 2) : -- le sol, -- le xylème des racines, du tronc et des branches (ensemble des tissus cellulaires organisés en canaux de circulation de la sève brute), -- les stomates des feuilles (cellules de l'épiderme des feuilles régulant l'évapotranspiration), -- l'air de l'atmosphère au contact des feuilles. Q1. Définir, à l'aide d'une fonction d'état thermodynamique à préciser, le potentiel chimique u(T,P) de l'eau dans un récipient contenant n moles d'eau pure à l'état liquide sous la température 7 et la pression P. 3/19 La transpiration tire l'eau de la feuille La cohésion tire RE le long du xylème Particule de sol Molécules d'eau Xylème L'eau est attirée vers la racine Sens de diminution de y Valeurs du potentiel hydrique y le long du CSPA Atmosphère : = -100 MPa Feuilles du sommet : y= -1,5 MPa Tronc : y=-0,6 MPa Racines : y= -0,2 MPa Sol : y=-0,05 MPa QS. Q4. a) Rappeler la loi d'Ohm locale dans un milieu ohmique (on l'écrira à l'aide du potentiel électrique V). À quelles grandeurs électriques sont analogues respectivement w et ju ? Définir et exprimer, en fonction des données, la conductivité hydraulique y, analogue de la conductivité électrique. b) Dans ce modèle, la masse d'eau traversant une surface ($S) par unité de temps, ou débit massique à travers (S), est D= [| ju-dS. De quelle grandeur électrique le débit (S) massique D est-il analogue ? a) Définir la résistance hydraulique R; d'un tube de courant d'eau de débit massique D, d'extrémités À et B, soumis à une différence de potentiel hydrique 1 --w8 > 0.
b) Dans quelle unité, faisant intervenir uniquement le mètre et la seconde,
s'exprime la
résistance hydraulique ?
Le système racinaire du pin est modélisé comme un faisceau de N racines
cylindriques rectilignes
de conductivité hydraulique y,, de sections, et de longueur /,, interconnectées
au point O à la
base du tronc (figure 3) et soumises à la même différence de potentiel hydrique
w8 ---w4 > 0,
avec w4 le potentiel hydrique au niveau des extrémités des racines au contact
avec le sol.
Q5.
Q6.
partie aérienne
de l'arbre
7 1EU de potentiel hydrique w = wo
L
x À
système :
; ; \
racinaire
2 demi-sphère dans le sol
modélisé
-7%-- de potentiel hydrique wy = vs
Figure 3 - Schéma d'un pin et de son système racinaire
Par circulation du champ -grady le long d'une racine, établir l'expression de
la résistance
hydraulique À, d'une racine en fonction de y,, s, et de /,. En déduire la
résistance
hydraulique R,, du système racinaire.
Avec R, la résistance hydraulique du système racinaire, À, celle du tronc, R;
celle du
système foliaire et À, celle à l'interface entre le système foliaire et
l'atmosphère, donner en
justifiant, le schéma électrique équivalent au système
racines-tronc-feuilles-atmosphère.
La résistance hydraulique moyenne d'un pin adulte (des extrémités des racines
au contact avec le
Sol jusqu'aux aiguilles à son sommet) est R, =1,0 .10° S.I.
Q7.
Q8.
À partir de R, et des valeurs du potentiel hydrique de la figure 2, donner la
valeur
numérique de À.
En déduire la masse évapo-transpirée par un pin adulte pendant un jour d'été
(avec les
valeurs numériques de la figure 2 et une durée d'exposition solaire journalière
de 12h).
9/19
Q9. On peut lire sur un document du C.N.PÆF. (Centre National de la Protection
Forestière)
"qu'un hectare de pins maritimes adultes aspire 15 à 25 tonnes d'eau par jour,
cette eau
étant évapo-transpirée par la partie aérienne de l'arbre".
Sachant qu'il y a typiquement 300 pins adultes par hectare, les valeurs du
C.N.P.F. sont-
elles en accord avec le résultat trouvé en Q8 ? On rappelle que 1 hectare =
10m".
Partie Il - Gemmage en forêt landaise et distillation de la résine de pin
Le gemmage est un procédé ancestral qui consiste à produire une entaille dans
l'écorce du pin
pour en retirer la résine. Le procédé, généralisé à toute la forêt landaise
jusqu'au début du XX
siècle, va devenir une activité industrielle phare de la région jusque dans les
années 1950. Après
une période de déclin, puis sa disparition dans les années 1990, des projets de
relance sont
aujourd'hui en cours.
À l'aide du hapchot (petite hache), le résinier effectue les piques qui forment
la " carre " le long de
laquelle la résine va s'écouler jusqu'à un pot en terre cuite coincé entre une
lamelle de zinc et un
clou en contrebas (photos 2a et 2b).
La résine (ou gemme) ainsi récoltée est ensuite distillée pour obtenir de
l'huile essentielle de
térébenthine et des composés organiques lourds, nommés brai ou colophane selon
leur
consistance. Le principal constituant de l'essence de térébenthine est le
pinène, molécule
odorante de formule brute CH, très utilisée comme solvant organique. Le brai
est utilisé
comme colle végétale et la colophane comme liant dans certaines peintures. Elle
est aussi bien
connue des musiciens pour favoriser le crissement de l'archet sur les
instruments à cordes
frottées.
ge 7 m -
x - # A
LS FRE
" .:
EANETT A
mx
er
|
p",
LA A : L A LL"
Ce:
the ei E
: 6 +
Ve :
| -
.
À
7.
E le
EUR
Ur
: En st
{ , Lfs «7 ,
SÉSAN ATEN
Le
XL . rs. rs 2% 24 L
PPS SES en à
De
Photo 2a - Résinier ouvrant la " carre " Photo 2b - Pot de recueil de la résine
(https://www.futura-sciences.com/planete/dossiers/aeographie-region-aquitaine-gemmage)
6/19
11.1 - Obtention d'essence de térébenthine par hydrodistillation
Pour récupérer la térébenthine, on procède par hydrodistillation (ou
entraînement à la vapeur)
(figure à) : de l'eau pure est ajoutée à la gemme dans un alambic et le tout
est porté à ébullition.
Les vapeurs d'eau obtenues entraînent avec elles des vapeurs de pinène, ce qui
donne un
mélange gazeux de composition déterminée. Ce mélange passe alors dans le
serpentin où il se
refroidit et se condense. Le condensat est récupéré dans un récipient, appelé "
florentin ". L'eau et
le pinène liquides étant non miscibles, l'essence de térébenthine surnage au
dessus de l'eau, ce
qui permet sa récupération. Le résidu de distillation au fond de l'alambic
donne le brai et la
colophane.
essence
de :
terebenthine
STE
Récipient "florentin" Alambic
Figure 4 - Schéma d'une hydrodistillation
(https://www.centrecultureldupaysdorthe.com)
Q10. Dessiner l'allure du diagramme des phases (p, 7) de l'eau pure. Nommer et
mentionner deux
points particuliers sur ce diagramme et indiquer les domaines solide, liquide
et gazeux.
Q11. La pression de vapeur saturante du pinène pur à 20 °C est p, (293) = 430
Pa.
En considérant le modèle de gaz parfait pour les espèces gazeuses, établir s'il
est
dangereux de travailler dans un local à 20 °C dans lequel de l'essence de
térébenthine se
trouverait à l'équilibre de vaporisation, sachant que la teneur limite à ne pas
dépasser est de
5 g de pinène par mètre cube d'air.
On donne en figure 5 les courbes représentatives des pressions de vapeur
saturante p, (T) et
Ph (T) des équilibres de vaporisation de l'eau pure et du pinène pur en
fonction de la température
T. La troisième courbe correspond à la somme p,(T)+p,(T). On fera les lectures
adéquates sur
ces courbes pour répondre aux questions Q12 à Q15.
7119
pression (bar)
125
120 Pe(T) + Pp(T) »/ /< ef) pat) +, 110 105 1.00 0.95 0.90 0.85 0.80 0.75 0.70 0.65 0.60 LEE) 0.50 0.45 0.40 LEE] 0.30 0.25 0.20 0.15 0.10 0.05 0.00 330 335 340 345 350 355 360 365 370 375 380 385 390 395 400 405 410 415 420 425 430 435 440 445 450 température (K) On cherche à estimer l'enthalpie standard de réaction A:H° de la réaction (1). Pour cela, on introduit 20 g de diiode en cristaux dans un calorimètre de grand volume, puis on y ajoute 5 mL d'essence de térébenthine, supposée être du pinène pur. Les réactifs sont introduits à 6; = 20°C. À la fin de l'expérience, tout le diiode en excès est sous forme vapeur et la température du milieu réactionnel est 6; =185°C. On suppose l'évolution isobare. Q16. Calculer la quantité de matière initiale en pinène n, et la quantité de matière en diiode en excès nn, Une fois tout le pinène consommé. Q17. En négligeant les capacités thermiques du calorimètre et du produit formé C;H4b, exprimer A.H° en fonction des données. Calculer sa valeur. Commenter son signe. Partie INT - La marche du berger landais sur échasses Afin de parcourir de longues distances dans la lande et pour surveiller leurs troupeaux de moutons, les bergers landais utilisaient des échasses (photo 3). Les premiers témoignages de cette pratique remontent au XVIII siècle. Celle-ci a progressivement disparu jusqu'au début du XX° siècle avec l'extension de la forêt qui marqua la fin du pastoralisme. De nos jours, des groupes folkloriques d'échassiers s'attachent à perpétuer et à faire revivre ce patrimoine culturel landais. /A #08 : 2% a! PR) j lo pt M ge ; ' m Photo 3 - Berger landais surveillant son troupeau de moutons du haut de ses échasses (https://photoshistoriques.info/lechasse-la-marche-des-bergers-de-france-prairies-1843-1937) Les échasses sont constituées de deux pièces de bois : l'escasse (" jambe " en patois landais) et le paouse pé (" repose pied "), fixé sur l'escasse, le plus souvent à une hauteur par rapport au sol comprise entre 90 cm et 1,20 m. Deux lanières de cuir sont prévues pour que l'échassier attache son pied et sa jambe à l'échasse. On se propose d'étudier la marche sur échasses en établissant quels paramètres mécaniques sont modifiés par rapport à la marche ordinaire et de déterminer s'il est pertinent de qualifier cette pratique de " marche à pied augmentée " Commençons par décrire la marche ordinaire : la marche est une activité complexe, nécessitant l'action coordonnée de 48 muscles de contrôle de la position du tronc et des membres inférieurs afin de permettre au marcheur de se déplacer vers l'avant avec un rendement optimal. 9/19 QG Où X 9 9 4 * l &---- Durée du cycle ----* 0 Tac Ts Toe DT The Aac + Tos) + + 4 + > à
lOscillation gauche! Appui unipode
| Double |! | Double gauche |;
contact contact nr |
[ | Appui unipode | Oscillation droite |
I [l droit l |
:
|
(
Double
date f telle que
contact PE nipoce droit Oscillation gauche
= .
Ta Da { \
." | buste (b) #7 | &
S_-' \
buste (b) n a TA #8 À
A \ 1 Go( / \ I
b (Ti) l \ 1Go(Tac]
G() s - mt} Te oo +,
+; ! : Vo: 1 jambe gauche à une
L L !
Tac l < Tac + Tos jambe droite | LT at= Ty Figure 7a - Phase de double contact Figure 7b - Phase d'oscillation gauche On adopte le modèle mécanique simplifié suivant : Chaque jambe est modélisée par une tige solide, de longueur /., de masse m., de centre de masse G; et d'extrémité F (pivot fémoral). Ces points sont notés G, et F; pour la jambe droite (Ja) et G, et À pour la jambe gauche (j,). Le buste (b) est modélisé comme un solide de masse m, et de centre de masse G,. L'ensemble (2) = Ua) (g),(b)} constitue le marcheur. On note : °g=-guü, l'accélération de la pesanteur. e J- le moment d'inertie de (j,) (respectivement de (Jg)) par rapport à l'axe F, y (respectivement F y). + J, le moment d'inertie de (/,) (respectivement de (j,)) par rapport à l'axe O,y (respectivement ©, y). 1.1 - Étude de la phase d'oscillation gauche Soit O(f) la position angulaire de (j,) par rapport à la verticale ascendante (figure 7b). Q18. En appliquant le théorème du moment cinétique à (j,) dans le référentiel du buste supposé galiléen, établir l'équation différentielle vérifiée par 8(t) pendant cette phase d'oscillation. Q19. a) Définir ce que sont des oscillations isochrones. b) Dans l'approximation des petits angles, le mouvement de (j,) est-il isochrone ? 11/19 I11.2 - c) Exprimer, dans cette approximation, la pulsation «&, et la durée 1, de cette phase oscillante en fonction de m,, J-, g etde A. Étude de la phase de double contact Afin d'évaluer le coût énergétique de la marche, on adopte les quatre hypothèses suivantes lors de la phase de double contact : Q20. IIL.3 - Q21. Q22. Q23. Q24. II1.4 - le buste est animé d'un mouvement de translation quasi-uniforme, de vitesse moyenne Vie Vi Ü, avec V, = P (la composante verticale de VW. est donc négligée). Tdc Les variations d'énergie potentielle de pesanteur de (/,) et de (J,) sont négligées. Les variations d'énergie cinétique de (j,) et de (j,) Sont supposées égales. Le mouvement de rotation de (/,) autour de O,y s'effectue à la vitesse angulaire variable Q(t), avec Q{(t -0)=0. On note h=26 (.) -Zc(o la Variation d'altitude du point G, entre les instants de dates t=0 et f=71, (figure 7a). Exprimer la Variation A& de l'énergie mécanique de (7) entre ces deux instants, en fonction de J,, Q(rt,L), m,, g etde h. Coût énergétique et pas optimal de la marche ordinaire En supposant quasi-constante la puissance % fournie par les muscles pendant la phase de A& double contact, on évalue Y par P =--, Tdc Rappeler l'énoncé du théorème de la mécanique dont découle cette relation d'évaluation de Y. p? Avec h ET (expression approchée de h valable pour les petits angles 0:) et en supposant des conditions de marche telles que Q{r,)=a®,, avec «, la pulsation trouvée à la OS ? question Q19.c, montrer que Y | Obtenir l'expression du pas p,.. qui minimise P. Application numérique : Avec /;= 1m, m,= 10 kg, m, = 60 kg, calculer p,,, dans le cas d'une jambe à répartition de masse uniforme, pour laquelle on a alors A = L [2 et J, = JF. Pas optimal avec des échasses Soit maintenant un berger monté sur ses échasses. Chacune d'elles est modélisée comme une tige de masse négligeable, de longueur /", solidarisée à la jambe et formant avec elle une " jambe équivalente " de longueur L +71. Onnote E le point de contact entre le sol et l'échasse et JE le moment d'inertie, par rapport à l'axe Ey, de la "jambe équivalente ". 12/19 Q25. a) Parmi les paramètres intervenant dans l'expression de p,,, obtenue en Q23, indiquer lesquels sont inchangés par rapport au cas sans échasses et lesquels sont à modifier. On précisera ces modifications. b) En déduire l'expression de Popt puis donner le rapport Popt en fonction de dE et de L Popt O j Dans le tableau 1 figurent les expressions des moments d'inertie d'une jambe à répartition de masse uniforme, sans ou avec échasse. Jambe seule Jambe avec échasse (contact avec le sol en O) | (contact avecle solen E) Moment d'inertie par rapport à m | Jn =-172 J=Ti(R:3rL:31 l'axe de rotation au sol O T3 j ET 3 | j Tableau 1 - Moments d'inertie dans le cas d'une jambe à répartition de masse uniforme x * Q26. a) Exprimer Popt en fonction du seul rapport _ dans le cas d'une jambe à répartition de Popt j masse uniforme. x b) Calculer Popt pour un berger adulte de longueur de jambe / 1m, monté sur des opt échasses de longueur 7 =1m. c) Justifier si la durée de la phase oscillante est changée avec les échasses. d) Des études statistiques ont montré, qu'une fois le pas optimal adopté, la vitesse moyenne de déplacement horizontal du marcheur sur un cycle est proportionnelle au pas optimal et * à la pulsation de la phase oscillante. En déduire le rapport T des vitesses de déplacement du marcheur avec et sans échasses. Commenter. Partie IV - La préparation du pastis landais À la fois moelleux et parfumé, le pastis landais (ou « pastis bourrit ») est une pâtisserie traditionnelle née au XIX° siècle, très prisée lors des fêtes locales. Il s'agit d'une brioche légère de forme tronconique parsemée de morceaux de sucre concassé (photo 4). En patois gascon, « pastis » signifie « gâteau » ou « pâte » et « pastis bourrit » veut dire « gâteau à pâte levée » (cette pâtisserie n'a donc rien à voir avec la célèbre boisson anisée !). 13/19 Dans sa recette moderne, on utilise de la levure (ou poudre à lever) dont l'objectif est de libérer du dioxyde de carbone gazeux pour faire gonfler la pâte lors de la cuisson. Une fois la levure mélangée aux ingrédients et humidifiée, le gaz est obtenu par une réaction acidobasique faisant intervenir l'ion hydrogénocarbonate HCO:. Soit la composition d'un sachet de 15 g de levure : * 4 g d'amidon ; * m 9 de diphosphate disodique Na;H;,P,0, (ou dihydrogénodiphosphate de sodium) ; * m, 9 de bicarbonate de sodium NaHCO, (ou hydrogénocarbonate de sodium). L'amidon joue le rôle de stabilisateur pour que les deux composés actifs ne réagissent pas entre eux pendant la durée de stockage du sachet (ce dernier devant être conservé à l'abri de toute trace d'humidité). Le tableau 2 donne les noms des ions utiles dans cette partie. ons H,P,02- HP,0$- P,0%- HCO; CO$ nom des | dihydrogéno- | monohydrogéno- hydrogéno- Ions diphosphate diphosphate diphosphate carbonate carbonate Tableau 2 - Noms des ions diphosphates et carbonates Données à 25 °C : Couples acido- basiques HP,07 /HP,0% | HROY /P,07 | CO; aqueux / HCO3 | HCO3/COf pKa pKa, = 6,7 pKa, = 9,3 pKa; = 6,3 pKa, = 10,3 Tableau 3 - Couples acido-basiques et leur pKa Équilibre de solubilité du CO, dans l'eau et sa constante d'équilibre : CO; (9) = CO; aqueux K, =2,8:1 0? On donne la réaction d'équilibre entre l'ion hydrogénocarbonate HCO; et l'ion dihydrogénodiphosphate H,P,0°" : H,P,05 + HCO; 2 CO,(g)+H,0 + HROY (1) Q27. En assimilant la réaction dans la pâte à la réaction en solution aqueuse, exprimer en fonction de Ka, Kas et de K;, la constante d'équilibre de la réaction (1), puis donner sa valeur numérique à 25 °C. Peu avancée à température ambiante, cette réaction devient totale lors de la cuisson, le chauffage déplaçant l'équilibre dans le sens du dégazage de CO, . Des alvéoles se forment alors au sein de la pâte qui se solidifie en une structure " aérienne "et dilatée : c'est la "levée ". Q28. On utilise un sachet de 15 g de levure. Calculer les masses m, de NaH,P,0, et m, de NaHCO, contenues dans le sachet pour assurer la stooechiométrie de la réaction (1). 14/19 Q29. Quel volume de CO, un sachet de levure peut-il libérer sous une pression égale à 1 bar et une température égale à 170 °C si on suppose totale la réaction (1) et si on assimile le gaz à un gaz parfait ? Il est aussi bien connu des amateurs pâtissiers que le bicarbonate de sodium seul peut être utilisé comme poudre à lever, mais qu'il donne un goût amer aux pâtisseries en raison du caractère basique de l'ion carbonate formé. La formulation combinée d'un sachet de levure en bicarbonate et en dihydrogénodiphosphate évite cet inconvénient en permettant des valeurs de pH modérément basiques. On se propose de vérifier ce point. Le diagramme simulé figure 8 représente le logarithme décimal des concentrations des espèces H,0*, OH, HP,07, HP,0Y et P.07 en fonction du pH, dans une solution de concentration totale C, en espèces phosphorées. La valeur numérique de C, a été choisie pour correspondre à la situation de la question Q31. a ON 1 2 | E $ PE in _1- = LT P Q nf] O _5 4 d » re Et id 52 | 9 -- ai . GE y NS e|T --$5 : / C --6 à Q Ed \ ÿ --/ d oO a | T 2 "0 l 2? 3 4 s 6 7 8 9 10 11 1 2 13 14 pH Figure 8 - Diagramme pour les espèces H,0*, OH, HP,07, HP,0$ et P,.07 Q30. a) Pour chaque numéro de courbe de la figure 8, attribuer l'espèce correspondante. b) Déterminer C, par lecture sur le diagramme. c) Expliquer à quelles valeurs théoriques correspondent les abscisses des points P et Q. Q31. On réalise l'expérience suivante : un sachet de 15 g de levure est dissous dans 100 mL d'eau. On chauffe pour rendre la réaction (1) totale. Après retour à température ambiante et en négligeant la quantité de CO, dissous restant en solution après dégazage dans l'air, trouver, par lecture en figure 8, le pH de la solution finale obtenue, sachant que, dans cette hypothèse, le pH est déterminé par la seule réaction d'équilibre (a) suivante : 2 HP,0Y 2 H,P,07 + P.07 (a) 15/19 Partie V - Bronzage sur les plages de la Côte d'Argent et protection solaire V.1 - La pénétration des rayonnements dans la peau On dispose en figure 9 d'une illustration de la pénétration différenciée des rayonnements ultraviolets (UVA, UVB et UVC) et infrarouges dans les trois couches constitutives de la peau. Des informations sur ces rayonnements sont données dans le document 1. UVC UVB UVA nee RAYONS I ROUGES 0,1 mm] Epiderme | Derme 1 mm Hypoderme Figure 9 - Illustration de la pénétration du rayonnement solaire dans la peau (https://wWww.newpharma.fr/cnt/art/186/rayons-uv-uva-uvb-et-uvc-la-difference.html) "Les UVA (320 à 400 nm) IIS représentent environ 95 % des radiations UV qui atteignent la surface de notre planète. Ils pénètrent le derme en activant la mélanine présente dans notre peau, ce qui la fait bronzer. Mais dans la durée, ils provoquent aussi une altération moléculaire du derme du fait des radicaux libres qu'ils produisent, ce qui les rend responsables du photo-vieillissement et de cancers de la peau. "Les UVB (290 à 320 nm) IIS représentent 5 % des rayons UV qui atteignent la surface de la Terre. Ils pénètrent seulement l'épiderme mais sont plus dommageables que les UVA. IIs sont responsables des coups de soleil. *Les UVC (100 à 280 nm) Les UVC sont intégralement absorbés par la couche d'ozone et n'atteignent pas la surface de la Terre, où ils rendraient la vie impossible. *Les infrarouges (800 à 2 000 nm) Leurs grandes longueurs d'onde leur permettent d'atteindre les couches les plus profondes de la peau, mais ils sont beaucoup moins nocifs que les ultraviolets. Document 1 - Informations sur les rayonnements UV et infrarouges Afin d'étudier la pénétration cutanée des rayonnements UV, on propose un modèle sommaire dans lequel les propriétés de conduction électrique des différentes couches de la peau sont décrites par un milieu conducteur ohmique unique, de conductivité électrique 7 uniforme, réelle et indépendante de la longueur d'onde, de permittivité diélectrique £&, et de splitéabilité magnétique LH, égales à celles du vide. Un point M de l'espace est repéré par ses coordonnées cartésiennes 16/19 (x, y,z) dans le repère cartésien (O;uü,,u,,u,), avec O un point à l'interface air/conducteur, ü, le ÿ? vecteur unitaire normal au plan de l'interface et dirigé de l'air vers le conducteur, ce dernier occupant le demi-espace z > 0.
On note c=1/;/Eu0, E(M;t) et B(M,t) les champs électrique et magnétique de
l'onde
électromagnétique présente dans le conducteur.
Q32. Écrire les équations de Maxwell dans le conducteur dans l'hypothèse d'un
milieu localement
neutre et à courant de déplacement négligeable devant le courant de conduction.
Q33. Établir l'équation aux dérivées partielles vérifiée par le champ E. On
rappelle que
rot(rotE)= grad(divE)- AË , où A est l'opérateur laplacien vectoriel.
_ . ilwt-k.OM ; |
Soit E(Mt)=E, ü,e PS | la représentation complexe du champ électrique en un
point M de la
peau. Dans cette expression, 2 =-1, E, et w sont des constantes réelles
strictement positives et
k=KkuU, est le vecteur d'onde complexe, avec À une constante complexe.
Q34. a) Préciser la direction de propagation et la polarisation de l'onde.
b) Exprimer k° en fonction de 1, c, y et de la longueur d'onde dans le vide a=
Te.
(7)
En déduire, en justifiant, l'expression de k qui convient.
c) Faire apparaître une longueur caractéristique à d'évolution de l'amplitude
de E. Quel
nom donne-t-on à à ?
Q35. Expliquer si ce modèle semble conforme à la pénétration différenciée des
rayonnements
illustrée en figure 9.
V.2 - Les filtres solaires inorganiques
Des pigments à structure nano-particulaire, tels que le dioxyde de titane TiO,
ou l'oxyde de zinc
ZnO, sont utilisés comme filtres inorganiques anti UV dans les crèmes solaires.
Le dioxyde de titane existe sous trois formes cristallographiques : l'anatase,
la brookite et le rutile,
de masses volumiques respectives 3880 kg-m *, 4 120 kg-m * et 4 260 kg-m *.
On fait l'analyse cristallographique d'un échantillon de dioxyde de titane
entrant dans la
composition d'une crème solaire. Une expérience de diffraction de rayons X a
permis de
déterminer que la structure cristalline correspond à la maille
parallélépipédique représentée en
figure 10, avec pour paramètres de maille a=-459 pm et b=-296pm (on rappelle que
1 pm = 10m).
17/19
En gris clair : Ti**
En noir : O7
L
a
Figure 10 - Maille parallélépipédique d'une forme cristallographique de TiO,
Q36. Combien de motifs TiO, la maille représentée contient-elle ?
Q37. Identifier la forme cristallographique de cet échantillon parmi les trois
formes proposées. On
rappelle la valeur du nombre d'Avogadro : N, = 6,02:10*mol |.
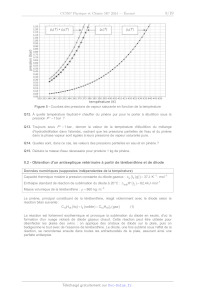
Q38. La figure 11 donne les courbes d'absorbance de TiO, et de ZnO en fonction
de la longueur
d'onde pour des tailles de particules de l'ordre de 100 nm.
Expliquer les formulations combinées en TiO, et en ZnO des crèmes solaires.
absorbance
be nn nu mu men pen un per jen me ei MER
290 310
Figure 11 - Absorbance de TiO, et de ZnO en fonction de la longueur d'onde
V.3 - Des anti-oxydants dans les crèmes solaires
Données :
Couple d'oxydoréduction CéHO6 / CéHeO6 PYIE S,0$ / S,0$"
Potentiel standard E° (en V) 0,13 0,54 0,08
18/19
Un anti-oxydant est une substance réductrice qui défend les cellules contre les
molécules instables
nommées radicaux libres générées par l'action des rayonnements UV.
La vitamine E (ou a---tocophérol, de formule brute C,.H:0O0,) et la vitamine C
(ou acide
ascorbique, de formule brute C;H,0,) sont de puissants antioxydants : en
neutralisant les
radicaux libres, ces molécules contribuent à protéger la peau d'un
vieillissement prématuré et à
lutter efficacement contre l'apparition de mélanomes.
On propose d'étudier le titrage iodométrique de l'acide ascorbique contenu dans
une poudre (p)
intervenant comme matière première dans la fabrication d'une crème solaire.
Pour ce faire, on prépare les trois solutions ci-dessous :
-- une solution (a) obtenue par dissolution de 500 mg de (p) dans 100 mL d'eau ;
-- une solution (i) obtenue par dissolution de 1,250 g de cristaux de diiode
dans 100 mL d'eau ;
-- une solution (t) obtenue par dissolution de 1,500 g de cristaux de
thiosulfate de sodium
Na;S,0; dans 100 mL d'eau.
Dans un erlenmeyer, on introduit un volume V, = 20,0 mL de solution (a). On
note n; la quantité
d'acide ascorbique inconnue contenue dans ce prélèvement. On verse ensuite un
volume
V, = 30,0 mL de solution (i).
L'erlenmeyer est bouché, le mélange est agité puis laissé au repos pendant 15
min.
On dose ensuite le diiode en excès par la solution (t). Le volume obtenu à
l'équivalence est égal à
V. =19,4 mL.
Q39. Calculer les concentrations en quantité de matière C, et C, des solutions
(i) et (t) en diiode
et en ion thiosulfate S,0<" . Q40. Écrire l'équation bilan de la réaction (supposée totale) se produisant dans l'erlenmeyer avant l'étape de dosage, puis écrire l'équation bilan de la réaction de dosage. Q41. Exprimer n, en fonction de C;, V,, C. et de V.. Q42. Déterminer le degré de pureté de (p) défini par la fraction massique de (p) en acide ascorbique. FIN 19/19