Mines Physique 2 MP 2017
| Thème de l'épreuve | La capacité thermique des gaz |
| Principaux outils utilisés | mécanique classique, mécanique quantique, thermodynamique |
| Mots clefs | capacité thermique, oscillateur harmonique, équipartition de l'énergie, gaz parfait diatomique, équation de Schrödinger |
Corrigé
:👈 gratuite pour tous les corrigés si tu crées un compte
👈 l'accès aux indications de tous les corrigés ne coûte que 1 € ⬅ clique ici
👈 gratuite pour tous les corrigés si tu crées un compte
- - - - - - - - - -
👈 gratuite pour ce corrigé si tu crées un compte
- - - - - - - - - - - - - - -
Énoncé complet
(télécharger le PDF)


Rapport du jury
(télécharger le PDF)



Énoncé obtenu par reconnaissance optique des caractères
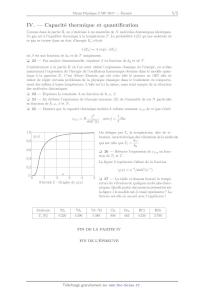
A2017 PHYSIQUE II MP ÉCOLE DES PONTS PARISTECH, ISAE-SUPAERO, ENSTA PARISTECH, TELECOM PARISTECH, MINES PARISTECH, MINES SAINT-ÉTIENNE, MINES NANCY, IMT Atlantique (ex Télécom Bretagne), ENSAE PARISTECH. Concours Centrale-Supelec (Cycle International), Concours Mines-Télécom, Concours Commun TPE/EIVP. CONCOURS 2017 DEUXIÈME ÉPREUVE DE PHYSIQUE Durée de l'épreuve : 3 heures L'usage de la calculatrice et de tout dispositif électronique est interdit. Les candidats sont priés de mentionner de façon apparente sur la première page de la copie : PHYSIQUE II - MP L'énoncé de cette épreuve comporte 4 pages de texte. Si, au cours de l'épreuve, un candidat repère ce qui lui semble être une erreur d'énoncé, il le signale sur sa copie et poursuit sa composition en expliquant les raisons des initiatives qu'il est amené à prendre. Physique II, annee 2017 -- filiere MP La capacite thermique des gaz La capacite thermique des gaz est une grandeur thermodynamique assez facile a mesurer experimentalement. Elle a joue un grand role dans la comprehension de la nature microscopique des gaz et de la matiere en general. Elle a egalement ete un point de questionnement fondamental au moment de la construction de la physique quantique. Dans cette epreuve, on se propose d'expliquer a l'aide de differents modeles theoriques les valeurs mesurees de la capacite thermique de differents gaz parfaits diatomiques a differentes temperatures. Hormis le nombre i tel que i2 = -1, les nombres complexes sont soulignes : z C. Les vecteurs seront traditionnellement surmontes d'une fleche, par exemple !v pour une vitesse ; sauf s'ils sont unitaires et seront alors surmontes d'un chapeau, par exemple u ! tel que #! u# = 1. I. -- De la molecule a l'oscillateur harmonique On considere une molecule diatomique dont les deux atomes A et B sont lies par une liaison covalente : l'energie potentielle d'interaction entre les deux atomes est attractive a longue portee et repulsive a courte portee. L'etude est menee dans le referentiel du laboratoire suppose galileen. On suppose la molecule isolee et on neglige l'interaction gravitationnelle entre les deux atomes devant l'interaction conduisant a la liaison covalente. 1 -- Tracer l'allure du profil d'energie potentielle Ep de cette molecule en fonction de la longueur = AB de la liaison. On y fera figurer la longueur d'equilibre e de la liaison et l'energie de liaison E . 2 -- Donner un ordre de grandeur de e en nm et de E en kJ·mol-1 . 3 -- Compte tenu de l'allure de la courbe de la question 1, et moyennant une hypothese a preciser, justifier que l'on peut assimiler la liaison covalente a un ressort dont on exprimera la constante de raideur k en fonction d'une derivee de Ep . On suppose cette approximation valide dans toute la suite. 4 -- Exprimer l'energie cinetique de la molecule en fonction des vitesses !vA , !vB et des masses mA , mB des atomes A et B dans le referentiel du laboratoire. 5 -- Calculer un ordre de grandeur de la vitesse caracteristique des molecules dans l'air J · mol-1 · K -1 pour valeur de la a 300 K et sous une pression de 1 atm. On prendra R = 25 3 -1 -3 constante des gaz parfait et Ma = 30 × 10 kg · mol pour la masse molaire de l'air. 6 -- Exprimer l'energie mecanique Em de la molecule dans le referentiel du laboratoire, en fonction de E , , e , k, !vA et !vB . - -- 7 -- On note G le barycentre de la molecule tel que mA GA + mB GB = !0 et !vG sa vitesse dans le referentiel du laboratoire. On appelle referentiel barycentrique, le referentiel ayant les memes vecteurs de base que le referentiel du laboratoire mais d'origine G. Ce referentiel est-il galileen ? On justifiera sa reponse. - " # dAB , etablir la relation Em - E = 21 m #!vG #2 + µ #!v #2 + kr2 dans 8 -- On note !v = dt laquelle on exprimera les constantes m et µ en fonction des masses mA , mB et la variable r en fonction de et e . Page 1/4 Tournez la page S.V.P. La capacite thermique des gaz - 9 -- En ecrivant AB = (t) e!r avec e!r = - AB - , #AB # decomposer Em en la somme de trois termes que l'on supposera independants dans ce probleme et qui representent respectivement la translation Etra , la vibration Evib et la rotation Erot de la molecule. On explicitera chacun de ces termes en fonction des grandeurs les plus adaptees. FIN DE LA PARTIE I II. -- Capacite thermique d'un gaz parfait diatomique On s'interesse maintenant a un gaz parfait de N molecules diatomiques identiques. On cherche a determiner l'expression de la capacite thermique de ce gaz en exploitant le modele developpe dans la partie precedente. 10 -- Exprimer l'energie interne U de cet ensemble de particules en fonction de N et &Em ', ou &Em ' est l'energie moyenne d'une molecule de cet ensemble de molecules. 11 -- Enoncer le theoreme d'equipartition de l'energie. 12 -- Montrer que dans le modele classique developpe dans la partie I la capacite thermique molaire cV,m du gaz est une constante que l'on exprimera en fonction de R. La figure 1 presente les releves experimentaux de la capacite thermique molaire du dichlore Cl2 gazeux et du dihydrogene H2 gazeux a diverses temperatures. 4 3.5 3 / !",# $ 2.5 Cl2 2 H2 1.5 1 0 10 Température [K] 1 2 10 10 3 10 Figure 1 Mesures de la capacite thermique molaire du dichlore (Cl2 ) et du dihydrogene (H2 ) gazeux en fonction de la temperature. 13 -- Commenter les deux courbes de la figure 1 au vu des predictions theoriques obtenues precedemment. FIN DE LA PARTIE II Page 2/4 Physique II, annee 2017 -- filiere MP III. -- L'oscillateur harmonique en physique quantique On envisage dans cette partie un traitement quantique de l'oscillateur harmonique etudie dans les parties precedentes. L'objectif est d'obtenir l'expression quantifiee des valeurs possibles de l'energie de cet oscillateur harmonique dans cette theorie. On note (x,t) la fonction d'onde du systeme decrivant l'oscillateur harmonique associe a la molecule diatomique consideree. Ce systeme est un point materiel M dont la masse est le parametre µ introduit a la question 8. Ce point evolue evolue le long d'un axe (O,! ux ), la distance x = OM represente l'elongation du ressort de raideur k modelisant la liaison chimique entre les deux atomes a travers le potentiel V (x) = 12 kx2 . Il s'agit donc d'un probleme unidimensionnel. Le systeme est de plus stationnaire, on peut donc separer la fonction d'onde en deux parties iE sous la forme (x,t) = f (x)e- ! t ou E represente les valeurs de l'energie accessibles a ce systeme. Pour l'oscillateur harmonique, on montre que ces valeurs de E doivent etre positives. La fonction (x,t) est une solution de norme unite de l'equation de Schrodinger - (x,t) !2 2 (x,t) + V (x)(x,t) = i! 2 2µ x t 14 -- Ecrire l'equation differentielle verifiee par la fonction f (x) en fonction des parametres k, µ, ! et E. $ %1/4 $ %1/2 µk 4µ E 2 On effectue le changement de variable = x . et l'on pose = !2 !2 k 15 -- Quelles sont les dimensions de et de ? 16 -- Ecrire l'equation differentielle verifiee par la fonction f () en fonction du seul parametre . 1 2 17 -- Verifier que dans le regime ±, on peut ecrire f () e± 2 1 2 18 -- Justifier succinctement que seule la solution * e- 2 est physiquement acceptable. Des lors que nous connaissons le comportement asymptotique de la solution recherchee, nous 1 2 pouvons l'extraire de celle-ci en effectuant le changement de fonction f () = g()e- 2 19 -- Determiner l'equation differentielle verifiee par la fonction * g() ? Pour resoudre cette equation, on effectue un developpement en serie entiere de la fonction g : g() = + & bp p p=0 20 -- Exprimer le coefficient bp+2 en fonction du coefficient bp , de l'entier p et de . Si l'on conserve tous les termes de la serie, on montre que le comportement asymptotique de la fonction * g() l'emporte sur exp(-2 /2) en ± ce qui ne permet pas de construire de solution physiquement acceptable. La seule possibilite est de tronquer la serie en imposant l'existence d'un entier n tel que si p n alors bp+2 = 0. 21 -- En deduire que les energies accessibles a un oscillateur harmonique en regime quantique sont de la forme % $ 1 ! avec n N En = n + 2 ou est une grandeur que l'on exprimera en fonction de µ et k. FIN DE LA PARTIE III Page 3/4 Tournez la page S.V.P. La capacite thermique des gaz IV. -- Capacite thermique et quantification Comme dans la partie II, on s'interesse a un ensemble de N molecules diatomiques identiques. Ce gaz est a l'equilibre thermique a la temperature T . La probabilite (E) qu'une molecule de ce gaz se trouve dans un etat d'energie En s'ecrit (En ) = A exp(-En ) ou est une fonction de kB et de T uniquement. 22 -- Par analyse dimensionnelle, exprimer en fonction de kB et de T . Contrairement a la partie II ou l'on avait utilise l'expression classique de l'energie, on utilise maintenant l'expression de l'energie de l'oscillateur harmonique obtenue dans le modele quantique a la question 21. C'est Albert Einstein qui eut cette idee le premier en 1907 afin de tenter de regler certains problemes de la physique classique dans le traitement du comportement des solides a basse temperature. L'idee est ici la meme, mais rend compte de la vibration des molecules diatomiques. 23 -- Exprimer la constante A en fonction de !, , . 24 -- En deduire l'expression de l'energie moyenne &E' de l'ensemble de ces N particules en fonction de !, , et N . 25 -- Montrer que la capacite thermique molaire a volume constant cV,m de ce gaz s'ecrit cV,m 2 =R sinh2 () 1,0 1 avec = ! 2 On designe par Tv la temperature, dite de vibration, caracteristique des vibrations de la molecule ! . qui est telle que Tv = kB &(%) 0,8 0,6 26 -- Reecrire l'expression de cV,m en fonction de Tv et T . 0,4 La figure 2 represente l'allure de la fonction 0,2 0 0 (u) = u-2 /sinh2 (u-1 ) % 1 2 3 4 Figure 2 Graphe de (u) Molecule Tv [K] 1 H2 6 220 2 H2 4 390 5 1 27 -- La table ci-dessous fournit la temperature de vibration de quelques molecules diatomiques. Quelle partie des mesures presentees sur la figure 1 le modele est-il cense representer ? La theorie est-elle en accord avec l'experience ? H-2 H 5 380 Cl2 808 FIN DE LA PARTIE IV FIN DE L'EPREUVE Page 4/4 Br2 463 HCl 4 230 HBr 3 790