X/ENS Physique MP 2021
| Thème de l'épreuve | Thermodynamique de l'atmosphère |
| Principaux outils utilisés | thermodynamique |
| Mots clefs | nuage, évaporation, changement d'état, atmosphère, machines thermiques |
Corrigé
:👈 gratuite pour tous les corrigés si tu crées un compte
👈 l'accès aux indications de tous les corrigés ne coûte que 1 € ⬅ clique ici
👈 gratuite pour tous les corrigés si tu crées un compte
- - - - - - - - - -
👈 gratuite pour ce corrigé si tu crées un compte
- - - - - - - - - - - - - - - - - - - - - - - - - - - - - - -
Énoncé complet
(télécharger le PDF)










Rapport du jury
(télécharger le PDF)


Énoncé obtenu par reconnaissance optique des caractères
ECOLE POLYTECHNIQUE
ECOLES NORMALES SUPERIEURES
CONCOURS D'ADMI SSION 2021
MERCREDI 14 AVRIL 2021
08h00 - 12h00
FILIERE MP - Epreuve n° 5
PHYSIQUE (XULCR)
Durée : 4 heures
L'utilisation des calculatrices n'est pas
autorisée pour cette épreuve
Thermodynamique de l'atmosphère
Ce sujet aborde la structure de l'atmosphère sous l'angle de la
thermodynamique. Il comporte
trois parties. Bien que le contexte général soit établi dans la première
partie, les trois parties du
sujet peuvent être abordées indépendamment. Certaines définitions et relations
de thermody-
namique sont rappelées en annexe à la fin du texte, ainsi que les valeurs de
certaines grandeurs
apparaissant dans les applications numériques. Les résultats des applications
numériques seront
donnés avec un seul chiffre significatif, à l'exception des trois premières
questions pour lesquelles
on donnera deux chiffres significatifs.
1 Structure verticale de l'atmosphère
On considère dans cette section des modèles d'atmosphères de complexité
croissante, afin
d'isoler les processus physiques qui gouvernent le profil de température
vertical de l'atmosphère.
On considère tout d'abord les processus radiatifs : on admet qu'un système plan
infini à
température T émet par rayonnement un flux surfacique d'énergie @ = sT* (en
watts par
mètre carré), le flux étant dirigé vers l'extérieur. Dans les situations
considérées ci-après, ce
flux correspond à du rayonnement infrarouge. Le coefficient s -- 5,67 x 10° Wim
°.K "est
appelé constante de Stefan. On néglige la courbure de la Terre dans cette
première partie, et
on considère donc la surface de la Terre comme localement plate.
1) Dans un premier modèle, on considère que la surface terrestre absorbe un
flux solaire incident
I -- 220 W.m *, considéré uniforme et indépendant du temps. A l'équilibre, la
Terre ré-
émet l'intégralité de l'énergie reçue par rayonnement vers le haut. En déduire
la température
d'équilibre de surface 7, de la Terre dans ce modèle. Faites une application
numérique en vous
aidant de l'annexe. Commentez le résultat.
2) Un raffinement du modèle consiste à inclure une atmosphère infiniment fine
située à une
hauteur h au-dessus de la surface de la Terre. Cette atmosphère est
transparente au rayon-
nement solaire incident, mais elle est entièrement absorbante pour le
rayonnement infrarouge
émis par la Terre. Elle atteint une température d'équilibre 7, si bien qu'elle
rayonne elle aussi
un flux d'énergie sT% vers le haut, mais aussi un flux s7% vers le bas.
Calculez la température
1, d'équilibre de l'atmosphère, ainsi que la nouvelle température d'équilibre
7, de surface de
la Terre. Faites une application numérique en vous aidant de l'annexe.
Commentez le résultat
obtenu. Comment s'appelle l'effet mis en évidence par ce modèle simple ?
On oublie un instant les modèles radiatifs précédents, pour se concentrer sur
la thermody-
namique du fluide atmosphérique. On suppose que l'atmosphère est un gaz parfait
diatomique.
3) Rappelez quels sont les deux constituants principaux de l'atmosphère ainsi
que leurs pro-
portions. En déduire une valeur approchée de la masse molaire moyenne M de
l'air.
On donne la différentielle de l'entropie du gaz parfait:
d$ = nC,d In (rs) | (1)
où 9, T', et P désignent l'entropie, la température et la pression du gaz. On
désigne de plus
par ñn la quantité de matière (nombre de moles), et on définit 7 = C,/C,, où C,
est la capacité
calorifique molaire à pression constante du gaz, et C, est sa capacité
calorifique molaire à
volume constant. Ces deux grandeurs sont également reliées par la relation de
Mayer, rappelée
en annexe.
4) On s'intéresse au modèle isentropique, pour lequel l'entropie du gaz est
supposée indépendante
de la coordonnée verticale z. Ecrire tout d'abord l'équilibre hydrostatique
d'une parcelle
d'atmosphère, puis calculer le profil de température T(z) associé à ce modèle,
en fonction
de la température T4 à la surface z -- 0 de la Terre, de l'accélération g de la
pesanteur (sup-
posée constante), de la capacité calorifique molaire C, de l'air (supposée
constante également),
et de la masse molaire moyenne M de l'air.
5) Faites une application numérique pour le gradient de température l = d7'/dz
dans ce modèle.
On pourra considérer l'air comme un gaz parfait diatomique.
On souhaite justifier la pertinence de ce modèle d'atmosphère isentropique.
Dans ce but,
on considère une atmosphère ayant un profil de température initial T(z)
quelconque (les profils
de densité p(z) et de pression P(z) se déduisent de ce profil de température
par l'équilibre
hydrostatique et la loi des gaz parfaits). On isole une parcelle de fluide à
l'altitude initiale z; qui
constitue le système fermé étudié. Ce système est initialement à la température
T; = T(2;), et à
la pression P;, = P(z;). On suppose qu'une perturbation externe déplace la
parcelle considérée
à l'altitude z; + dz, de façon adiabatique et quasi-statique (réversible), où
dz représente un
déplacement infinitésimal. Le système s'équilibre donc rapidement à la pression
P; = P(2;+d2).
6) Calculez la température T} du système à l'issue de cette transformation, en
fonction de P,,
P f: T;. k et Cp.
7) Discutez le mouvement vertical ultérieur de la parcelle d'atmosphère, selon
que T} < T2; + dz) ou T} > T(z,+dz2). Quelle situation correspond à une atmosphère stable ? à
une atmosphère
instable ? On appelle ce phénomène l'instabilité convective.
8) Le cas où 7°; = T(2; + dz) s'appelle le cas "marginalement stable". Quel est
le gradient de
température vertical l = d1'/dz de l'atmosphère dans cette situation
marginalement stable ?
Commentez, en lien avec les questions 4) et 5).
On revient à un modèle purement radiatif, que l'on complexifie en prenant en
compte
l'absorption et la ré-émission de rayonnement par chaque tranche élémentaire
d'atmosphère.
Pour un profil donné du coefficient d'absorption de rayonnement infrarouge par
l'atmosphère,
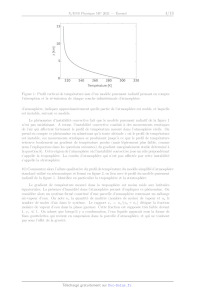
ce modèle conduit au "profil radiatif" de température représenté en figure 1.
9) Après avoir estimé le gradient de température dans les hautes et basses
couches de ce modèle
10-
z [km]
220 240 260 280 300 320
Température [K]
Figure 1: Profil vertical de température issu d'un modèle purement radiatif
prenant en compte
l'absorption et la ré-émission de chaque couche infinitésimale d'atmosphère.
d'atmosphère, indiquez approximativement quelle partie de l'atmosphère est
stable, et laquelle
est instable, suivant ce modèle.
Le phénomène d'instabilité convective fait que le modèle purement radiatif de
la figure 1
n'est pas satisfaisant. À terme, l'instabilité convective conduit à des
mouvements erratiques
de l'air qui affectent fortement le profil de température mesuré dans
l'atmosphère réelle. On
prend en compte ce phénomène en admettant qu'à toute altitude z où le profil de
température
est instable, ces mouvements erratiques se produisent jusqu'à ce que le profil
de température
retrouve localement un gradient de température proche (mais légèrement plus
faible, comme
nous l'expliquerons dans les questions suivantes) du gradient marginalement
stable déterminé à
la question 8). Cette région de l'atmosphère où l'instabilité convective joue
un rôle prépondérant
s'appelle la troposphère. La couche d'atmosphère qui n'est pas affectée par
cette instabilité
s'appelle la stratosphère.
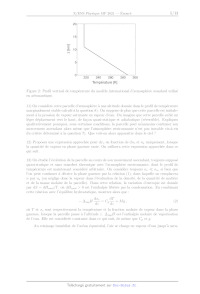
10) Commentez alors l'allure qualitative du profil de température du modèle
simplifié d'atmosphère
standard utilisé en aéronautique et fourni en figure 2, en lien avec le profil
du modèle purement
radiatif de la figure 1. Identifiez en particulier la troposphère et la
stratosphère.
Le gradient de température mesuré dans la troposphère est moins raide aux
latitudes
équatoriales. La présence d'humidité dans l'atmosphère permet d'expliquer ce
phénomène. On
considère alors un système fermé constitué d'une parcelle d'atmosphère
contenant un mélange
air-vapeur d'eau. On note n, la quantité de matière (nombre de moles) de vapeur
et n, le
nombre de moles d'air dans le système. Le rapport x, = n,/(na + n,) désigne la
fraction
molaire de vapeur d'eau dans la phase gazeuse. Cette fraction est supposée très
faible devant
1, x, EUR 1. On admet que lorsqu'il y a condensation, l'eau liquide apparaît
sous la forme de
fines gouttelettes qui restent en suspension dans la parcelle d'atmosphère, et
qui ne tombent
pas sous l'effet de la gravité.
20
15!
10!
z [km]
220 240 260 280 300
Température [K]
Figure 2: Profil vertical de température du modèle international d'atmosphère
standard utilisé
en aéronautique.
11) On considère cette parcelle d'atmosphère à une altitude donnée dans le
profil de température
marginalement stable calculé à la question 8). On suppose de plus que cette
parcelle est initiale-
ment à la pression de vapeur saturante en vapeur d'eau. On imagine que cette
parcelle subit un
léger déplacement vers le haut, de façon quasi-statique et adiabatique
(réversible). Expliquez
qualitativement pourquoi, sous certaines conditions, la parcelle peut néanmoins
continuer son
mouvement ascendant alors même que l'atmosphère environnante n'est pas instable
vis-à-vis
du critère déterminé à la question 7). Que voit-on alors apparaitre dans le
ciel ?
12) Proposez une expression approchée pour dx, en fonction de dn, et n,;
uniquement, lorsque
la quantité de vapeur en phase gazeuse varie. On utilisera cette expression
approchée dans ce
qui suit.
13) On étudie l'évolution de la parcelle au cours de son mouvement ascendant,
toujours supposé
quasi-statique et sans transfert thermique avec l'atmosphère environnante, dont
le profil de
température est maintenant considéré arbitraire. On considère toujours n,; &
n,, si bien que
l'on peut continuer à décrire la phase gazeuse par la relation (1), dans
laquelle on remplacera
n par nr, (on néglige donc la vapeur dans l'évaluation de la densité, de la
quantité de matière
et de la masse molaire de la parcelle). Dans cette relation, la variation
d'entropie est donnée
par dS = dHiona/T, Où dHiona > 0 est l'enthalpie libérée par la condensation.
En combinant
cette relation avec l'équilibre hydrostatique, montrez alors que :
dry dT
-- Avant = Ca + M9, (2)
où Jet x, sont respectivement la température et la fraction molaire de vapeur
dans la phase
gazeuse, lorsque la parcelle passe à l'altitude z. À,,, A est l'enthalpie
molaire de vaporisation
de l'eau. Elle est considérée constante dans ce qui suit, de même que C, et g.
Au voisinage immédiat de l'océan équatorial, l'air se charge en vapeur d'eau
jusqu'à satu-
4
z=h un OR DRRRRRRRRn nn nnnnanmu
To D» 7 < T Surface océanique, z=0 + | | ® 4: 30°S 0° 30°N latitude Figure 3: La circulation de Hadley correspond aux mouvements atmosphériques dominants dans un plan méridional (latitude - altitude). La température de surface au niveau de l'océan est supérieure au voisinage de l'équateur (T;) qu'aux latitudes subtropicales (75 < T;). Les flèches illustrent la direction dominante du vent. ration. La fraction molaire en vapeur d'eau initiale, et) est alors de 4%, et la température de l'ordre de 30 °C. Cette atmosphère humide consiste en de nombreuses parcelles isolées d'atmosphère, identiques au système précédent, qui ont un mouvement ascendant depuis le niveau de la mer 2 -- 0 jusqu'au sommet de la troposphère, à une altitude À -- 10 km. On suppose que toute la vapeur est condensée lorsqu'une telle parcelle atteint l'altitude A. 14) Calculez alors le gradient de température moyen l} = (T(h) -- T(0))/h en fonction de M, 9; Cp: À, Avap/1, et et). l', est appelé le "gradient de température de l'atmosphère humide". 15) Donnez la valeur numérique du gradient de température de l'atmosphère humide l'}, en considérant l'atmosphère comme un gaz parfait diatomique. On donne l'enthalpie de vapori- sation de l'eau : A, AH = 4,1 x 10% J.mol-!. Commentez le résultat, en lien avec le profil du modèle international d'atmosphère standard fourni en figure 2. 16) On représente sur la figure 3 la circulation de Hadley, qui est le principal courant méridional de l'atmosphère au voisinage de l'équateur. Pourquoi la température de surface est-elle supérieure au voisinage de l'équateur (71), par rapport aux latitudes subtropicales (75 < T1)? Com- mentez alors la structure de cette circulation : direction des mouvements d'air, présence de précipitations équatoriales, etc. On souhaite établir la dépendance de la pression de vapeur saturante de vapeur d'eau Px(T) avec la température. Pour cela, on considère un système fermé, formé uniquement d'eau liquide et de vapeur d'eau en co-existence (sans air). On note Gn(T, P) l'enthalpie libre molaire de la phase liquide et Gy; m(T, P) celle de la phase vapeur. De même, on note VimtT, P) et Vim(T, P) les volumes molaires de ces deux phases, et S,,(7, P) et Sum(T, P) leurs entropies molaires. 17) Exprimez la différentielle de Gim(T, P) en fonction de WA(T, P), Sim(T, P), et des diffé- 9 rentielles de T'et P. Exprimez de même la différentielle de G, (1°, P) en fonction de V,, (7, P), Sum(T, P), et des différentielles de T'et P. En utilisant l'extensivité de l'enthalpie libre G du système complet, donnez son expression en fonction de Gim(1, P), Gym(T, P), de la quantité de matière en phase vapeur n, et de la quantité de matière totale n. 18) On considère la situation où T' et P sont imposées par un thermostat et un réservoir de pression. On admet que G est un potentiel thermodynamique dans cette situation. Exprimez alors la condition d'équilibre liquide-vapeur en fonction de Gym EURt Gim- 19) On considère deux points sur la courbe de coexistence liquide-vapeur, de coordonnées (T', Pix (T7) et (T + AT, Px(T + dT)). Ecrire la condition d'équilibre liquide-vapeur aux deux points considérés en fonctions des enthalpies libres molaires des deux phases. Soustraire ces deux conditions d'équilibre pour obtenir la relation de Clapeyron : d'Ésat _ Avyap 1 (3) dr TV m Vi m) En déduire le sens de variation de la pression de vapeur saturante avec la température. 20) On néglige le volume molaire de la phase liquide devant celui de la phase gazeuse, et on assimile la vapeur à un gaz parfait à la pression Fix. On considère de plus que A,4,, A est indépendante de la température. Montrez alors que la pression de vapeur saturante s'exprime sous la forme : PT : : NÉUIRTER) o Fiat (T5) To T où 7, est une température de référence arbitraire, et où vous donnerez l'expression de C. 21) On considère que l'eau existe dans l'océan et l'atmosphère sous deux formes, HO et HO, formées respectivement avec les isotopes 16 et 18 de l'oxygène. Ces deux isotopes sont stables du point de vue de la radioactivité. Les deux types de molécules d'eau se caractérisent par des enthalpies molaires de vaporisation différentes, et donc des pressions de vapeur saturante différentes. Expliquez comment la fraction de H20Y% dans les calottes glaciaires fournit un historique de la température de l'atmosphère terrestre. 2 La troposphère vue comme une machine thermique On se propose de modéliser le courant atmosphérique représenté sur la figure 3 par une machine thermique cyclique. La thermodynamique nous permet alors de déterminer une borne supérieure sur la fraction du transfert thermique incident qui est transformée en travail mécanique sous la forme de vents. Dans ce but, on revient dans un premier temps sur le fonc- tionnement et le rendement des moteurs dithermes cycliques. Pour les applications numériques demandées dans les deux dernières questions de cette partie, on considèrera la Terre comme une sphère dont le rayon vaut approximativement 6400 km. 22) On considère tout d'abord un moteur ditherme cyclique en interaction avec un thermostat chaud de température T4 et un thermostat froid de température 7};. Défnissez le rendement £ de ce moteur. Etablissez la valeur théorique maximale £. de ce rendement (le rendement de Carnot), atteinte si les transformations associées au cycle sont réversibles. Une machine thermique entièrement réversible n'est pas un bon modèle d'une machine réelle : les processus mis en jeu doivent être infiniment lents, en particulier les transferts thermiques. Si le travail fourni par la machine est non nul, ce travail est fourni en un temps infini ! Autrement dit, la puissance engendrée (travail fourni par unité de temps) tend vers zéro dans la limite de transformations parfaitement réversibles. Pour résoudre ce problème on considère la situation représentée sur la figure 4. La machine comprend un fluide, le système JF à l'intérieur du cadre pointillé, qui subit de façon cyclique 4 transformations : 1. Une étape isotherme, à température 7, pendant laquelle le fluide reçoit un transfert thermique algébrique Q, depuis le thermostat chaud, à température T,. Le thermostat est connecté au système par une résistance thermique À. Cette étape est supposée durer un temps 7. On notera que la température au voisinage immédiat du système F (au bord du domaine pointillé) est bien 7: : c'est la température effective de la source chaude pour le système F. 2. Une détente adiabatique rapide du fluide. Si nécessaire, une telle détente peut être ef- fectuée rapidement tout en restant réversible (il suffit que le temps soit long devant le temps de propagation des ondes sonores dans le fluide). Sa durée est donc négligeable par rapport au temps 7. 3. Une étape isotherme, à température 7, pendant laquelle le fluide reçoit un transfert thermique algébrique Q:, à travers une résistance thermique À, depuis un thermostat froid à température 7}. Cette étape dure un temps 7 égal à celui de l'étape 1. On notera encore une fois que la température au voisinage immédiat du système Æ est T; : c'est la température effective de la source froide pour le système F. 4. Une compression adiabatique rapide du fluide (qui peut néanmoins être réversible, si nécessaire), dont la durée est négligeable par rapport au temps r. On note W le travail algébrique reçu par le système pendant un cycle. Les températures des thermostats T° et T°}; sont fixées, mais on suppose que l'on peut ajuster les températures de fonctionnement 71; et 1; du moteur pour obtenir un fonctionnement optimal. 23) Donnez les signes de Q:1, Q2 et W dans ce qui vous semble être le régime de fonctionnement normal du moteur. Ordonnez les températures Te, T}, Ti et T2 dans ce régime de fonction- nement, en justifiant très brièvement. On supposera cet ordre des températures respecté dans la suite. 24) Exprimez les transferts thermiques algébriques Q1 et Q2 reçus par le système Æ pendant les étapes 1 et 3, en fonction de À, Ti, T2, Te, Tfet T. travail -W Système À. |. D" >
résistance 2 | résistance
thermique _ : : thermique
source JT: T': @ G : T2 T Source
chaude 2 R| | R. ; froide
1 2
@ |
Figure 4: Une machine cyclique est connectée aux sources chaude et froide par
le biais de
résistances thermiques. Le système Æ subit alors de façon cyclique les 4 étapes
décrites dans
le texte, représentées schématiquement par les chiffres entourés.
25) Définissez la puissance motrice P fournie par le moteur. Exprimez P en
fonction de À, Ti,
T2, T$ et Te.
26) À l'aide du second principe de la thermodynamique, établir une inégalité
entre T3, D, T}
et T,. Pour simplifier les calculs, on admet que le rendement maximal est
obtenu lorsque les
transformations sont réversibles pour le système F. On remplacera alors cette
inégalité par une
égalité dans ce qui suit.
27) A l'aide des réponses aux deux questions précédentes, éliminez T; pour
exprimer la puissance
P sous la forme :
Te
P= x x (An), (5)
où l'on à introduit les paramètres X = 75/T. et n = T;/T.
28) À l'aide des réponses aux questions précédentes (en particulier la question
23), montrez que
X > 1/2.
29) En pratique, les moteurs réels fonctionnent dans un régime où 7; (et donc
72) est choisie
pour maximiser la puissance motrice délivrée, à Te et T; fixées. Calculez la
valeur X, de X
associée à ce maximum, en fonction de 7. Donnez la valeur du maximum de
puissance en
fonction de À, T, et n.
30) Donnez l'expression du rendement £ du moteur en fonction de X et 7. Montrez
que le
rendement du moteur à puissance maximale vaut £(X,) -- 1 -- nl/2. Comment cette
expression
du rendement se compare-t-elle au rendement de Carnot ?
31) La différence de valeur entre ces deux rendements signifie que certains
processus apparais-
sant sur la figure 4 sont irréversibles. Quels sont-ils ? On définit le taux de
création d'entropie
S comme le rapport de l'entropie créée par ces processus irréversibles pendant
un cycle divisée
par la durée d'un cycle. En appliquant le second principe de la thermodynamique
à un système
judicieusement choisi, calculez $ en fonction de À et 7 dans le régime de
fonctionnement à
puissance maximale du moteur.
On souhaite appliquer le modèle précédent aux courants atmosphériques. Le
système est la
totalité de la troposphère, que l'on considère comme une couche de fluide de
hauteur À = 10 km
à la surface de la Terre, et de densité p -- 1 kg.m * considérée constante pour
ces calculs d'ordre
de grandeur. Le transfert thermique Q; recu par la troposphère est dû au
rayonnement solaire
incident qui atteint la surface terrestre. Ce rayonnement a une intensité Z --
220 W.m * en
moyenne sur une journée et sur toute la surface de la Terre. Q correspond alors
au transfert
thermique sous forme de rayonnement infrarouge émis au niveau du sommet de la
troposphère
(on néglige la stratosphère), tandis que |W{ est l'énergie qui est transformée
en travail moteur
sous la forme de vents, ou courants atmosphériques. La température moyenne au
niveau du
sol est 7; -- 290 K, tandis que la température moyenne au sommet de la
troposphère est
T1 = 220 K.
32) En supposant que le système fonctionne à puissance maximale, calculez
approximativement
l'énergie cédée aux vents et courants atmosphériques par unité de temps.
33) On admet que les courants atmosphériques ainsi engendrés dissipent leur
énergie cinétique
à un taux D (énergie dissipée par unité de temps), de l'ordre de D = 0,05 x
MU*/h, où M
est la masse totale de la troposphère et Ü la vitesse typique des courants
atmosphériques. En
déduire un ordre de grandeur de U. Commentez.
3 Nucléation et formation des nuages
On s'intéresse à la formation des nuages, et on considère donc un système
constitué d'eau
liquide et d'un mélange gazeux air-vapeur d'eau. On note PF, la pression
partielle de vapeur
dans le gaz, et P.4(T) la pression de vapeur saturante.
34) Donnez la relation entre le potentiel chimique /4(T°) de l'eau liquide,
supposé ne dépendre
que de la température, et le potentiel u,[T, P, = Pix(T)] de la vapeur d'eau à
la pression de
vapeur saturante ?
On considère maintenant une pression de vapeur quelconque, et on s'intéresse à
l'évolution d'une
gouttelette d'eau liquide dans l'atmosphère. L'existence d'une interface de
surface À entre le
liquide et le gaz conduit à un terme d'énergie de surface supplémentaire, o À,
qu'il convient
d'ajouter à l'énergie du système (ou au potentiel thermodynamique considéré).
Le coefficient
o est une constante positive appelée tension de surface. Son unité est le
kg.s_*. Le système
considéré contient un nombre fixe de molécules d'air, et un nombre total fixe
ny = 7 + n, de
moles d'eau, où n, est le nombre de moles d'eau liquide et n, le nombre de
moles de vapeur
d'eau. Le système est maintenu à pression et température constante.
35) Exprimez la différentielle de l'enthalpie libre du système en fonction de
©, À, {uy, Lu, n
atmosphère
particule (air+vapeur d'eau)
solide
eau liquide
Figure 5: Une particule fine solide comporte une cavité conique ouverte sur
l'extérieur. On
considère la possibilité que de l'eau liquide apparaisse sous la forme d'un
domaine conique au
fond de la cavité.
et/ou leurs différentielles.
36) On suppose que la phase liquide consiste à tout instant en une gouttelette
d'eau sphérique
de rayon r et de masse volumique constante po -- 1000 kg.m *. Exprimez la
différentielle de
l'enthalpie libre en fonction de Ju, y, po, r, o, Mio et dr, où WMy,o est la
masse molaire de
l'eau.
37) Intégrez cette relation pour obtenir l'enthalpie libre G(r) (à une
constante près, qui ne joue
pas de rôle dans ce qui suit). Tracez l'allure de G(r) pour y et u, fixés. On
distinguera les cas
Hi < Hu EÙ Li > y:
38) Discutez l'évolution de la gouttelette suivant son rayon initial, en
distinguant à nouveau
les cas zu < y et lu > ,. Quand cela est pertinent, on identifiera une valeur
remarquable
r. de r, dont on donnera l'expression en fonction des mêmes paramètres qu'à la
question 36).
On définira également une "énergie d'activation" pour l'apparition de la phase
liquide, lorsque
l'on part uniquement d'un mélange gazeux air-vapeur d'eau, dont on donnera
l'expression en
fonction de ces mêmes paramètres.
39) On modélise la phase gazeuse comme un mélange de gaz parfaits. A l'aide de
l'expression du
potentiel chimique donnée en annexe, que l'on appliquera à la vapeur d'eau,
exprimez le rayon
critique au-delà duquel une gouttelette croit spontanément en fonction de la
"sursaturation"
X -- Ps Psat(T) > let de M0. ©, Po; kR et T..
40) À partir de vos connaissances sur la loi d'Arrhénius, ou sur le facteur de
Boltzmann,
proposez une expression pour la dépendance de la vitesse d'apparition des
gouttelettes dans
l'atmosphère en fonction de la sursaturation x (cette expression sera obtenue à
une constante
multiplicative près). Commentez cette dépendance en y.
On considère la situation représentée sur la figure 5 : une particule solide en
suspension dans
l'atmosphère présente une cavité conique ouverte sur l'extérieur, de demi-angle
d'ouverture 6.
10
On étudie la possibilité que de l'eau liquide se forme à partir du fond de la
cavité, selon la
géométrie représentée sur la figure 5. L'eau liquide occupe alors un domaine
conique dont la
base est un disque de rayon r perpendiculaire à l'axe du cône. Le volume d'un
tel cône est
mr/l/3, où L est la hauteur du cône.
41) On fait l'hypothèse que seule l'interface liquide-gaz intervient dans le
terme de tension de
surface, et donc que l'interface solide-liquide n'engendre aucun terme de
tension de surface.
Exprimez la différentielle de l'enthalpie libre en fonction de /4, Huy, po, T,
6, Mio, 0 et dr.
42) Comme à la question 38), identifiez une valeur remarquable de r. Exprimez
l'énergie
d'activation associée en fonction de &, M0, Po, Lu, Hu et 0.
43) Expliquez alors pourquoi la présence de particules en suspension dans
l'atmosphère favorise
l'apparition de nuages.
Quelques rappels
Pour simplifier certaines applications numériques, on donne les racines
quatrièmes suivantes :
(220/5,67)//4 + 2,5 et 2/4 + 1,2.
Thermodynamique générale
Pour un système formé de N constituants (ou phases) de potentiels chimiques y;,
avec les
quantités de matière n;, la différentielle de l'énergie interne s'écrit :
dU = TdS -- PaV + ES idn; (6)
et l'enthalpie libre est définie par G = ÙU + PV -- TS. Le dernier terme de la
différentielle
(6) n'apparaît pas lorsque l'on considère une phase pure ou un système sans
transformation de
phases (dn; = 0).
Thermodynamique des gaz parfaits
On rappelle la relation de Mayer pour un gaz parfait, C, -- C; = À, où la
constante des gaz
parfaits vaut À = 8.314 J.K=!mol !. Dans un mélange de gaz parfaits. le
potentiel chimique
1; d'un constituant ? est donné par la relation :
P,;
(PT) = WT) + RTS. (7)
0
où pi0) est une fonction qui ne dépend que de la température, PF; désigne la
pression partielle
du constituant ?, et F, = 1 bar est une pression de référence.
11
Masses molaires
On rappelle les masses molaires de l'hydrogène, du carbone, de l'azote et de
l'oxygène : My --
1,0 g.mol !, Mo = 12 g.mol !, Mn = 14 g.mol !, M5 = 16 g.mol !.
12