CCINP Chimie 1 PC 2001
| Thème de l'épreuve | Propriétés des éléments zinc et magnésium. Synthèse en série aromatique. |
| Principaux outils utilisés | atomistique, cristallographie, diagramme potentiel-pH, mélanges binaires, thermochimie, diagrammes d'Ellingham, chimie organique, synthèse aromatique, nitration, spectroscopie RMN, amides, composés azoïques, organomagnésiens |
Corrigé
:👈 gratuite pour tous les corrigés si tu crées un compte
👈 l'accès aux indications de tous les corrigés ne coûte que 1 € ⬅ clique ici
👈 gratuite pour tous les corrigés si tu crées un compte
- - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - -
👈 gratuite pour ce corrigé si tu crées un compte
- - - - - - - - - - - - - - - - -
Énoncé complet
(télécharger le PDF)










Énoncé obtenu par reconnaissance optique des caractères
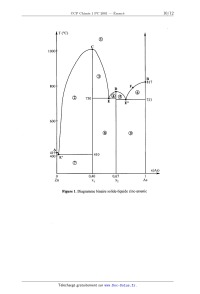
SESSION 2001 PCOO7 CONCOURS (OMMUNS POlYTECHNIOUES ÉPREUVE SPÉCIFIQUE - FILIÈRE PC CHIMIE 1 DURÉE: 4 heures Distribuer aux candidats deux feuilles de papier millimètré L'usage des calculatrices programmables et alphanumériques n'est pas autorisé. Mise en garde Toute démonstration illisible ou incompréhensible sera considérée comme fausse. Les parties 1 et Il sont indégendantes Tournez la page S.V.P. PARTIE I Synthèses en série aromatique Données ° Masses molaires atomiques en g.mol'l : H : 1 C : 12 N : 14 O : 16 ° Données spectroscopiques de RMN Déplacements chimiques (en ppm) de quelques protons caractéristiques (le proton ou groupe de protons concerné est en gras) (CH3)4Si R--CH3 0,8 à 1,5 ch=cmv 5,2 à 5,7 R--CsC--H 2,5 à 3,1 ROH 10à55 R--C(=O) --CH3 2,0 à 2,6 R--NH--C(=O) ---R' 5,0 à 8,5 HC(=O) --NR2 7,8 à 8,2 Ar--CH3 2,0 à 2,5 Ar--H A - La Chimie à miniéchelle La chimie à miniéchelle (ou "minichimie") utilise très peu de réactifs, ce qui présente des gains évidents en coût et en temps. Par contre, un soin méticuleux est indispensable lors des manipulations. Dans cette partie, nous allons étudier quelques réactions ainsi réalisées. Le réactif initial est la 4--méthy1aniline A ou para-toluidine. On réalise deux synthèses successives. ' 1 -- Première synthèse : obtention du composé C à partir de la para-toluidine Le protocole opératoire de la première étape est le suivant : - Obtention du composé B brut Dans un miniballon, dissoudre 107 mg de A dans 0,2 mL d'acide sulfurique concentré. Agiter jusqu'à complète dissolution du solide, puis refroidir dans la glace. Verser ensuite, goutte à goutte et avec précaution, 0,4 mL d'une solution obtenue en mélangeant 0,3 mL d'acide nitrique concentré et 0,1 mL d'acide sulfurique concentré. Maintenir la température en dessous de 5 °C. Une fois l'addition terminée, laisser reposer 15 minutes à température ambiante. Verser le mélange réactionnel dans 5 mL d'une solution d'hydroxyde de sodium à 40 %, refroidie dans de la glace. Agiter brièvement, filtrer sur entonnoir à verre fritté. Laver le solide avec 10 mL d'eau froide puis le laisser sécher. Le résidu solide ainsi obtenu fond à 75 °C. - Purification de B Placer le solide dans un tube à essais et ajouter 2 mL d'éthanol à 95 %. Porter le mélange à ébullition pour dissoudre le solide. Si tout le solide n'est pas dissous, ajouter progressivement de l'éthanol tout en maintenant l'ébullition, et ce, jusqu'à dissolution complète du solide (le volume total d'éthanol ne doit pas dépasser 3 mL). Goutte à goutte, ajouter de l'eau dans la solution bouillante d'éthanol jusqu'à ce que la solution devienne légèrement trouble. Laisser refroidir à température ambiante, puis dans un bain de glace. Filtrer les cristaux jaunes à l'aide d'un entonnoir à verre fritté. Laisser sécher à l'air. Peser. On obtient 102 mg d'un produit B fondant à 79 °C. 1.1 - Quel est le rôle de l'acide Sulfurique concentré '? 1.2 - Pourquoi maintient--on la température en dessous de 5 °C lors de l'addition du mélange sulfonitrique ? 1.3 - Quel est le rôle de la solution d'hydroxyde de sodium '? 1.4 - Proposer un mécanisme de formation de B en précisant quel est l'électrophile utilisé dans cette réaction et son mode d'obtention. 1.5 - Justifier succinctement la régiosélectivité de la réaction. 1.6 -- Calculer le rendement de la synthèse. 1.7 - En quelques lignes, indiquer comment est mesurée une température de fusion. 1.8 -- Quel est le nom de l'opération effectuée lors de la purification de B ? Expliquer le rôle de l'eau et le trouble observé lors de son addition à chaud. - Obtention du composé C à partir du composé B Dissoudre 100 mg de B dans 0,5 mL d'acide éthanoïque pur, puis ajouter 0,2 mL d'anhydride éthanoïque. Porter à ébullition durant 15 min. Verser le mélange réactionnel dans 5 mL d'eau glacée. Le solide obtenu est filtré puis purifié. On isole ainsi le solide C. Son spectre RMN du proton réalisé dans un mélange de chloroforme et de DMSO deutériés présente les signaux suivants : 8 = 2,2 ppm, singulet, intégration 3 H, 6 = 2,5 ppm, singulet, intégration 3 H, 8 = 7,3 ppm, doublet, intégration 1 H, 6 = 7,5 ppm, doublet, intégration 1 H, 6 = 8,0 ppm, singulet, intégration 1 H, 8 = 8,14 ppm, large singulet, intégration 1 H. 1.9 - Ecrire la formule semi-développée de C. 1.10 - Attribuer, dans la mesure du possible, les signaux de RMN aux différents groupes de protons de C. Expliquer pourquoi on observe un singulet large à 8,14 ppm. 1.11 - Donner le mécanisme de formation de C. 1.12 - Pourquoi utilise-t--on l'anhydride éthanoïque de préférence à l'acide éthanoïque ? Quel autre réactif aurait-on pu également utiliser ? Indiquer le mode d'obtention de ce réactif et de l'anhydride éthanoïque à partir de l'acide éthanoïque. Tournez la page S.V.P. 2 - Deuxième synthèse : obtention du composé F à partir de la para-toluidine -- Obtention du composé D à partir du composé A A réagit avec l'anhydride éthanoïque en solution dans de l'acide éthanoïque. On obtient le composé D dont le spectre RMN du proton réalisé dans du chloroforme deutérié présente les signaux suivants : 6 = 2,12 ppm, singulet, intégration 3 H, 8 = 2,30 ppm, singulet, intégration 3 H, 8 = 7,15 ppm, doublet, intégration 2 H, 6 = 7,35 ppm, doublet, intégration 2 H, 6 = 8,14 ppm, large singulet, intégration 1 H. 2.1 - Ecrire la formule semi-développée de D. 2.2 - Attribuer les signaux de RMN aux différents groupes de protons de D. - Obtention du composé E à partir du composé D D réagit avec un mélange d'acides sulfurique et nitrique concentrés. On obtient le produit E. 2.3 -- Ecrire la formule semi-développée de E. 2.4 - Justifier soigneusement la régiosélectivité de la réaction de passage de D à E. -- Obtention du composé F E subit une hydrolyse basique pour conduire au produit F. 2.5 - Ecrire la formule semi-développée de F. 2.6 -- Proposer un mécanisme réactionnel pour le passage de E à F. 3 - Conclusion Après avoir comparé B et F, indiquer comment on pourrait distinguer ces deux composés en RMN du proton. B - Synthèse de composés azoïgues Les composés azoïques peuvent selon les cas être utilisés comme indicateurs colorés mais aussi comme colorants. Nous envisagerons la synthèse d'un tel composé à partir du composé B précédent et de phénol. 1 - Préparation du composé M à partir du phénol 1.1 - Le phénol étant un acide faible dans l'eau, l'action d'une base forte, telle que l'hydroxyde de sodium, suffit à former l'ion phénolate. Le phénolate de sodium, quant à lui, réagit aisément avec l'iodométhane pour donner l'éther-oxyde correspondant G. Ecrire l'équation-bilan de la réaction permettant de passer du phénol au phénolate de sodium, puis celle conduisant du phénolate au composé G. 1.2 - L'action du dibrome en présence de FeBr3 sur G donne un mélange de deux isomères, J et K. Ce mélange de J et K est traité avec du magnésium dans l'éther anhydre, puis avec du C02 solide (carboglace). Après hydrolyse, on isole deux composés, L et M, résultant respectivement de J et K. Dans le composé M les deux groupes portés par le cycle aromatique sont en position ortho et, en outre, M a une température d'ébullition inférieure à celle de L, ce qui permet de séparer assez aisément ces deux composés par distillation. 1.2.1 -- Comment expliquer cette différence entre les températures d'ébullition de L et M '? 1.2.2 -- Décrire succinctement les conditions opératoires d'une synthèse magnésienne à partir de J (ou de K). 1.2.3 - Ecrire les formules semi-développées de J, K, L et M. 1.2.4 - Connaissant les potentiels standard des couples 12/ l" et S4OË_/SzO3_ : E°(12/1--) = + 0,54 V et E°(s4oä'/SZOË') = + 0,08 v, on se propose d'effectuer le dosage de l'organomagnésien obtenu à partir de 0,1 mole de J (ou de K). On considère qu'après réaction, on obtient 80 mL d'un mélange réactionnel dont on prélève 0,5 mL que l'on ajoute à 10 mL d'une solution de diiode dans le benzène. Il faut, après réaction, 17,5 mL d'une solution aqueuse de SzÛ3-- à 0,1 mol.L'1 pour décolorer le diiode en excès, au lieu des 25 mL nécessaires si l'on ne met pas 0,5 mL de mélange réactionnel en présence de diiode. 1.2.4.1 - Donner les équations-bilans des réactions ayant lieu au cours du dosage envisagé. Pourquoi peut-on parler de dosage de l'organomagnésien à propos de la manipulation ainsi décrite ? 1242 --Pourquoi n'utilise-t-on pas une solution aqueuse de diiode ? Expliquer succinctement pourquoi I2 est soluble dans le benzène. 124.3 - Pourquoi, enfin, lors du dosage, est-il nécessaire d'opérer lentement tout en agitant vigoureusement '? 2 - Préparation du composé azoïque P 2.1 - Ecrire l'équation--bilan de l'action du nitrite de sodium sur B en présence d'acide chlorhydrique. Donner la formule du composé N obtenu . 2.2 - L'action d'une solution d'hydroxyde de sodium sur M conduit au composé P. N réagit ensuite avec P pour donner le produit R attendu. 2.2.1 - Ecrire la formule semi-développée de P. 2.2.2 - Ecrire l'équation--bilan de la réaction conduisant à R. Donner la formule de ce composé et justifier le résultat final. 23 -- Expliquer pourquoi les composés azoïques peuvent être classés parmi les colorants ou parmi les indicateurs colorés. Tournez la page S.V.P. PARTIE II Le Magnésium et le Zinc : Données 0 Données atomistiques Numéros atomiques : du magnésium, Z = 12 du zinc, Z = 30 Masses molaires atomiques en g.mol"1 : Mg : 24,3 S : 32,1 Cl : 35,5 Zn : 65,4 Rayons atomiques en nm : ng: 0,160 % : 0,138 Paramètres de la maille de magnésium en nm : a= 0,32 c = 0,52 Paramètres de la maille du zinc en nm : a = 0,27 c = 0,49 Règles de Slater pour le calcul des facteurs d'écrans 5j_,i : électron i ns, np nd, nf electron ] ------ _uu-I (*) sauf si l'électron qui fait écran appartient à une CA 5 ou p de même 11, auquel cas 5j_,i = ]. Energie de l'électron ls pour l'atome d'hydrogène, EUR...(H) = - 13,6 eV. ° Données thermodynamiques à 298 K Pour As : Tfu5=_ 1090 K ' Pour H2 : . ° = 130,6 J.K*l.mol"1 Pour H+ (aq) : S° = 0 J .K"'.mol"1 Pour 02(g) : S° = 205 J .K"'.mol"1 Pour SZ'(g) : Af ° = 611 kJ.mol'1 Pour Zn : T... = 692 K A...H°-- _ 7 ,4 kJ. mol"l Teb =1180K AebH°=1153kJmoll Pour Zn(s) : S° = 41,6 J.K"'.mol"1 Pour Zn2+(aq) : AfH°-- -- -- 153,9 kJ.mol"l ° = *-- 112,1 J .K"'.mol--1 Pour Zn2+(g) AfH°-- -- 2783 kJ.mol"1 Pour ZnO : T... = 2248 K Pour ZnO(s) : Af ° = -- 348,3 kJ.mol'l S° = 43,6 J.K"'.mol"1 Pour ZnS blende : . Af ° = -- 206 kJ.mol"1 E°(H30+/ Hz) = 0 V ; E°(02/H20) = + 1,23 V Produit de solubilité de Zn(OH)2 : KS = 1047 Pour l'équilibre : Zn(OH)2(s) + 2 OH" = Zn(OH)Ï , la constante d'équilibre est égale à 10--1'5 Pour l'équilibre : 2 H20 = H3O+ + OH", Ke : 10--14 Constante des gaz parfaits : R = 8,31 J .K"'.mol'1 Constante de Faraday : F = 96500 C.mol"' Constante d'Avogadro : NA = 6,02.1023 mol"1 ° Données à prendre en compte pour les calculs 2,3 RT/F = 0,06 V n=3,14 Jî=1,4 ; J5=1,7 ; ./3/2=1,2. A - Les Eléments , 1 - Leur place dans le tableau périodique 1.1- Ecrire les structures électroniques du magnésium et du zinc dans leur niveau fondamental et rappeler les règles habituellement utilisées pour parvenir à ce résultat. 1.2 - A quelle famille d'éléments de la classification périodique appartiennent le magnésium ' et le zinc '? 1.3 - Envisager et expliquer les différentes possibilités de formation d'ions à partir du magnésium et du zinc. 1.4 - Calculer à partir du modèle de Slater les énergies de 1ère et de 2ème ionisation du magnésium et du zinc. 1.5 - Comparer l'énergie de 1ère ionisation du magnésium à celle de l'élément qui le suit dans la classification périodique. Le résultat est-il en accord avec la théorie de Slater ? 2 - Leur structure cristalline 2.1 - Faire un schéma de chacune des mailles définissant un assemblage compact d'atomes. Indiquer en la justifiant la coordinence dans chacun des cas. 2.2 - Calculer les compacités dans chaque cas. 2.3 - Les éléments magnésium et zinc cristallisent dans une maille hexagonale. Pour chaque élément, les mesures cristallographiques conduisent aux valeurs des paramètres a et c fournies dans les données. S'agit-il de structures ,hexagonales compactes '? Les réponses seront justifiées. Tournez la page S.V.P. B - L'alliage Man2 1.1- Citer les deux types de sites interstitiels existant dans une structure hexagonale compacte. 1.2 - Pour chaque site, calculer le rayon maximal rmax d'un atome susceptible de s'y insérer en fonction du rayon r de l'atome définissant la structure hexagonale compaCte. 1.3 - L'alliage Man2 peut être décrit à partir de l'empilement compact d'atomes de zinc. Pensez-vous que cet alliage soit un alliage d'insertion ou de substitution '? Argumenter votre réponse. C - Le magnésium et le zinc en solution : deux exemples 1 - Le magnésium : complexation des ions Mg2+ L'acide éthylènediaminetétraacétique (EDTA) est un tétraacide H4Y dont les constantes d'acidité sont : ' pKA1(H4Y/H3Y') = 2,0 pKA2(H3Y'/H2YZ") = 2,7 pKA3(H2Y2"/ HY3") = 6,2 pKA4(HY3_/Y4") = 10,3. Le noir Eriochrome T (NET) est un triacide organique de formule H3A. Il est commercialisé sous la forme d'un se] de sodium de formule NaHzA dont les deux acidités sont faibles et caractérisées par les valeurs suivantes : pKA2(H2A" / HA2") = 6,2 et pKA3(HA2" / A3") = 11,6. L'ion H2A" est rose, l'ion HA2" est bleu et l'ion A3" est orangé. L'EDTA donne un complexe incolore avec l'ion Mg2+ , de formule [MgYF", dont la constante globale de formation [3 est donnée par la relation : log B = 8,7. Le NET donne également avec l'ion Mg2+ un complexe rouge, de formule [MgA]", dont la constante globale de formation [3' est donnée par la relation : log B' = 7,1. ' 1.1 - Tracer les diagrammes de prédominance de l'EDTA et du NET en fonction du pH ainsi que les diagrammes de prédominance des complexes et des ions en fonction du ng. On effectue le dosage d'un volume V0 = 20,0 mL d'une solution d'ions Mg2+ tamponnée à pH = 10,3 par une solution d'EDTA de concentration C] = 0,010 mol.L"1 en présence de NET comme indicateur. Le virage de l'indicateur a lieu pour un volume versé Ve(EDTA) = 14,0 mL. 1.2 - Ecrire les équations-bilans de toutes les réactions qui se déroulent en solution et interpréter le virage observé. Pourquoi est-il nécessaire de tamponner le milieu '? 1.3 - Déterminer la concentration initiale de la solution d'ions Mg2+. 1.4 - Etablir les expressions pY = f(x) avec pY = -- log ([Y4"]) et x = V/Ve 1.4.1 --- pour 0< V < Ve, 1.4.2 - pour V > Ve. 1.5 - Donner l'ordre de grandeur de pY lorsque V = Ve. 2 -- Le zinc : étude électrochimique du couple Zn (II)/ Zn 2.1 -- Potentiel standard d'oxydoréduction Dans un solvant donné, le potentiel standard d'un couple rédox est évalué par rapport au potentiel standard de l'électrode normale à hydrogène (pris comme zéro conventionnel), fonctionnant dans ce même solvant. Vérifier que le potentiel standard E°(Zn2+ / Zn) du couple Zn2+ / Zn en solution aqueuse à 25 °C est égal à --- 0,76 V. 2.2 - Diagramme potentiel-pH du zinc en solution aqueuse 2.2.1 - Tracer le diagramme potentiel-pH du zinc en solution aqueuse pour une concentration maximale en espèces dissoutes égale à 10"3 mol.L'1 en précisant les domaines d'existence ou de prédominance de Zn", Zn(OH)2,, Zn(OH)Ï et Zn(s). Echelles : En abscisse : 1 cm par unité de pH ; En ordonnée : 1 cm pour 0,2 V. 2.2.2 - En écrivant les réactions mises en jeu dans chaque cas, expliquer les possibilités d'attaque du zinc par une solution d'acide fort à 1 mol.L"1 puis par une solution de base forte à 1 mol.L"'. 2.2.3 - Sachant que le potentiel standard du couple F e3+ / Fe2+ vaut + 0,77 V et que celui du couple F e3+ / Fe(s) vaut -- 0,037 V, calculer le potentiel standard du couple Fe2+/Fe(s). 2.2.4 - En tenant compte des valeurs calculées aux questions C2] et C.2.2.3 et sachant que le potentiel standard du couple Ni2+ / Ni(s) vaut -- 0,25 V, utilisera--t--on du nickel ou du zinc pour protéger le fer d'une éventuelle corrosion '? Justifier le choix. D - Etude développée du zinc 1 - Etude de quelques composés du zinc 1.1 - Etude du binaire Zn-As Le diagramme de cristallisation du binaire zinc--arsenic, sous une pression de 1 bar, donné à la figure 1 page 10, montre l'existence de deux composés définis de fraction molaire en As : xl : 0,40 et x2 = 0,67. 1.1.1 - Quelle est la formule des composés correspondant aux fractions molaires xl et x2 ? 1.1.2 - Donner la nature des phases et leur contenu dans les domaines numérotés de @ à @ sur la figure. 1.1.3 - En considérant que la pression n'est pas ici un facteur d'équilibre, déterminer la variance aux points notés B, C, E et F. 1.1.4 - On introduit dans une enceinte maintenue à une température constante de 400 °C un liquide dont la fraction molaire en As est égale à 0,85 et la température égale à 1000 °C. Donner l'allure de la courbe d'analyse thermique, en précisant la nature des phases en présence. Tournez la page S.V.P. 10 AT(°C) A @ C 1000" ® B '817 800" F D @ E . E" 600-- @ 413 l 400--'E. 4.10 @ x(As) 0 0,40 0,67 1 ' Zn X1 x2 As Figure 1. Diagramme binaire solide-liquide zinc-arsenic 11 1.2 -- Le sulfure de zinc lus dans sa forme blende 1.2.1 - Faire un schéma de la maille élémentaire de la blende. Déterminer le nombre de motifs par maille. 1.2.2 -- Calculer l'énergie réticulaire Em de la blende, définie comme l'énergie du processus de constitution du cristal à partir de ses ions gazeux infiniment éloignés les uns des autres. 1.2.3 - La masse volumique de la blende est égale à 4080 kg.m"3. Donner la relation permettant le calcul du paramètre a de la maille de ZnS. 1.2.4 - Les rayons ioniques du Zn2+ et du SZ" sont respectivement égaux à 0,074 nm et 0,184 nm ; les rayons covalents du zinc et du soufre sont respectivement égaux à 0,131 nm et 0,104 nm. Sachant que pour la blende le paramètre a est de 0,541 nm, que peut-on conclure pour la liaison Zn--S dans la blende '? 1.3 - L'oxyde de zinc non stoechiométrique 1.3.1 - Les calculs relatifs à l'oxyde de zinc montrent que celui-ci n'est pas rigoureusement stoechiométrique et que sa formule, dans certaines conditions de pression partielle de dioxygène, peut s'écrire ZnO.... En quoi consiste cette non--stoechiométrie de l'oxyde de zinc '? Quels paramètres vont être modifiés par rapport à ceux du cristal parfait ZnO '? 1.3.2 - En considérant que les défauts en oxygène peuvent se traduire par l'équilibre (l) 02" = 1/2 02 + 2e", quelle propriété électrique pourra--t--on attendre pour Zn01_X '? 1.3.3 -- y étant la conductivité du cristal, l'expérience montre que : ln y = A --1/41nP02_. Retrouver cette relation à partir de l'équilibre (1) mis en jeu précédemment. 2 - La métallurgie du zinc Le zinc est préparé par réduction de son oxyde ZnO(s). On se propose d'effectuer l'étude thermodynamique de la réaction en supposant que dans les domaines de température où il ne se produit pas de changement de phase, les enthalpies de formation AfH° sont indépendantes de la température. ' 2.1 - Etude de l'oxydation du zinc ' Considérons la réaction : (2) 2Zn+02=2Zn0 2.1.1 - Pour des températures variant de 500 K à 2000 K, établir les expressions de la variation d'enthalpie libre standard de la réaction (2) notée ArGË en fonction de T. Préciser, pour chaque formule établie, le domaine de température dans lequel elle s'applique. Tournez la page S.V.P. 12 2.1.2 - Représenter sur un graphique les variations de ArG(2) en fonction de la température Echelles : En abscisse : 10 cm pour 1000 K ; En ordonnée : 5 cm pour 100 U . 2.2 - Etude de l'oxydation du carbone L'oxydation du carbone donne lieu aux équilibres (3) et (4) ci--après pour lesquels les variations d'enthalpies libres standard, ArGÊ et ArGÊ, sont indiquées : (3) c + o2 = co2 AIG? = - 393300 - 3T J.mol" (4) 2 c + o2 = 2 co A.Gâ = -- 220900 - 179 T J.mol". 2.2.1 -- En déduire l'expression de ArGË , variation de l'enthalpie libre standard de la réaction (5), qui intervient également au cours de l'oxydation du carbone : (5) 2 oo + 02 = 2 (302 M}? 2.2.2 - Représenter sur le graphique précédent les variations des enthalpies libres standard pour les réactions (3), (4) et (5) (mêmes échelles en abscisse et en ordonnée que précédemment). 2.2.3 -- Préciser sur le graphique les domaines de prédominance du carbone, du monoxyde de carbone et enfin du dioxyde de carbone, en présence de dioxygène. 2.3 - Réduction de ZnO 2.3.1 - Combien de points d'intersection existe--t-il entre les courbes relatives à ArGÊ et ArG's) et celle relative à A:GÊ ? Déterminer à partir du diagramme la température correspondant à ce(s) point(s) de rencontre. 2.3.2 - Expliquer comment, par simple lecture du graphique, il est possible de déterminer les domaines de température dans lesquels l'oxyde de zinc est réductible : 2.3.2.1 - par le carbone, 2.3.2.2 -- par le monoxyde de carbone. 2.3.3 -- Proposer une méthode pour la préparation industrielle du zinc à partir de son oxyde. Fin de l'énoncé