CCINP Chimie 1 PC 2014
| Thème de l'épreuve | Quelques utilisations du plomb. Trois synthèses du jasmonate de méthyle. |
| Principaux outils utilisés | chimie organique, courbes intensité-potentiel, cristallographie, diagrammes E-pH, mélanges binaires, oxydoréduction, solutions aqueuses, thermochimie |
| Mots clefs | galène, alliages plomb-etain, accumulateur, batterie, jasmonate de méthyle, Diels-Alder, spectroscopie, Wittig, addition de Michael, plomb |
Corrigé
:👈 gratuite pour tous les corrigés si tu crées un compte
👈 l'accès aux indications de tous les corrigés ne coûte que 1 € ⬅ clique ici
👈 gratuite pour tous les corrigés si tu crées un compte
- - - - - - - - - - - - - - - - - - - - - - - -
👈 gratuite pour ce corrigé si tu crées un compte
- - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - -
Énoncé complet
(télécharger le PDF)










Rapport du jury
(télécharger le PDF)






Énoncé obtenu par reconnaissance optique des caractères
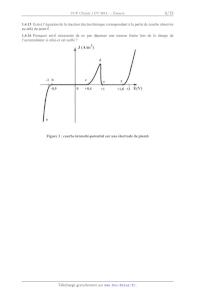
SESSION 2014 PCCH107 .:==_ CONCOURS COMMUNS -=- POLYTECHNIQUES EPREUVE SPECIFIQUE - FILIERE PC CHIMIE 1 Durée : 4 heures N.B. : Le candidat attachera la plus grande importance à la clarté, & la précision et à la concision de la rédaction. Si un candidat est amené à repérer ce qui peut lui sembler être une erreur d 'e'nonce', il le signalera sur sa copie et devra poursuivre sa composition en expliquant les raisons des initiatives qu 'il a été amené à prendre. Les calculatrices sont interdites Toute réponse devra être clairement justifiée. Le sujet est composé de deux parties indépendantes : - la première étudie quelques propriétés physico-chimiques du plomb et de ses dérivés ; - la deuxième aborde trois synthèses du jasm0nate de méthyle. Dans chaque partie, de nombreuses questions sont indépendantes. Toutes les données utiles au problème sont regroupées en fin de sujet. 1/12 Partie 1 : quelques utilisations du plomb Le plomb, relativement abondant dans la croûte terrestre, est l'un des métaux les plus anciennement connus et travaillés. Grâce à sa facilité d'extraction et à sa grande malléahilité, il a été fréquemment utilisé. On en a trouvé dans des pigments recouvrant des tombes ou des dépouilles préhistoriques. Sa toxicité était connue des médecins et mineurs de l'Antiquité. Les Romains qui l'utilisaient sous forme d'acétate de plomb pour conserver et sucrer leur vin, s'étaient rendu compte que les gros buveurs souffraient d'intoxication. De nombreux cas d'intoxication (saturnisme) ont été à l'origine d'une réglementation progressivement mise en place dans la plupart des pays industriels. Le plomb a ainsi été interdit en France pour la confection des tuyaux de distribution d'eau potable en 1995. 1.1 Atomistique 1.1.1 Ecrire la configuration électronique du plomb Pb (Z = 82) dans son état fondamental. En déduire son nombre d'électrons de valence. 1.1.2 Quelle est la position (période et colonne) du plomb dans la classification périodique '? Quel élément, du carbone, de l'azote ou de l'oxygène, appartient à la colonne du plomb '? 1.2 La galène, minerai principal <> Etude cristallographique de la galène Le principal minerai de plomb est le sulfure de plomb PbS, ou galène, qui possède une structure de type chlorure de sodium NaCl. 1.2.1 Indiquer sur trois schémas, en distinguant clairement les cations des anions pour la maille conventionnelle du réseau cristallin de PbS, les positions des centres des ions situés dans : - un plan correspondant à une face du cube ; - un plan parallèle à une face et passant par le centre du cube ; - un plan contenant deux arêtes parallèles n'appartenant pas à la même face. 1.2.2 Préciser le nombre d'entités PbS présentes dans la maille conventionnelle. Quelle est la coordinence cation-anion pour cette structure cristalline de type NaCl '? 1.2.3 En admettant une tangence cation-anion, établir l'expression du paramètre de maille a en fonction des rayons des ions. Calculer une valeur numérique de a. RNa 1.2.4 Calculer la valeur minimale du rapport des rayons ioniques pour une structure de Cl type NaCl. Cette condition est-elle vérifiée pour la galène '? <> Grillage de la galène La première étape de la métallurgie du minerai de plomb consiste en un grillage de la galène PbS, menée à une température inférieure à celle de sa fusion, selon la réaction notée (l) : 2 PbS(s) + 3 02(g) _ 2 PbO(s) + 2 so2(g) (1) 1.2.5 Représenter une structure de Lewis du dioxyde de soufre 802. En déduire, d'après la théorie VSEPR, la géométrie autour de l'atome central. 2/12 1.2.6 Justifier que le dioxyde de soufre est polaire. Représenter son moment dipolaire. 1.2.7 Calculer la variance d'un système où la transformation modélisée par la réaction (1) conduirait à un état d'équilibre. Conclure. 1.2.8 Calculer l'enthalpie standard A,H° ainsi que l'entropie standard . rS de la réaction (1) a 300 K. Commenter le signe de ces valeurs. 1.2.9 Quelle est l'influence d'une augmentation de la température sur l'équilibre (l) à pression et composition constantes '? Justifier votre réponse. Quelle est l'influence d'une augmentation de la pression sur l'équilibre (l) à température et composition constantes '? Justifier votre réponse. 1.3 Alliages plomb-étain Le diagramme de phase isobare (P° = 1 bar) solide--liquide du plomb et de l'étain, représenté ci- après (figure 1), fait apparaitre deux zones de miscibilité partielle à l'état solide du plomb dans l'étain, notée ... et de l'étain dans le plomb, notée ... . La composition du mélange est donnée en pourcentage massique en plomb noté pr. 1.3.1 Indiquer la nature des différentes phases des domaines I à IV. 1.3.2 Quel est le nom du mélange présentant un pourcentage massique de 38,1 % en plomb '? 1.3.3 Représenter l'allure des courbes d'analyse de température, pour un refroidissement isobare de 3500 C a 50° C, de mélanges de pourcentage massique respectivement 20 % et 38,1 % en plomb. Préciser, dans chaque cas, les phénomènes mis en jeu aux points particuliers de ces courbes. Justifier l'allure relative des portions de courbe par des calculs de variance. Pour réaliser des soudures, on utilise couramment un alliage plomb-étain. 1.3.4 Quel pourcentage massique en plomb convient-il d'utiliser pour réaliser aisément ce type de soudure '? T(0 C) 400 350 300 °° 250 231 °C \ "___. ,,Ïf er 18.3.°Cï 3"8ël. % IV 0 10 20 30 40 50 60 70 80 90 100 Sn pr (%) Pb Figure 1 : diagramme de phase isobare solide-liquide du plomb-étain (P° = 1 bar) 3/ 12 1.4 Le plomb en solution aqueuse .<> Diagramme E-pH du plomb à 300 K Les espèces prises en compte pour la construction du diagramme E-pH du plomb représenté ci-après (figure 2) sont les suivantes : Pb(s), PbO(s), PbO2(S), Pb3O4(s), Pb2+(aq), HPbO2 (aq), PbOâ (aq). Conventions de tracé du diagramme E-pH : La concentration de chaque espèce dissoute est égale à : C = 1,0 >< 10'4 mol.L". On suppose qu'à la frontière entre deux espèces dissoutes, il y a égalité des concentrations molaires entre ces deux espèces. En pointillés, sont représentées les droites frontières relatives aux couples redox de l'eau. (G) (A) Figure 2 : diagramme E-pH du plomb 1.4.1 Attribuer chacun des domaines du diagramme E-pH à l'une des espèces chimiques prises en compte pour la construction de ce diagramme. Justifier votre réponse. 1.4.2 Quels sont les domaines de corrosion, d'immunité et de passivation du plomb '? 1.4.3 Déterminer la valeur de la pente de la droite frontière entre les domaines de PbO2(S) et Pb2+(aq). 1.4.4 Calculer les valeurs de pH limites du domaine d'existence de PbO(s). 1.4.5 Ecrire, à l'aide du diagramme, l'équation de transformation du plomb au contact d'une eau aérée et de pH voisin de 7, contenue dans une canalisation au plomb. 4/12 <> Etude du fonctionnement en décharge de l'accumulateur au plomb On étudie à 300 K le fonctionnement de l'accumulateur au plomb alimentant les composants électriques des véhicules automobiles et dont la chaîne électrochimique est symbolisée ci-après : Pb(s) PbSO4(s) solution aqueuse d'acide sulfurique PbSO4(s) PbO2(S) Pb(s). On suppose que l'acide sulfurique H2SO4 est un diacide dont les deux acidités sont, en première approximation, fortes dans l'eau. Le pH de la solution aqueuse d'acide sulfurique de l'accumulateur au plomb est proche de 0. On assimile néanmoins, pour les solutés de cette solution, l'activité du soluté notée a au rapport c/c°, (: concentration molaire en soluté et (3° concentration molaire standard. Le plomb Pb(s) sert de conducteur métallique à l'électrode de droite. 1.4.6 Quel est le rôle de la solution aqueuse d'acide sulfurique dans l'accumulateur au plomb '? 1.4.7 Comparer, de façon qualitative, les solubilités du sulfate de plomb dans l'eau et dans une solution aqueuse d'acide sulfurique. 1.4.8 Identifier la cathode et l'anode. Ecrire l'équation de la réaction de fonctionnement en décharge de l'accumulateur au plomb en tenant compte des espèces prépondérantes. 1.4.9 Schématiser la circulation de tous les porteurs de charge lors du fonctionnement en décharge de l'accumulateur au plomb. 1.4.10 Calculer la valeur de la force électromotrice standard à intensité nulle de l'accumulateur au plomb. Commenter cette valeur sachant qu'une batterie de voiture délivre en général 12 V. Lorsque l'accumulateur au plomb est au repos et à l'air libre, on constate qu'il s'auto-décharge. 1.4.1] Ecrire les équations des réactions responsables de l'auto-décharge de l'accumulateur à l'anode en tenant compte des espèces prépondérantes. L'une de ces réactions présente-t-elle un danger '? Si oui, justifier. .<> Etude d'une électrode au plomb et de la tension limite de charge de l'accumulateur La courbe intensité-potentiel (figure 3, page suivante) représente l'intensité surfacique J ou densité de courant, mesurée par unité de surface (en A/m2) de l'électrode de plomb, en fonction du potentiel E (en V) imposé à cette même électrode. L'électrode en plomb plonge dans une solution aqueuse désaérée (sans dioxygène dissous) d'acide Par convention, l'intensité surfacique anodique est comptée positivement, l'intensité surfacique cathodique négativement. Les ions sulfate SOË ne sont pas électro-actifs. 1.4.12 Ecrire les équations des réactions électrochimiques correspondant aux parties (ab) et (cd) de la courbe intensité-potentiel. 1.4.13 Expliquer succinctement pourquoi la densité de courant J est quasi-nulle sur les parties de courbe (bc) et (ef). Nommer, pour cette dernière, le phénomène à l'origine d'une intensité quasi- nulle. 1.4.14 Expliquer simplement la décroissance observée pour la partie de courbe (de). Ecrire l'équation de la réaction électrochimique correspondante. 5/12 1.4.15 Ecrire l'équation de la réaction électrochimique correspondant àla partie de courbe observée au-delà du point f. 1.4.16 Pourquoi est-il nécessaire de ne pas dépasser une tension limite lors de la charge de l'accumulateur si celui-ci est scellé '? 1 J(A/m2) d -1 b c ' f -0,9 0 +0,4 +1 +1,8 +2 E(V) Figure 3 : courbe intensité-potentiel sur une électrode de plomb 6/12 Partie 2 : trois synthèses du jasmonate de méthyle Il est recommandé d'utiliser, uniquement pour l'écriture des mécanismes, des représentations simplifiées des molécules ne pouvant faire apparaître que le seul groupe caractéristique concerné par la transformation étudiée. Les jasmonates sont des hormones végétales dont le rôle principal est de réguler la croissance et le développement des plantes. Les jasmonates comprennent l'acide jasmonique et ses esters, tel que le j asmonate de méthyle représenté ci-dessous : j asmonate de méthyle COZCH3 1" 2" L'objectif de cette partie est d'étudier et de comparer trois synthèses du jasmonate de méthyle partant de la cyclopent-2-èn--l-one, composé 2. 2.1 Etude préliminaire .<> Etude stéréochimique du jasmonate de méthyle 2.1.1 Déterminer la configuration des atomes de carbone asymétriques, ainsi que celle de la double liaison C=C du jasmonate de méthyle. Justifier votre réponse. 2.1.2 Combien de stéréoisomères de configuration le j asmonate de méthyle possède-t-il '? <> Préparation de la cyclopent-2-èn-l-one La cyclopent-2-èn-l-one 2 est formée par un chauffage prolongé du composé 1, de formule brute C5H802, dans le méthanol en présence de carbonate de sodium Na2C03. Le spectre infrarouge de 1 présente, entre autres, une bande large centrée vers 2 900 cm'l, une bande vers 2 760 cm"1 et deux bandes voisines à 1 735 et 1 725 cm'1. Aucune bande n'est observée au-delà de 3 200 cm'1. Le spectre RMN 1H de 1 présente les signaux donnés dans le tableau ci- dessous : protons déplacement chimique multiplicité constante de couplage intégration en ppm en Hz Ha 2,1 singulet 3 H Hb 2,7 triplet 7,4 2 H Hc 2,9 à definir 2 H Hd 9,6 triplet 2,5 1 H Tableau 1 2.1.3 Déterminer le nombre d'insaturations du composé 1 et représenter les structures topologiques de 1 et 2. 2.1.4 Attribuer les bandes IR aux liaisons concernées et l'ensemble des signaux observés en RMN aux différents protons notés Ha -- Hd du composé 1. 2.1.5 Quelle est la multiplicité attendue pour le signal à 2,9 ppm '? 7/12 2.1.6 Quel est le rôle du carbonate de sodium Na2C03 pour la transformation 1 - 2 '? Proposer un mécanisme réactionnel pour cette transformation. .<> Réaction de la cyclopent-2-èn-l-one avec un diène La cyclopent-2-èn-l-one 2 est mise en solution dans le xylê:ne (diméthylbenzène) en présence de 2-éthoxybuta-l,3-diène 3. On obtient majoritairement le composé 4. O | ' OCH2CH3 4 Les conditions expérimentales de cette transformation ont été optimisées lors de l'étude d'une réaction modéle entre le prop-2-ènal et le diène 3 dont les orbitales . frontières sont précisées en données. On admet que les réactions entre ces différents réactifs ont lieu sous contrôle orbitalaire. 2.1.7 Nommer la réaction conduisant au composé 4. 2.1.8 Identifier les orbitales frontières mises en jeu dans la réaction entre le prop-2-ènal et le diène 3. 2.1.9 Représenter l'interaction orbitalaire prépondérante entre le prop-2-ènal et le diène 3. En déduire la formule topologique du produit obtenu. 2.1.10 Représenter, en convention de Gram, le ou les stéréoisomère(s) du composé 4 formé(s) par réaction de la cyclopent-2-èn--l-one 2 avec le diène 3. La solution obtenue présente-t-elle une activité optique '? Justifier votre réponse. 2.2 Une synthèse industrielle du jasmonate de méthyle Une synthèse industrielle du jasmonate de méthyle utilise le chloroprène ou 2-chlorobuta-l,3-diène, dont la réaction avec la cyclopent-2-èn--l-one 2 donne la chloroindénone 5. Cette dernière est ensuite transformée en deux étapes, décrites ci-après, en ester méthylique 7 : O O /O .0 Cl COZCH3 chloroindénone 5 7 <> Ouverture du cycle insaturé de la chloroindénone La chloroindénone 5 est traitée à basse température par l'ozone dans l'éthanoate d'éthyle. L'ajout d'un large excès de diméthylsulfure (CH3)2S conduit au composé 6 de formule brute C9H11C103. Ce dernier, mis en solution dans le méthanol en présence de pyridine C5H5N, est transformé en ester méthylique 7. 2.2.1 Représenter la formule topologique plane du composé 6. 2.2.2 Proposer un mécanisme pour la réaction de transformation de 6 en 7. 8/12 <> Obtention du jasmonate de méthyle Le jasmonate de méthyle est préparé à partir de l'ester méthylique 7 selon une réaction réalisée à partir du réactif 8. Ce dernier est formé en deux étapes : - 1re étape : le l-bromopropane soumis à un excès de triphénylphosphine PPh3 conduit à la formation d'un solide ionique 9 ; - 26 étape : le solide ionique 9, mis en solution dans un solvant approprié, est traité par du butyllithium pour obtenir le réactif 8. 2.2.3 Représenter la formule topologique du sel 9. Préciser le mécanisme mis en jeu pour sa formation. 2.2.4 Quel solvant, du méthanol ou du toluène (ou méthylbenzène), utiliser pour former le réactif 8 dans la seconde étape '? 2.2.5 Nommer la réaction permettant de préparer le jasmonate de méthyle à partir de l'ester méthylique 7 et de 8. Représenter la formule topologique du réactif 8. 2.3 Une deuxième synthèse avec cyclisation intermédiaire Une autre voie de synthèse, également développée à partir de la cyclopent-2-èn--l-one 2, consiste à transformer cette dernière en un composé 10 à l'aide d'éthane-l,2-diol en présence d'acide para- toluènesulfonique (ou APTS) représenté ci-après : --.--SO3H APTS 2.3.1 Représenter la formule topologique du composé 10. Nommer la fonction formée. 2.3.2 Quel est l'intérêt d'utiliser l'acide para-toluènesulfonique dans la transformation de 2 en 10 '? Proposer un mécanisme pour la formation de 10. Le composé 10, traité par le 2-méthylbuta-l,3-diène, conduit principalement au composé 11. 2.3.3 En admettant que la réaction de formation du composé Il suit le même type de régiosélectivité que celle observée pour la formation du composé 4, écrire la formule topologique plane de 11. L'action sur 11 de tétraoxyde d'osmium OsO4 conduit au composé 12. Ce dernier est transformé par un réactif adéquat en composé 13 : /_\ o o /O 13 0 2.3.4 Représenter la formule topologique plane du composé 12. Proposer un réactif adéquat pour transformer 12 en 13. 9/12 La suite de la synthèse met en jeu une réaction dite << haloforme >>. Celle-ci consiste à transformer une méthylcétone en acide carboxylique par action du dibrome en milieu basique, suivie d'une acidif1cation. Il se forme au cours de cette transformation une tribromométhylcétone, non isolée, qui se transforme in situ en tribromométhane ou bromoforme et en ion carboxylate : O 0 O A L JL L a R CH R CBr HCBr3 + R 09 3 NaOH 3 , , . , , tribromométhane methylcetone tr1bromomethy1cetone ou br om oform e aci di fi cation O RJJ\OH acide carboxylique 2.3.5 Proposer, par analogie avec l'action d'un nucléophile sur un dérivé d'acide carboxylique, un mécanisme pour la transformation de la tribromométhylcétone en ion carboxylate. 2.3.6 Proposer, en précisant les réactifs utilisés, une suite de réactions pour transformer le composé 13, représenté à la question 2.3.4, en jasmonate de méthyle. 2.4 Une troisième synthèse par addition de Michael Une autre synthèse utilise comme réactif dans la première étape l'acide malonique ou acide propanedioïque. Celui-ci est traité par le méthanol en présence d'acide sulfurique pour obtenir le composé 14. Ce composé 14, mis en solution dans le DMSO ou diméthylsulfoxyde, est traité par du méthanolate de sodium CH3ONa. On ajoute ensuite la cyclopent-2-èn-l-one 2. Il se forme alors un composé ionique 15 non isolé On lui additionne alors le bromoalcyne 16 et on isole le diester 17. Ces deux derniers composés sont représentés ci-après : O Br ; \ à 17 COZCH3 COZCH3 2.4.1 Ecrire la formule topologique du composé 14. Quel est l'intérêt de la transformation de l'acide malonique en 14 ? 2.4.2 Quelle est l'action du méthanolate de sodium sur le composé 14 '? Aurait-on pu utiliser pour cette même réaction l'éthanolate de sodium '? Justifier votre réponse. 2.4.3 Proposer, par analogie avec la réactivité des diorganocuprates de lithium sur des énones, un mécanisme pour la réaction de formation du composé ionique 15. Représenter sa formule topologique plane. Le bromoalcyne 16 est formé selon la séquence réactionnelle suivante : lre étape : le but-l-yne est traité à basse température par le chlorure de méthylmagnésium ; lorsque le dégagement gazeux observé cesse, on ajoute du méthanal. Après hydrolyse acide, on obtient 18. 26 étape : le composé 18 est transformé en 16 par action du tribromure de phosphore PBr3. 10/12 2.4.4 Indiquer la nature du gaz formé lors de la première étape. A quelle famille de réaction appartient la transformation du but-l-yne par le chlorure de méthylmagnésium '? 2.4.5 Représenter la formule topologique du composé 18. Proposer un mécanisme pour sa formation. 2.4.6 Ecrire l'équation de la transformation de 18 en 16. Cette synthèse se termine par une réaction de dihydrogénation de 17 en 19, puis par une décarboxylation du diester 19. 2.4.7 Quel catalyseur utiliser pour hydrogéner 17 en 19 en vue de la synthèse du jasmonate de méthyle '? Représenter la formule topologique de 19. 2.4.8 Proposer une suite de transformations, en précisant les réactifs et les conditions opératoires autres que celles développées par Krapcho et décrites ci-après, permettant de réaliser la décarboxylation d'un ... -diester. La réaction de décarboxylation à chaud du ... -diester 19 a été réalisée selon des conditions opératoires développées par Krapcho: traitement de 19 en solution dans le diméthylsulfoxyde (DMSO) en présence d'un excès de chlorure de lithium LiCl. On obtient dans ces conditions un dégagement gazeux et du chlorométhane et, après hydrolyse, un ester : 0 O O LiCl R! DMSO R' Chauffage puis hydrolyse 2.4.9 Préciser le mécanisme de la réaction de décarboxylation dans les conditions opératoires développées par Krapcho, sachant que la première étape met en jeu l'anion chlorure et conduit à la formation de chlorométhane et d'un intermédiaire anionique. 11/12 Numéro atomique : Rayon ionique en pm : Masse molaire : Nombre d'Avogadro : Constante des gaz parfaits : Donnéesà300K: C:6;N:7;O:8;S:16;Pb:82 R(Pb2+ Na R ... ;R(S2' \ ...23...+ -1 -1 : .mol 1 Enthalpies standard de formation AfH° , entropies molaires standard Sm : Composé AfH° (en kJ.mol'l) sm (en J_K'1_mol'l) SOg(g) - 300 250 PbO(s) - 220 65 PbS(s) - 120 90 02(g) 205 Valeurs numériques : RT Potentiels standard redox en volt : log3 0,5...Æ 1,4;,/% 12,6 1,7 Couple redox PbSO4/Pb Pb2+/Pb H+/H2 02/H20 PbO2/Pb2+ PbO2/Pbso4 E° (Volt) - 0,36 - 0,13 0,00 1,23 1,46 1,69 Produit de solubilité KS : PbO(s) + H20 = Pb2+(aq) + 2 HO'(aq) K, 10 14»5 PbO(s) + 2 H20 = HPbO2 (aq) + H30+(aq) KSZ 10 "" Constante d'équilibre d'autoprotolyse de l'eau : Ke = 10'14 Données spectrales : Données RMN 1H : gamme de déplacements chimiques en ppm : Proton H -CH-C- -CH-C=C- -CH-C=O -CH-OR -CH=C- -CH=O , (ppm) 0,9 - 1,3 1,6 - 2,5 2,0 - 3,0 3,3 - 3,7 4,5 - 6,0 9,5 - 10,0 Données INFRAROUGE : nombres d'onde ... (en cm'l) de vibration de quelques liaisons liaison OH CH CHaldéhyde C=C C=O ... (cm'l) 3300--3 600 2910--2970 2750--2900 1580--1620 1710--1750 Orbitales moléculaires % frontières du 2-éthoxybuta-l,3-diène et du prop-2-ènal : 1 3 2 ' 3 2-éthoxybuta-1,3-diène % Pf0P'2'ena' OW 4 2 4 DE Energie ... + 0,59 ... - ... ... __ ... Energie ... + ... ..._ - ... , . ... C(1) 0,64 0,58 O(1) 0,58 0,43 C(2) 0,37 - 0,37 C(2) 0 - 0,58 C(3) - 0,34 - 0,39 C(3) - 0,58 - 0,23 C(4) - 0,57 0,61 C(4) - 0,58 0,66 Fin de l'énoncé 12/12 IMPRIMERIE NATIONALE -- 141316 -- D'aprèsdocumentsfournis