CCINP Chimie PC 2018
| Thème de l'épreuve | Le monoxyde de carbone. Synthèse de la (+)-lupinine et du (-)-épiquinamide. |
| Principaux outils utilisés | orbitales moléculaires, chimie de coordination, cinétique chimique, thermodynamique, oxydoréduction, chimie organique |
| Mots clefs | monoxyde de carbone, toxicité, phosgène, aldolisation stéréosélective d'Evans, amide de Weinreb |
Corrigé
:👈 gratuite pour tous les corrigés si tu crées un compte
👈 l'accès aux indications de tous les corrigés ne coûte que 1 € ⬅ clique ici
👈 gratuite pour tous les corrigés si tu crées un compte
- - - - - - - - - - - - - -
👈 gratuite pour ce corrigé si tu crées un compte
- - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - -
Énoncé complet
(télécharger le PDF)














Rapport du jury
(télécharger le PDF)






Énoncé obtenu par reconnaissance optique des caractères
SESSION 2018
!
!
!
PCCH007
!
ÉPREUVE SPÉCIFIQUE - FILIÈRE PC!
!!!!!!!!!!!!!!!!!!!!"
CHIMIE
Jeudi 3 mai : 14 h - 18 h!
!!!!!!!!!!!!!!!!!!!!"
N.B. : le candidat attachera la plus grande importance à la clarté, à la
précision et à la concision de la
!"#$%&'()*+,'+-)+%$)#'#$&+./&+$0.)"+1+!.2"!.!+%.+3-'+2.-&+4-'+/.054.!+6&!.+-).+.!!.-!+#7")()%"8+'4+4.+
/'9)$4.!$+/-!+/$+%(2'.+.&+#.:!$+2(-!/-':!.+/$+%(02(/'&'()+.)+.;24'3-$)&+4./+!$'/()/+#./+')'&'$&':./+3-7'4+
a été amené à prendre.!
!
!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!"
!
!
!
!
!
Les calculatrices sont autorisées
!
!
!
!
!
Le sujet est composé de 2 problèmes indépendants.
!
!
!
Problème 1 : pages 2 à 8.
!
Données : page 9.
!
!
Problème 2 : pages 10 à 15.
!
Données : pages 16 et 17.
!
!
Chaque problème est constitué de parties indépendantes.
!
!
!
!
!
!
!
!
!
1/17
!
PROBLÈME 1
Le monoxyde de carbone
Le monoxyde de carbone, de formule brute CO, est à l'état gazeux dans les
conditions normales de
température et de pression. Il sagit dun gaz incolore, inodore et très toxique
pour les mammifères.
Chez l'être humain, il est la cause dintoxications domestiques fréquentes,
parfois mortelles. Son
émanation provient d'une combustion incomplète de composés carbonés, accentuée
par une mauvaise
alimentation en air frais ou une mauvaise évacuation des produits de
combustion. Il apparaît comme un
gaz impliqué de façon majeure dans les effets néfastes de la pollution
atmosphérique. Cependant, à
léchelle industrielle, plusieurs centaines de millions de tonnes de monoxyde de
carbone sont produites
chaque année dans le monde, destinées à être utilisées comme réactif de
synthèses variées telles que
celle du phosgène ou celle daldéhydes par réaction dhydroformylation.
Partie I - Toxicité du monoxyde de carbone
I.1 - Fixation du monoxyde de carbone par lhémoglobine
Q1. Donner la configuration électronique des atomes de carbone et doxygène et y
repérer les électrons
de valence.
Q2. Proposer deux formules mésomères pour le monoxyde de carbone. La longueur
de la liaison CO
dans le monoxyde de carbone vaut 113 pm. Commenter cette valeur.
Q3. On trace le diagramme des orbitales moléculaires (O.M.) du monoxyde de
carbone en combinant
les orbitales atomiques (O.A.) de valence des atomes C et O (document 1).
Reproduire ce
diagramme sur la copie. Relier par des lignes pointillées les O.A. permettant
dobtenir chacune des
O.M. représentées sur le diagramme dénergie par combinaison linéaire et
identifier la symétrie !
ou " de chacune de ces O.M. Préciser le caractère liant, non-liant ou antiliant
de chaque O.M. Placer
les électrons dans ce diagramme.
Document 1 - Diagramme dO.M. de CO
E
E
x
2py
2px
2pz
2pz
2px
2py
z
!"#
y
2s
2s
C
O
Q4. Expliquer si la formule mésomère la plus représentative de CO est en accord
avec les résultats
obtenus dans le cadre de la théorie des O.M.
2/17
Q5. Identifier lorbitale la plus haute occupée (H.O.) et lorbitale la plus
basse vacante (B.V.) de CO et
proposer pour chacune une représentation conventionnelle simplifiée.
Document 2 - Fixation du dioxygène et du monoxyde de carbone par lhémoglobine
Lhémoglobine est formée de quatre sous unités polypeptidiques associées chacune
à un cofacteur lié :
lhème. Lhème est constitué dun atome de fer (II) complexé par une porphyrine.
N
N
Fe II
N
N
HO
OH
O
O
Latome de fer (II) est fixé au centre de la porphyrine grâce à linteraction
avec les atomes dazote.
Cest à cet ion que se fixe le dioxygène lors de loxygénation du sang. Lors des
intoxications au
monoxyde de carbone, ce dernier se fixe à latome de fer (II), empêchant la
fixation du dioxygène. Les
complexes obtenus lors de la fixation du dioxygène et du monoxyde de carbone
sont représentés de
façon simplifiée ci-dessous :
O
O
HO
O
C
N FeII N
N
N
N FeII N
N
N
HO
OH
O
O
complexe hémoglobine-O2
O
O
complexe hémoglobine-CO
OH
Pour simplifier létude, on ne considère que linteraction entre latome de fer
(II) et le monoxyde de
carbone CO.
Q6. Dans chacun des complexes représentés dans le document 2, justifier par la
théorie V.S.E.P.R. les
géométries observées au niveau de latome du ligand (O2 ou CO) qui est
directement lié au fer et
estimer langle valenciel correspondant.
Q7. Laquelle des interactions fer(II)-CO ou fer(II)-O2 est-elle a priori la
plus forte ? Lion cyanure CN!"
se fixe sur lhémoglobine de façon similaire au monoxyde de carbone rendant
ainsi lion CN!
toxique. Justifier.
3/17
Q8. Donner la configuration électronique de lion Fe2+. On approche un ion Fe2+
du ligand CO le long
de laxe (Oz) défini dans le document 1. En détaillant votre raisonnement,
identifier et nommer les
O.A. d de Fe2+ conduisant à un recouvrement non nul avec la H.O. et la B.V. du
monoxyde de
carbone, sachant que ce dernier interagit via son atome de carbone.
Q9. Lallure du diagramme dO.M. simplifié obtenu par interaction des O.A. d de
Fe2+ avec la H.O. et
la B.V. de CO est représentée dans le document 3. Expliquer de façon détaillée
lallure du
diagramme en précisant notamment les différents types de recouvrement mis en
jeu, le caractère
liant, non liant ou antiliant des O.M. obtenues.
Document 3 - Diagramme dO.M. de CO
E
E
O.M. 8
x
O.M. 6 O.M. 7
Fe2+,CO
z
O.M. 4 O.M. 5
y
O.M. 2 O.M. 3
O.M. 1
Fe2+
CO
Q10. En utilisant les notions de donation et de rétro-donation, expliquer quels
transferts délectrons ont
lieu entre le fer et le monoxyde de carbone et qualifier le ligand en termes de
!/" donneur/accepteur.
I.2 - Intoxication au monoxyde de carbone
Document 4 - Effets du monoxyde de carbone sur lorganisme
Les effets du monoxyde de carbone sur lorganisme humain en fonction de sa
concentration en parties
par million (0,0001 %) sont énumérés ci-dessous :
!"#$"%%& : maux de tête et étourdissements dans un délai de six à huit heures ;
!"'(("%%& : légers maux de tête au bout de deux à trois heures ;
!")(("%%& : étourdissements, nausées, convulsions apparaissant dans un délai de
45 minutes ;
!"* 400 ppm : maux de tête et vertiges apparaissant en une à deux minutes. La
mort survient en un peu
moins de 20 minutes ;
!"'+ 800 ppm : perte de connaissance immédiate. La mort survient en un peu
moins de trois minutes.
Source : https://fr.wikipedia.org/wiki/Intoxication_au_monoxyde_de_carbone
4/17
Document 5 - Chauffage dune maison par un poêle à bois ou à charbon
Le poêle est un appareil de chauffage dont les premières utilisations remontent
au milieu du XIXe siècle.
Son principe repose sur la combustion exothermique du carbone solide sous forme
de charbon (à des
températures denviron 300 °C) en dioxyde de carbone et en monoxyde de carbone
gazeux, la chaleur
dégagée se propageant par convection et par rayonnement.
Lentrée dair froid, renouvelé via la grille daération séparant la pièce de
lextérieur, permet
dalimenter la combustion du bois ou du charbon (la pièce considérée étant en
dépression par rapport à
lextérieur). Il convient de bien régler le tirage (ou débit dentrée) de
linstallation : si celui-ci est trop
bas, le charbon ou le bois brûleront mal et pourront former des gaz polluants.
À linverse, sil est trop
fort, trop de combustible sera consommé, entraînant un gaspillage énergétique.
Les gaz issus de la
combustion sont évacués par un conduit menant vers lextérieur. En cas de
mauvais entretien du conduit
dévacuation, celui-ci peut sencrasser par des dépôts de suie (charbon) et
sobstruer, provoquant le
refoulement des gaz à lintérieur de la pièce.
Le schéma de principe est représenté ci-dessous :
Source :
http://www.lenergietoutcompris.fr/travaux-chauffage/poele-a-buches/comment-ca-marche
Q11. Écrire les équations des deux réactions de combustion se déroulant dans le
poêle à charbon et
justifier leur caractère exothermique.
Q12. Quelle est linfluence dun tirage trop faible sur le rapport entre la
quantité des deux gaz formés par
combustion ?
On considère une pièce à une température de 20 °C et une pression P = P°
assimilée à un pavé rectangulaire
(de dimensions L = 5,2 m ; l = 5,0 m ; h = 2,5 m) au milieu de laquelle un
poêle à charbon est installé. On
considère une situation de tirage en dioxygène dans laquelle loxydation en
monoxyde de carbone
consomme 12 % de la quantité initiale de carbone. Dans ces conditions, on
estime que le charbon brûle à
un rythme denviron 80 g par minute et que les gaz sont répartis de façon
homogène dans la pièce.
Q13. À partir du document 4, estimer au bout de combien de temps laccumulation
de gaz dans la pièce
peut provoquer le décès dun être humain en cas dobturation du conduit
dévacuation.
5/17
Partie II - Synthèse du monoxyde de carbone
Document 6 - Synthèse industrielle du monoxyde de carbone
Lune des méthodes industrielles la plus couramment employée pour synthétiser du
monoxyde de
carbone consiste à réaliser une médiamutation du carbone graphite avec le
dioxyde de carbone gazeux
selon léquilibre de Boudouard (processus de gazéification) :
C(s) + CO2(g) = 2 CO(g).
La synthèse consiste à injecter du dioxyde de carbone gazeux à une pression
denviron 2 bars, à une
température denviron 1 200 °C dans un réacteur préalablement vidé dair dans
lequel a été dispersé du
coke (carbone solide). En sortie du réacteur, la composition du gaz produit est
vérifiée grâce à une
analyse par spectroscopie de Résonance Magnétique Nucléaire du carbone 13 (RMN
13C) comme
présenté sur le spectre A.
Le gaz est ensuite injecté dans un circuit de purification, à une température
de 25 °C et une pression de
0,5 bar. Il est mis en contact avec une solution du complexe CuAlCl4toluéne2
dont la concentration en
chlorure daluminium cuivreux est de 2 mol.L!" (CoSorb process®). Ce complexe
fixe sélectivement
le monoxyde de carbone de façon réversible selon léquilibre :
CuAlCl4tol2(tol) + CO(g) = CuAlCl4COtol(tol) + tol(l)
où tol désigne le toluène (document 9).
!complexH° = ! 23,5 kJ.mol!1
La solution obtenue est ensuite chauffée à 100 °C à pression atmosphérique et
le gaz obtenu, séparé de
la phase liquide, est analysé par spectroscopie de RMN 13C (spectre B).
Spectre A
Spectre B
Principe de la spectroscopie RMN du 13C : les atomes 13C, 19F, 31P présentent
des spins ½ comme le
proton 1H et peuvent être détectés par RMN. Le 13C est intéressant pour létude
des molécules
organiques mais son abondance isotopique est de 1,11 %, ce qui nécessite un
appareillage très sensible
et plusieurs enregistrements successifs pour amplifier le signal. Avec les
appareils actuels, un spectre
de RMN 13C exploitable peut être obtenu avec quelques milligrammes de produit
en 30 min environ.
Document 7 - Purification du monoxyde de carbone par Pressure Swing Adsorption
(PSA)
Il existe un autre procédé de purification du monoxyde de carbone que le CoSorb
process® décrit au
document 6 : il sagit du Pressure Swing Adsorption (PSA) qui consiste à envoyer
le gaz en sortie de
réacteur à une pression denviron 10 bars et une température denviron 50 °C sur
une phase solide
contenant du cuivre et de laluminium oxydés, adsorbant sélectivement le
monoxyde de carbone. Une
réduction ultérieure de la pression permet alors de désorber le monoxyde de
carbone et de le récupérer
sous forme de gaz. Cette méthode donne une pureté légèrement inférieure à celle
du CoSorb process®.
6/17
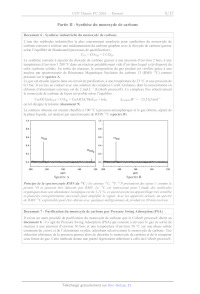
Document 8 - Équilibre de Boudouard - Évolution des fractions molaires de CO et
CO2 en
fonction de la température pour différentes pressions totales
Document 9 - Propriétés du toluène
Masse molaire : M = 92,14 g.mol!"
! Densité : d = 0,867
! Tfus #$! 95,0 °C
! Téb = 110,6 °C
! H225 - Liquide et vapeurs très inflammables
! H361d - Susceptible de nuire au ftus
! H304 - Peut être mortel en cas d'ingestion
et de pénétration dans les voies
respiratoires
!
H373 - Risque présumé d'effets graves
pour les organes à la suite d'expositions
répétées ou d'une exposition prolongée
! H315 - Provoque une irritation
cutanée
! H336 - Peut provoquer somnolence ou
vertiges
!
Source :
http://www.inrs.fr/publications/bdd/fichetox/fiche.html?refINRS=FICHETOX_74
Q14. Justifier le fait que léquilibre de Boudouard peut être considéré comme
une médiamutation.
Dans le poêle à charbon présenté dans le document 5 pour lequel la température
avoisine 300 °C,
expliquer à laide des documents si le contact entre le charbon et le dioxyde de
carbone formé peut
être considéré comme un danger.
Q15. Pourquoi est-il possible de fixer à la fois la pression et la température
dans le réacteur ? Justifier de
façon détaillée. En utilisant les divers documents, expliquer les choix de
conditions de température
et de pression dans le réacteur pour la synthèse du monoxyde de carbone.
Expliquer qualitativement
comment ces résultats auraient pu être prévisibles.
Q16. Retrouver la valeur de la fraction molaire en CO du document 8 pour P = P°
et T = 1 000 K.
Q17. En raisonnant avec la notion daffinité chimique, expliquer quelle serait
la conséquence dun ajout
de gaz inerte, tel que le diazote, dans le réacteur sur le rendement, à
pression P et température T
constantes. Commenter le choix de vider le réacteur dair.
Q18. À la fin de létape de purification (CoSorb process®), justifier lutilité
de porter la solution à 100 °C
à pression atmosphérique. Cette étape de purification est-elle efficace dans le
cas présenté ? Justifier.
7/17
Q19. Dans le complexe CuAlCl4tol2 utilisé lors du CoSorb process®, donner les
nombres doxydation du
cuivre, de laluminium et du chlore, en justifiant. À laide des données,
expliquer lintérêt dutiliser
CuAlCl4tol2, contrairement par exemple à CuCl. On pourra pour cela considérer
le complexe
CuAlCl4tol2 comme lassociation dun ion aluminium, dun complexe
tétrachlorocuivre et de deux
molécules de toluène. On mènera lintégralité du raisonnement en solution
aqueuse à pH nul, la
conclusion pouvant être extrapolée dans le solvant toluène.
Q20. Comparer les deux procédés de purification du monoxyde de carbone CoSorb
process® et PSA
présentés dans les documents 6 et 7 en termes davantage(s) et dinconvénient(s).
Partie III - Synthèse du phosgène à partir du monoxyde de carbone
Document 10 - Synthèse du phosgène
Le phosgène est un composé inorganique de formule COCl2. Gazeux à une
température de 20 °C sous
pression atmosphérique, ce composé toxique a été utilisé comme arme chimique.
Le phosgène est
aujourdhui majoritairement employé dans la production de polymères, dont les
polyuréthanes et les
polycarbonates. Il est aussi utilisé pour produire des isocyanates et des
chlorures d'acyle destinés aux
industries pharmaceutiques et à la fabrication des détergents et des pesticides.
Le phosgène est produit industriellement par lintroduction de dichlore et de
monoxyde de carbone
gazeux sous pression atmosphérique dans un réacteur tubulaire à 250 °C ; le
monoxyde de carbone est
introduit en excès afin que le gaz obtenu en sortie de réacteur contienne une
quantité infime de dichlore,
ce dernier interférant avec le phosgène vis-à-vis des applications citées
précédemment. La réaction se
produisant dans le réacteur est la suivante :
CO(g) + Cl2(g) = COCl2(g).
Lexpérience montre que cette réaction admet un ordre non classique et que sa
vitesse a pour expression
v = k[CO]a[Cl2]b. Afin de déterminer les ordres partiels a et b, on réalise
deux séries dexpériences au
cours desquelles on mesure la pression partielle en phosgène au cours du temps
dans une enceinte de
volume V maintenu constant, à température T constante :
Q21. Montrer que, dans les conditions opératoires dans lesquelles les deux
expériences sont réalisées, la
vitesse de la réaction peut se mettre sous la forme v = k[CO]a. On explicitera
notamment
lexpression de la constante k en considérant tous les gaz parfaits.
Q22.
!"#$%&'(%)*+,$#"'%-.*/&+$#"'%0%1%2%-.")-)(%3%4+)%)+44")$%5%0%-"'$%6+%,"'7$+'$(%-(%8#$(77(%(7$%'"$*(%k.
Déterminer, en justifiant, les expressions des temps de demi-réaction t1/2 et
de trois-quarts réaction t3/4
en fonction de k, puis donner la relation existant entre t1/2 et t3/4.
Q23. Déterminer lordre partiel a en exploitant les données expérimentales sans
calcul.
Q24. Déterminer lordre partiel b à partir des valeurs expérimentales.
Q25. Commenter le choix dintroduire un excès de monoxyde de carbone dun point
de vue cinétique.
8/17
Données du problème 1
Numéros atomiques
Élément
Z
C
6
N
7
O
8
Al
13
Cl
17
Fe
26
Cu
29
Longueurs de liaison covalente
Liaison
Longueur d (pm)
C=O
122
!"#
143
!$#
112
Masses molaires
Élément
M (g.mol"1)
C
12,0
O
16,0
Enthalpies molaires standard de formation (supposées indépendantes de la
température)
Espèce
!fH° (kJ.mol"1)
CO(g)
" 110,5
CO2(g)
" 393,5
Entropies molaires standard (supposées indépendantes de la température)
Espèce
S° (J.K"1.mol"1)
C(s)
5,7
CO(g)
197,6
CO2(g)
213,8
Potentiels standard à pH = 0 (supposés indépendants de la température)
Couple
E° (V)
Al3+(aq)/Al(s)
" 1,66
CuCl43"(aq)/Cu(s)
" 0,82
CO2(g)/CO(g)
" 0,12
CuCl(aq)/Cu(s)
0,12
Volume molaire des gaz parfaits à 293 K et P° = 1 bar : Vm = 24,0.10-3 m3.mol"1
Constante détat des gaz parfaits : R = 8,31 J.K"1.mol"1
Conversion dunités de température : T ="# + 273 avec T en K et # en °C
Conversion dunités de pression : 1 Pa = 7,5.10%3 mmHg
Composition de lair : 78 % de diazote N2, 21 % de dioxygène O2, 1 % de divers
gaz (dioxyde de carbone
CO2, gaz nobles )
9/17
PROBLÈME 2
Synthèse de la (+)-lupinine et du ()-épiquinamide
Pour lécriture des mécanismes, chaque fois quil le juge nécessaire, le candidat
pourra utiliser des
notations simplifiées des molécules lui permettant de se concentrer uniquement
sur les groupes
caractéristiques concernés.
Présentation générale
La (+)-lupinine et le ()-épiquinamide sont deux alcaloïdes quinolizidiniques
(figure 1). La (+)-lupinine
est présente dans les plantes de la famille des Fabacées comme le lupin. Le
()-épiquinamide quant à lui
est extrait de la peau de Epipedobates tricolor, petite grenouille de la forêt
amazonienne. Cest un
antagoniste des récepteurs nicotiniques.
Figure 1
Une synthèse asymétrique de ces deux alcaloïdes impliquant des réactions
dhydroformylation a
récemment été décrite conjointement par les groupes de Bernhard Breit et André
Mann (Organic Letters
2010, 12 (3), 528531).
Partie I - Synthèse de la (+)-lupinine
La synthèse de la (+)-lupinine débute par la préparation dune oxazolidinone 6
obtenue à partir du
(+)-phénylalaninol selon la séquence réactionnelle suivante (schéma 1) :
Schéma 1
Q26. Donner la configuration absolue du carbone asymétrique du
(+)-phénylalaninol. Justifier la réponse.
10/17
Q27. Le composé 2 est obtenu en faisant réagir le (+)-phénylalaninol avec le
carbonate de diéthyle 1. Au
cours de la réaction, un liquide incolore est distillé à une température de
7879 °C.
Identifier ce liquide et justifier lintérêt de la distillation.
Q28. Proposer un réactif 4 pour transformer lacide crotonique 3 en chlorure
dacide 5.
Justifier lintérêt de cette transformation.
Document 11 - Laldolisation stéréosélective dEvans
Laldolisation stéréosélective dEvans, réaction très utilisée en synthèse
organique, consiste en
laddition dun énolate doxazolidinone chirale de configuration Z sur un aldéhyde
:
Laldolisation dEvans est conduite en présence dun acide de Lewis MXn qui
facilite la formation de
lénolate Z [9] par déprotonation avec une amine tertiaire. Après hydrolyse, le
composé 11 est isolé
avec une excellente stéréosélectivité.
La suite de la synthèse comporte une aldolisation stéréosélective dEvans
(document 11) au cours de
laquelle loxazolidinone 6 est transformée en composé 13 (schéma 2) :
Schéma 2
Q29. Quels sont les atomes dhydrogène les plus acides de loxazolidinone 6 ?
Justifier la réponse en
écrivant les structures appropriées.
Q30. Représenter lénolate [12].
Q31. Représenter le stéréoisomère 13 obtenu majoritairement. Proposer un schéma
mécanistique rendant
compte de sa formation à partir de lénolate [12]. On ne sintéressera pas à la
stéréosélectivité de la
réaction.
Q32. Combien de stéréoisomères minoritaires sont obtenus lors de la formation
du composé 13 ? Justifier
la réponse. Les représenter et nommer leur(s) relation(s).
Q33. Quel stéréoisomère majoritaire serait obtenu selon la même séquence
réactionnelle en partant de
lénantiomère de loxazolidinone 6 ? Justifier la réponse.
11/17
Document 12 - La protection de la fonction alcool
Dans une synthèse, le groupe hydroxyle de la fonction alcool peut être protégé,
par exemple sous forme
déther de benzyle ou déther silylé, via des réactions de type SN2. La fonction
alcool peut facilement
être régénérée par hydrogénolyse (H2 en présence dun catalyseur métallique) de
léther de benzyle, ou
par laction dions fluorure sur léther silylé :
La synthèse se poursuit à partir du composé 13 qui est transformé en
(+)-lupinine selon la séquence
réactionnelle suivante (schéma 3) :
Schéma 3
Q34. Proposer une interprétation à lexcellente sélectivité observée lors de la
monoprotection du diol 14
sous forme déther silylé 15.
Q35. Représenter le composé 16. Quelle est lutilité de sa formation ?
Q36. La réaction du composé 16 avec lazoture de sodium (NaN3) a lieu selon un
mécanisme SN2.
Représenter le produit 17 en justifiant la réponse.
Q37. Lhydroformylation est une voie de synthèse pour produire des aldéhydes
(RCH2CH2CHO) à partir
dalcènes terminaux (RCH=CH2). Elle est conduite sous atmosphère de CO et H2 en
présence de
catalyseurs et de ligands.
Représenter le produit 18 issu de lhydroformylation du composé 17.
12/17
Le composé 18 est analysé par spectroscopie infrarouge (IR) et par
spectroscopie de Résonance
Magnétique Nucléaire du proton (RMN 1H) à 400 MHz dans le chloroforme deutéré
(CDCl3). Les spectres
obtenus présentent, entre autres :
! en IR : une bande dabsorption intense à 1 725 cm1 ;
! en RMN 1H : deux signaux triplets intégrant chacun pour un hydrogène avec une
constante de
couplage 3J = 1,4 Hz aux déplacements chimiques ! = 9,80 et 9,78 ppm (partie
par million).
Q38. Attribuer les deux signaux observés sur le spectre de RMN 1H à un ou des
atomes dhydrogène
caractéristiques du composé 18. Justifier la multiplicité.
Q39. Proposer une attribution à la bande dabsorption observée sur le spectre IR
du composé 18.
Q40. Expliquer pourquoi la protection sous forme déther silylé a été préférée à
la protection sous forme
déther de benzyle dans cette séquence (document 12).
Partie II - Synthèse du ()-épiquinamide
La synthèse stéréosélective du ()-épiquinamide débute par la séquence
réactionnelle ci-dessous
permettant daccéder au composé 21 à partir de la
()-N-benzyloxycarbonylméthionine (schéma 4) :
Schéma 4
Document 13 - Les amides de Weinreb
Les N-méthoxy-N-méthylamides ou amides de Weinreb, du nom du chimiste américain
S. M. Weinreb
qui les a introduits dans les années 1980, sont dimportants intermédiaires de
synthèse en chimie
organique*. Obtenus notamment à partir des acides et de leurs dérivés, ils
permettent la préparation de
cétones par réaction avec des organométalliques via la formation dun
intermédiaire tétraédrique dans
lequel un atome métallique est coordiné par le groupement méthoxy :
*Source : http://www.faidherbe.org/site/cours/dupuis/amides.htm
Q41. Représenter lamide de Weinreb 19 obtenu par réaction de la
()-N-benzyloxycarbonylméthionine
avec le chlorhydrate de la N-méthoxy-N-méthylamine (CH3(CH3O)NH2+Cl) en milieu
basique
(document 13).
13/17
Document 14 - Synthèse du composé 21
Préparation de lorganométallique 20
Sous argon, dans un ballon bicol de 500 mL surmonté dune ampoule de coulée
isobare, sont placés
des tournures de magnésium (9,75 g) et du diéthyléther anhydre (120 mL). Le
milieu réactionnel est
refroidi à 0 °C, puis quelques cristaux de diiode sont ajoutés. À 0 °C, une
solution de 1-bromoprop-2-ène
(14,3 mL) dans le diéthyléther anhydre (165 mL) est additionnée goutte-à-goutte
à laide de lampoule
de coulée. La solution grisâtre dorganométallique 20 ainsi préparée est dosée
par le butan-2-ol en
présence dune petite quantité de bisquinoléine. Une concentration égale à 0,48
mol.L1 est obtenue.
Synthèse du composé 21
Sous argon, dans un ballon bicol de 1 L surmonté dune ampoule de coulée
isobare, lamide de Weinreb
19 (21,5 g) est solubilisé dans le tétrahydrofurane anhydre (140 mL). Le
mélange est refroidi à 15 °C
à laide dun mélange de glace et de chlorure de sodium. À 15 °C, la solution
précédente
dorganométallique 20 fraîchement préparée (288 mL) est additionnée
goutte-à-goutte à laide
de lampoule de coulée. À la fin de laddition, lagitation est poursuivie 1 h à
15 °C, puis le
milieu réactionnel est hydrolysé avec une solution aqueuse dacide chlorhydrique
de concentration
1 mol.L1 (160 mL). Le mélange est réchauffé à température ambiante, puis
extrait avec de lacétate
déthyle (3 ! 160 mL). Les phases organiques réunies sont lavées à leau (160 mL)
puis avec une
solution aqueuse saturée de chlorure de sodium (160 mL). Après séchage sur
sulfate de sodium
anhydre, les solvants sont éliminés à lévaporateur rotatif pour donner le
composé 21 sous la forme
dun solide blanc (18,4 g).
Q42. À laide du document 14, donner la représentation de lorganométallique 20
et du composé 21.
Q43. Des conditions opératoires utilisées par les auteurs pour la préparation
de lorganométallique 20
sont encadrées dans le document 14.
Justifier celles-ci, notamment en écrivant les équations des réactions
secondaires correspondantes à
éviter.
Q44. Avec quel rendement est obtenu le composé 21 à partir de lamide de Weinreb
19 ? Justifier la
réponse.
Q45. Dans les mêmes conditions opératoires, la réaction du
()-N-benzyloxycarbonylméthioninate de
méthyle avec lorganométallique 20 conduit à un autre composé 22 (schéma 5).
Identifier ce composé.
Expliquer pourquoi le composé 21 ne peut pas être obtenu par cette réaction.
Schéma 5
14/17
Ensuite, le ()-épiquinamide est obtenu à partir du composé 21 à laide dune
séquence réactionnelle
incluant une réaction dhydroformylation (schéma 6) :
Schéma 6
Q46. Proposer un schéma mécanistique rendant compte de la formation du produit
23. On ne sintéressera
pas à la stéréosélectivité de la réaction.
La réaction du composé 23 avec le periodate de sodium (NaIO4) conduit au
sulfoxyde 24. Traité par le
carbonate de calcium (CaCO3), le sulfoxyde donne lamine allylique 25 avec le
bis(méthylsulfénate) de
calcium ((CH3SO)2Ca) comme sous-produit.
Q47. De combien varie le nombre doxydation de latome de soufre lors de la
formation du sulfoxyde 24 à
partir du composé 23 ? Justifier la réponse.
Q48. Donner le schéma de Lewis du sulfénate de méthyle (CH3SO).
Quelle géométrie peut être déduite de la méthode V.S.E.P.R. autour de latome de
soufre ?
Indiquer la valeur théorique de langle de liaison.
Q49. Proposer un schéma mécanistique rendant compte de la formation de lamine
allylique 25.
Q50. Proposer un schéma mécanistique rendant compte de la formation du produit
27 à partir du
composé 26.
Q51. Quel autre réactif aurait pu être utilisé pour la formation du produit 27 ?
Préciser les conditions opératoires de son utilisation.
15/17
Données du problème 2
Numéros atomiques, masses molaires et électronégativités de Pauling de quelques
éléments :
Élément
H
C
N
O
S
Z
1
6
7
8
16
M (g.mol1)
1
12
14
16
32
#"
2,2
2,6
3,0
3,4
2,6
Températures débullition à pression atmosphérique de quelques solvants* :
Solvant
Ébullition (°C)
Dichlorométhane
39,8
Diéthyléther
34,6
N,N-Diméthylformamide
189,0
Éthanol
78,5
Méthanol
64,6
o-Dichlorobenzène
180,5
Tétrahydrofurane
66,0
*Source : http://murov.info/orgsolvents.htm
IR (gamme de nombres donde)* :
Groupe fonctionnel
!"(cm1)
Intensité
OH alcool
3 200 3 650
Intense et large
C=O ester saturé
1 730 1 750
Intense
C=O ester conjugué
1 715 1 730
Intense
C=O aldéhyde saturé
1 720 1 740
Intense
C=O cétone saturée
1 705 1 725
Intense
C=O aldéhyde conjugué
1 680 1 705
Intense
C=O cétone conjuguée
1 665 1 885
Intense
C=C alcène
1 645 1 675
Moyenne
C=C alcène conjugué
1 635 1 650
Moyenne
*Source : Tables of Spectral Data for Structure Determination of Organic
Compounds 2nd Edition, E. Pretsch,
W. Simon, J. Seibl, T. Clerc ; W. Fresenius, J. F. K Hubert, E. Pungor, G. A.
Rechnitz, W. Simon Eds. ; 1989.
16/17
RMN 1H (gamme de déplacements chimiques)* :
Protons
! (ppm)
1,5 2,4
2,3 2,8
3,5 4,2
3,5 4,2
4,6 7,0
9,1 10,3
*Source : Tables of Spectral Data for Structure Determination of Organic
Compounds 2nd Edition, E. Pretsch,
W. Simon, J. Seibl, T. Clerc; W. Fresenius, J. F. K Hubert, E. Pungor, G. A.
Rechnitz, W. Simon Eds.; 1989.
FIN
17/17