CCINP Chimie PC 2020
| Thème de l'épreuve | Synthèse de la (+)-synargentolide. Le tétrahydruroborate de sodium \NaBH4. |
| Principaux outils utilisés | chimie organique, thermodynamique, cinétique chimique, orbitales moléculaires, oxydoréduction |
| Mots clefs | électrolyse, pile, borohydrure, NaBH4, BH5, dihydrogène, borohydrure de sodium, ribose, synargentolide B, tétrahydruroborate |
Corrigé
:👈 gratuite pour tous les corrigés si tu crées un compte
👈 l'accès aux indications de tous les corrigés ne coûte que 1 € ⬅ clique ici
👈 gratuite pour tous les corrigés si tu crées un compte
- - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - -
👈 gratuite pour ce corrigé si tu crées un compte
- -
Énoncé complet
(télécharger le PDF)














Rapport du jury
(télécharger le PDF)




Énoncé obtenu par reconnaissance optique des caractères
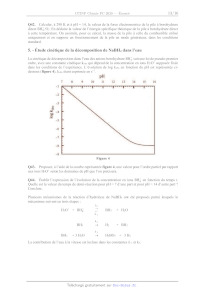
SESSION 2020 PC3C (INP CONCOURS COMMUN INP ÉPREUVE SPÉCIFIQUE - FILIÈRE PC CHIMIE Mardi S mai:8h-12h N.B. : le candidat attachera la plus grande importance à la clarté, à la précision et à la concision de la rédaction. Si un candidat est amené à repérer ce qui peut lui sembler être une erreur d'énoncé, il le signalera sur sa copie et devra poursuivre sa composition en expliquant les raisons des initiatives qu'il a êté amené à prendre. RAPPEL DES CONSIGNES «_ Utiliser uniquement un stylo noir ou bleu foncé non efjaçable pour la rédaction de votre composition ; d'autres couleurs, excepté le vert, peuvent être utilisées, mais exclusivement pour les schémas et la mise en évidence des résultats. ° Ne pas utiliser de correcteur. «_ Écrire le mot FIN à la fin de votre composition. Les calculatrices sont autorisées Le sujet est composé de deux problèmes indépendants. Chaque problème est constitué de parties indépendantes. Des données sont disponibles à la fin de chaque problème. Toute réponse devra être clairement justifiée. 1/16 PROBLÈME 1 Synthèse de la (+)-synargentolide B Pour l'écriture des mécanismes, chaque fois qu'il le juge nécessaire, le candidat pourra utiliser des notations simplifiées des molécules lui permettant de se concentrer uniquement sur les groupes caractéristiques concernés. 1. - Présentation de la (+)-synargentolide B La (+-synargentolide B, figure 1, isolée de plantes d'Afrique du Sud, présente un fragment de type d-lactone &,f-insaturée que l'on retrouve dans de nombreux produits naturels. Elle possède des propriétés pharmacologiques des plus intéressantes (antitumoral, antibactérien, retardateur de croissance...). Afin d'établir sans ambiguïté sa stéréochimie, différents stéréoisomères ont été synthétisés. Leurs propriétés physico-chimiques ont pu être ainsi comparées à celle de l'espèce isolée. Ce problème a pour but d'étudier certaines de ces synthèses. Ac = CH3CO OAc OH (+)-synargentolide B Figure 1 Q1. Quelle propriété physique présente la (+)-synargentolide B ? Pourquoi la (+)-synargentolide B présente-t-elle cette propriété ? Les différentes synthèses, publiées à ce jour et dont s'inspire ce problème, ont été menées à partir d'espèces chimiques telles que l'acide (S)-lactique ou acide (29)-2-hydroxypropanoïque (présent dans le lait, le vin et certains fruits et légumes ainsi que dans les muscles après un effort physique) ou l'acide (2S,3S)-tartrique! (préparé pour la première fois par Louis Pasteur, dans le cadre de son doctorat, à partir du sel double de tartrate isolé des jus de fermentation de raisin) ou encore le D-mannitol® (édulcorant naturel présent dans les algues marines) représentés figure 2 : OH OH OH OH : COOH X OH 77 COOH Loc Oo OH OH OH acide (S)-lactique acide (2S,3S)-tartrique D-mannitol Figure 2 Q2. Expliquer pourquoi les synthèses publiées à ce jour sont menées à partir de ces différentes espèces chimiques. ÎK.R. Prasad* and P. Gutala J. Org. Chem. 2013, 78, 3313-3322 G. Sabitha, K. Shankaraïah and J. S. Yadav Eur. J. Org. Chem. 2013, 4870-4878 U. Ramulu, $S. Rajaram, D. Ramesh, K.S. Babu Tetrahedron Asymmetry 2015, 26, 928-934 2 J. Lui, Y. GaO, L. Wang ans Y. Du Tetrahedron 2017, 73, 6443-6447 2/16 2. - Étude du ribose Document 1 - Les oses Les glycosides constituent une grande famille de molécules du vivant. Ce sont des biopolymères composés d'enchaînements de monosaccharides ou "sucres" liés par une liaison glycosidique. Selon la longueur de la chaîne constituée, on les nomme disaccharide (deux unités), oligosaccharides (quelques unités) ou encore polysaccharides (avec des masses molaires pouvant largement dépasser le million de g:mol"?). Le ribose, représenté schéma 1, est un aldopentose (pentose du type aldose), c'est-à-dire un ose, monomère de glucide, constitué d'une chaîne de 5 atomes de carbone ainsi que d'une fonction aldéhyde. Le ribose joue un rôle important pour les êtres vivants en tant que composant de l'ARN (acide ribonucléique) ou de l'ATP (adénosine triphosphate), du NADH (forme réduite de la nicotinamide adénine dinucléotide), et de diverses autres molécules importantes dans les processus métaboliques. En solution aqueuse légèrement acidifiée, la forme linéaire acyclique est minoritaire (<1 %), l'isomère prédominant étant le B-D-ribopyranose (58,5 %), forme cyclique à 6 atomes représentée ci-après en projection de Haworth. À noter qu'il existe d'autres isomères cycliques tels que les ribofuranoses «& et f : CH,0H CH,0H OH OH O OH OH OH OH RAC a-D-ribofuranose B-D-ribofuranose HO Ë É H 6,5 % 13,5 % OH OH O O OH 1 forme linéaire acyclique OH OH OH Fe OH OH OH OH a-D-ribopyranose B-D-ribopyranose 21,5 98,9 Schéma 1 Q3. Déterminer le descripteur stéréochimique de chacun des centres stéréogènes de la forme linéaire acyclique du ribose 1. Nommer cette forme en nomenclature systématique. Q4. Nommer la réaction qui est à l'origine de la formation en solution aqueuse acidifiée, à partir de la forme linéaire acyclique 1, des formes cycliques de type ribofuranose et ribopyranose. Proposer un mécanisme réactionnel conduisant à la formation de l'une de ces formes cycliques. Q5. Préciser la relation de stéréochimie liant l'a-D-ribopyranose et le B-D-ribopyranose. Représenter en perspective le stéréoisomère de conformation le plus stable du B-D-ribopyranose. Justifier sa stabilité. Q6. Quelle grandeur physique permet de suivre la transformation de l'a-D-ribopyranose en B-D-ribopyranose ? Relier cette grandeur physique à l'avancement chimique volumique de la transformation de l'a-D-ribopyranose en B-D-ribopyranose. 3/16 3. - Synthèse du synthon 7 - Transformation du ribose La synthèse de la (+)-synargentolide B ou de l'un de ses stéréoisomères débute par la préparation du composé 3, à partir d'un mélange d'a-D-ribofuranose et de B-D-ribofuranose, selon la séquence réactionnelle suivante (schéma 2) : O\ ,-OH OH O Ds Ph3P=CH, | ------ ---- HER Li _ _ ln, O\\° HO OH Ô t-BUOH, THF mélange È ' : Ph = CHO PCR 5 r = AZ, RS 2) NaBH4, MeOH Ô EtsN 2) Sol. aq. A Ac 4 d'acide chlorhydrique & 7 THF = l o \ Ac = CH3CO Schéma 3 Q10. Effectuer une représentation spatiale topologique du composé obtenu par action du periodate de sodium NalO4 sur 3. Quel est le rôle du mélange eau-THF ? Le spectre RMN 'H du composé 4 présente, entre autres, les signaux suivants : un signal [ -- 1,43 ppm, (singulet, 6H)] ; un signal [ -- 5,38 ppm, (doublet de doublets de doublets, 1H)]. Q11. Attribuer, en justifiant leur multiplicité, les signaux observés dans le spectre RMN 'H du composé 4. Quelle(s) bande(s) caractéristique(s) peu(ven)t être observée(s) dans le spectre infrarouge du composé 4 ? Lors de la transformation du composé 4 en composé 5, le protocole opératoire suivant est mis en oeuvre : À une solution du composé 4 (0,20 g, 1,3 mmol) dans du dichloromethane CH2Ch (8 mL) anhydre, additionner de la triéthylamine Et3N (0,36 mL, 2,53 mmol). Refroidir cette solution à 0 °C puis additionner, pendant 30 minutes, du chlorure de 4-méthylbenzènesulfonyle (0,30 g, 1,6 mmol). Agiter, pendant 3 heures, tout en laissant revenir à température ambiante. Verser une solution aqueuse d'acide chlorhydrique (1 mol-L'!, 2 mL) et extraire avec du dichlorométhane CH2Clb technique (2x 15 mL). Laver successivement les phases organiques regroupées avec une solution saturée d'hydrogénocarbonate de sodium NaHCO3 (10 mL) et de l'eau (10 mL). Sécher sur sulfate de magnésium anhydre MgSOi et évaporer, sous pression réduite, le solvant. Le composé 5 (0,38 g, 1,2 mmol) isolé sous forme d'huile est ensuite purifié par chromatographie séparative sur colonne de silice S102 (éluant éthanoate d'éthyle / hexane, 1:9). Q12. Effectuer une représentation spatiale topologique du composé 5. Quel est l'intérêt de la transformation du composé 4 en composé 5 ? 5/16 Q13. Proposer un mécanisme réactionnel rendant compte de la formation du composé 5 en précisant le rôle de la triéthylamine Et3N. On suppose que TsCI réagit selon un mécanisme analogue à celui d'un chlorure d'acyle. Q14. Analyser, dans le protocole opératoire décrivant l'obtention du composé 5, les différentes opérations réalisées après les 3 h d'agitation à température ambiante. Q15. Par analogie avec la chromatographie sur couche mince, expliciter le principe de la chromatographie sur colonne de silice. Quelle est la finalité de ce type de chromatographie ? Pourquoi utiliser un mélange éthanoate d'éthyle/hexane et non pas de l'hexane ou de l'éthanoate d'éthyle pur ? Q16. Pourquoi, lors du passage du composé 5 au composé 6, l'action de L1AÏH4 se fait-elle dans le THE ? Pourrait-elle se faire dans le méthanol comme lors de l'utilisation de NaBH4 ? Expliciter l'enchaînement des transformations se produisant lors du passage du composé 5 au composé 6. Q17. Pourrait-on transformer le diol 6 en diester 7 avec de l'acide éthanoïque ? Argumenter votre réponse. Proposer, en cas de réponse négative, des conditions opératoires pour réaliser cette transformation. La formation d'un stéréoisomère du composé 6 a été réalisée à partir du (S)-lactate d'éthyle, préparé à partir de l'acide (S)-lactique. Par chauffage et en présence de traces d'acide, l'acide (S)-lactique forme un lactide, de formule C6Hs30O4. Le spectre infrarouge de ce lactide ne présente pas de bandes au-delà de 3 100 cm !. Son spectre RMN 'H présente deux massifs, un doublet peu déblindé d'intensité relative 3 et un quadruplet plus fortement déblindé d'intensité relative 1. Q18. Proposer une structure plane du lactide en accord avec les données spectrales et en prenant soin de les analyser. Dénombrer les stéréoisomères de configuration possibles du lactide. Q19. Proposer une suite de transformations mettant en jeu, entre autres, une synthèse magnésienne et conduisant à la formation d'un stéréoisomère du composé 6 à partir de l'acide (S)-lactique. Seules la nature et la finalité des transformations sont attendues ainsi que la structure de l'organomagnésien pour la formation duquel les conditions opératoires (choix des réactifs, solvant, précautions expérimentales particulières...) seront détaillées. 4, - Formation d'acide polylactique L'acide (S)-lactique polymérise facilement pour donner l'acide polylactique ou PLA, un matériau biodégradable mais de faible ductilité, ce qui limite ses applications. L'adjonction d'additifs plastifiants limite ses avantages écologiques. Un autre mode de formation du PLA utilise le lactide. On obtient alors un polymère de masse moléculaire plus élevée, dont les propriétés physiques sont les suivantes : -- température de transition vitreuse : 60 °C ; -- température de fusion : 150 °C. Q20. Représenter l'unité de répétition du PLA. Quel est l'avantage de réaliser la formation du PLA à partir du lactide au lieu de l'acide (S)-lactique ? Décrire les différents états physiques du PLA en fonction de la température. 6/16 5.- Synthèse du synthon 9 - Formation d'alcool homoallylique L'autre partie de la synthèse se fait à partir d'un stéréoisomère du composé 4 représenté au schéma 3. Le stéréoisomère, noté 4bis et représenté schéma 4, est traité par un complexe de trioxyde de chrome CrO:3 et de pyridine CsH:5N dans le dichlorométhane pour obtenir le composé 8. Le spectre infrarouge de 8 présente, entre autres, une bande vers 1 720 cm ! et, son spectre RMN 'H, un signal vers 10 ppm, d'intensité relative 1. Le composé 8 est ensuite transformé, à l'aide d'une solution d'allyltributylstannane dans le dichlorométhane et en présence de quantités catalytiques de (R)-Binol et de Ti(0-1-Pr)4, pour former le composé 9. Ce dernier est ensuite transformé en composé 10 : O NS Cor 1) CrO;.pyridine, Chacle NV a O 2) JAN SNBU3 Ti(O-/-Pr)4, CHCI (R)}-Binol 4bis Schéma 4 Q21. Représenter le composé 8 formé à partir du composé 4bis par action du complexe de trioxyde de chrome et de pyridine. Quelle est la nature de cette transformation ? Q22. Quel composé, de réactivité analogue à celle de l'allyltributylstannane H2C-CHCHSnBu:, aurait-1l été possible d'utiliser pour la transformation du composé 8 en composé 9 ? Quel serait le principal inconvénient de son utilisation pour la formation du composé 9 ? Quel est le rôle du (R)-Binol, représenté figure 3 (les traits en gras représentant des liaisons en avant du plan de représentation), dans la formation du composé 9 ? 7/16 6. - Couplage des deux synthons Q23. Nommer la transformation qui permet de former, à partir du composé 10, le cycle de la (+)-synargentolide B. Quel est son élément « moteur » ? Représenter la structure plane du produit présentant également un cycle à 6 atomes pouvant se former lors de cette transformation. Les auteurs ont montré que ce produit secondaire ne se forme pas et que la transformation envisagée pour la formation du cycle de la (+)-synargentolide B pouvait être réalisée à partir du composé 7bis, énantiomère de 7 et du composé 10 représentés schéma 5 : OAc oO < Led + VX RS ue OAc O OAc OH 7bis 10 (+)-synargentolide B Ac = CH:CO Schéma 5 Q24. Proposer une suite de transformations conduisant à la formation de la (+)-synargentolide B à partir des composés 7bis et 10. Commenter. 8/16 Données relatives au problème 1 Données RMN 'H Proton H | -CH-C- | -CH-C=C- | H-C=C- | -CH-C=0O | -CH-OR | -CH=C- | -CH=0O 5(ppm) |09-1,3| 16-2,5 | 1,8---3,1| 2,0-3,0 | 3,3- 3,7 4,5 6,0 |9,5-10,0 Table 1 - Valeurs de déplacements chimiques & du proton en RMN 'H -CH-CH- cis-CH=CH- trans-CH=CH- HC=C-CH- J (HZ) 6 -- 20 O--10 12 -- 18 1 --3 Table 2 - Valeurs de constantes de couplage en RMN 'H H H H R = cis = trans R R R H Données INFRAROUGE liaison OH CH C=C C=0O 6 (cm !) 3 300 -- 3 600 2 910 -- 2 970 1 580 -- 1 620 1710 -- 1 750 Table 3 - Nombres d'onde © de vibration de quelques liaisons 9/16 PROBLÈME 2 Le tétrahydruroborate de sodium NaBH4 1. - Présentation du bore et du NaBH:4 Le bore, élément de la 2° période et de la 13° colonne de la classification périodique, est, sous forme de corps simple, un métalloïde noir, brillant et dur. Il se combine avec de nombreux éléments pour former, par exemple, des borures avec des métaux moins électronégatifs que lui, des borates ou des perborates avec l'oxygène et du borane ou des borohydrures avec l'hydrogène. Le tétrahydruroborate de sodium NaBH4, aussi appelé borohydrure de sodium, est un solide blanc, utilisé notamment dans l'industrie pharmaceutique en tant qu'agent réducteur source d'ions hydrure H° mais également dans les systèmes expérimentaux de pile à combustible comme source de dihydrogène, carburant de moteurs à combustion. Q25. Écrire la configuration électronique du bore dans son état fondamental. Préciser les nombres quantiques des orbitales atomiques de valence du bore. Q26. Représenter un schéma de Lewis de l'anion tétrahydruroborate BH, et préciser la géométrie autour de l'atome central de bore. Justifier sa dénomination d'« hydrure ». 2. - Pouvoir énergétique du dihydrogène Document 2 - Stockage de l'énergie Le dihydrogène est considéré comme le plus prometteur des modes de stockage, sous forme chimique, de l'énergie électrique. Il n'est n1 polluant, n1 toxique. Il peut être formé par électrolyse de l'eau ou selon la réaction de reformage à partir du gaz naturel. Il est utilisé dans les piles à combustible ou comme carburant dans des moteurs thermiques. Sa combustion ne génère que de l'eau. Son énergie massique de combustion dans l'air est supérieure à 100 MJ-kg !. Par comparaison, 1,0 kg de dihydrogène est équivalent à 2,8 kg d'essence. Cependant, le principal verrou technologique au développement du dihydrogène comme source énergétique est son stockage, de manière sûre et sur du long terme, ce gaz étant hautement inflammable. Q27. Rappeler le principe d'une électrolyse. Schématiser le dispositif expérimental légendé d'une cellule d'électrolyse et indiquer le sens de circulation des porteurs de charge lors de son fonctionnement. Q28. Proposer, en argumentant votre réponse, parmi les solutions données c1-après, celle(s) permettant de réaliser l'électrolyse de l'eau sur électrode de platine : - solution aqueuse d'acide sulfurique, H2SO4 diacide dont les deux acidités seront supposées fortes dans l'eau : - eau désionisée ; -__ solution aqueuse d'acide chlorhydrique, HCI acide fort dans l'eau. On suppose que les activités des différentes espèces électrochimiques actives sont égales à 1. Q29. Écrire les équations des réactions électrochimiques ayant lieu aux électrodes, en fonction de(s) la solution(s) retenue(s) et en ne prenant en compte que les espèces majoritaires. Q30. Déterminer, à 298 K, la valeur de l'énergie massique de combustion du dihydrogène dans l'air à partir des données tabulées. Confronter votre résultat aux informations fournies dans le document de présentation du stockage de l'énergie. 10/16 Q31. Vérifier, en développant un raisonnement quantitatif, s'1l y a bien « équivalence entre 1,0 kg de dihydrogène et 2,8 kg d'essence ». A quel volume d'essence cela correspond-il ? L'essence est assimilée à de l'octane liquide CsHig(e. 3. - Formation et structure du NaBH., solide Document 3 - Voies de synthèse du tétrahydruroborate de sodium De nombreuses voies de synthèse du tétrahydruroborate de sodium NaBH4 ont été explorées. C'est actuellement la transformation qui se produit entre le triméthoxyborane B(OCH:)}3 solide et l'hydrure de sodium NaH solide à haute température, qui permet de produire du NaBH4 à l'échelle industrielle. Le méthanolate de sodium CH3ONa solide, également produit lors de cette transformation, peut être recyclé par traitement avec du diborane B2H6 gazeux, selon une transformation exothermique modélisée par la réaction (1) : 2 B2Héç) + 3 CH3ONa6) -- 3 NaBH4x) + B(OCH36) (1) La transformation (1) est une alternative industrielle, intéressante, à la formation du NaBH4. De nouvelles voies de synthèse sont aujourd'hui étudiées. Elles ont pour principal objectif de recycler le métaborate de sodium NaBO, produit d'hydrolyse du NaBH4. Cependant, aucune n'a encore montré une efficacité et une viabilité industrielle suffisante. Q32. Écrire l'équation de la réaction modélisant la transformation chimique du triméthoxyborane B(OCH3)3 solide avec l'hydrure de sodium NaH solide. Commenter pourquoi cette réaction de formation de NaBH4 ne serait pas, au niveau industriel, la plus intéressante. Q33. Déterminer la valeur de la variance d'un système physico-chimique qui, après transformation modélisée par la réaction (1), a atteint un état d'équilibre. Conclure. Q34. Prévoir le signe de l'entropie standard AïS° de la réaction (1). Comment peut-on optimiser cette réaction ? Justifier votre réponse à l'aide de l'affinité chimique. Le tétrahydruroborate de sodium NaBH4 solide cristallise selon une structure de type NaCT, les anions constituant un réseau de type cubique faces centrées et les cations occupant l'ensemble des sites interstitiels octaédriques de ce réseau. Le paramètre de maille a vaut 0,610 nm. Des valeurs de rayons covalents et 1oniques sont fournies dans les données. Q35. Représenter, dans une maille conventionnelle cubique, les positions des centres des anions tétrahydruroborate BH}. Etablir la relation de « non-contact » entre ces amions. Conclure. Q36. Indiquer la position des centres des sites interstitiels octaédriques occupés par les cations sodium Na'. Etablir la relation de «contact» entre les cations sodium Na et les anions tétrahydruroborate BH, . En déduire une valeur du rayon de l'anion tétrahydruroborate BH, . Q37. Comparer cette valeur à celles pouvant être calculées à partir des données fournies. Conclure quant à la nature de la liaison B-H dans l'anion tétrahydruroborate. 11/16 4, - Capacité de stockage et décomposition du NaBH4 Document 4 - Capacité de stockage massique en dihydrogène La capacité de stockage massique en dihydrogène est calculée comme le rapport entre la masse de dihydrogène stockée et la masse de l'ensemble du système de stockage. Elle dépend de la quantité d'eau mise en jeu dans l'ensemble du système de stockage : l'eau servant à dissoudre NaBH4 en ses 1ons et l'eau nécessaire à la réaction d'hydrolyse de BH. L'augmentation de la capacité de stockage en hydrogène est totalement dépendante de la réaction entre l'eau et le tétrahydruroborate de sodium solide. Ainsi, la réaction entre le NaBH4 solide et la quantité d'eau nécessaire entraîne la formation de métaborate de sodium NaBO solide et fait passer la capacité de stockage massique en dihydrogène à une dizaine de pourcents en masse. Toutefois, cette dernière transformation n'aboutit jamais à la formation du métaborate de sodium anhydre, mais à la formation de borate de sodium hydraté, de formule NaBO2-xH20. L'eau, en tant que réactif, est donc également « piégée » par le borate. La capacité de stockage en dihydrogène dépend alors directement du degré d'hydratation du borate de sodium formé, c'est-à-dire de la valeur de x. Plus le borate de sodium a un degré d'hydratation élevé, plus la capacité de stockage en dihydrogène est faible. Par exemple, elle chute à 5,5 % si l'on forme NaBO2-4H20. Une solution (S), dite « stabilisée », préparée à partir de 100 mL d'une solution aqueuse d'hydroxyde de sodium, NaOH, à la concentration molaire 1,00-107! mol-L'!, dans laquelle est ajouté 36 g de NaBH4 (limite de solubilité à 25 °C), a, quant à elle, une capacité de stockage massique en dihydrogène de quelques pourcents en masse. Q38. Justifier, en exploitant le diagramme Æ-pH fourni en annexe, que l'anion BH}, est thermodynamiquement instable dans l'eau, et ce quel que soit le pH de Îla solution aqueuse. Q39. Écrire l'équation de la réaction de décomposition de l'anion BH, dans une solution aqueuse de pH fixé à 14 et évaluer, à 298 K, sa constante d'équilibre. En déduire la valeur de la capacité de stockage massique en dihydrogène de la solution aqueuse stabilisée (S) en supposant que la densité de la solution aqueuse d'hydroxyde de sodium NaOH est égale à 1. On ne tient pas compte, dans la question suivante, de la formation éventuelle de borate de sodium hydraté. Q40. Écrire l'équation de la réaction de formation de dihydrogène à partir de NaBH4 solide et de la quantité d'eau nécessaire entraînant la formation, supposée totale, de NaBO: solide. Calculer la valeur de la capacité de stockage massique de NaBH4 solide. Q41. Montrer, sans calculs supplémentaires, que la capacité de stockage massique de NaBH4 solide diminue s'1l y a formation de borate hydraté tel que NaBO2-4H20. Une solution aqueuse basique (pH = 14) de NaBH4 peut être utilisée directement comme combustible anodique. Le compartiment anodique est pré-rempli ou alimenté en continu dans une « pile à borohydrure direct BH, /O2 ». Ce type de pile a une énergie spécifique théorique, ou énergie massique théorique, inférieure à celle de la pile à combustible H2/02, mais une efficacité de conversion énergétique supérieure. L'énergie spécifique théorique d'une pile est définie comme Île rapport du travail utile maximal récupéré par le milieu extérieur sous forme de travail électrique par unité de masse. 12/16 Q42. Calculer, à 298 K et à pH = 14, la valeur de la force électromotrice de la pile à borohydrure direct BH; /O2. En déduire la valeur de l'énergie spécifique théorique de la pile à borohydrure direct à cette température. On assimile, pour ce calcul, la masse de la pile à celle du combustible utilisé uniquement et on suppose un fonctionnement de la pile en mode générateur, dans les conditions standard. 5. - Étude cinétique de la décomposition de NaBH, dans l'eau La cinétique de décomposition dans l'eau des anions borohydrure BH}, suit une loi de pseudo-premier ordre, avec une constante cinétique kobs qui dépend de la concentration en ions H30° supposée fixée dans les conditions de l'expérience. L'évolution de log kobs en fonction du pH est représentée ci- dessous (figure 4), kobs étant exprimée en s !. pH T # ÿ lo [L 12 13 14 15 lé - | -1 -à : = # 4 Qc £ -, -6 -# -ÿ Figure 4 Q43. Proposer, à l'aide de la courbe représentée figure 4, une valeur pour l'ordre partiel par rapport aux ions H30° selon les domaines de pH que l'on précisera. Q44. Établir l'expression de l'évolution de la concentration en ions BH; en fonction du temps f. Quelle est la valeur du temps de demi-réaction pour pH = 7 d'une part et pour pH = 14 d'autre part ? Conclure. Plusieurs mécanismes de la réaction d'hydrolyse de NaBH4 ont été proposés parmi lesquels Île mécanisme suivant en trois étapes : k; H30° + BH; C BHs + H20 k k BH; -- H: + BH; k3 BH3 +3 H20 -- H3BO3 + 3 H La contribution de l'eau à la vitesse est incluse dans les constantes k_1 et k3. 13/16 Q45. Établir la loi de vitesse d'apparition de H3BO3 à partir du mécanisme réactionnel proposé en appliquant l'approximation des états quasi-stationnaires à BH: et BH3. Commenter. 6. - Structure de BH: On envisage, dans le but de prévoir la structure de l'intermédiaire réactionnel BH, la construction, à l'aide de la méthode des fragments, du diagramme d'énergie des orbitales moléculaires (ou OM) de BH, dans la géométrie plan-carrée. On suppose que l'atome de bore est à l'origine d'un repère orthonormé et que les 4 atomes d'hydrogène sont positionnés sur les axes Ox et Oy, aux quatre sommets d'un carré. Différentes informations sur des orbitales atomiques (OA) et moléculaires (OM) sont fournies dans les données. Q46. Représenter, sur un diagramme d'énergie, l'allure conventionnelle des OM du dihydrogène H2. Préciser la symétrie © ou x et le caractère liant ou anti-liant de ces OM. Q47. Montrer que le diagramme d'énergie des OM du fragment H4 est constitué de 3 niveaux d'énergie, dont l'un est dégénéré. Attribuer, à chacune des OM du fragment H4 représentées dans les données, un niveau d'énergie. Q48. Indiquer les interactions possibles entre les OA du bore et les OM du fragment H4. Représenter, sur un diagramme d'énergie, l'allure conventionnelle des 4 OM de BH}, dans la géométrie plan-carrée, de plus faibles valeurs d'énergie. On s'accorde sur le fait que le niveau d'énergie de l'orbitale frontalière HO (haute occupée) permet de prévoir la géométrie d'un édifice. Le diagramme d'énergie, présenté figure 5, montre l'évolution des énergies des seules OM occupées dans la géométrie plan-carrée précédemment étudiée pour l'un des diagrammes et dans la géométrie déterminée en Q26 pour l'autre diagramme. À énergie ---- diagramme 1 diagramme 2 Figure 5 Q49. Attribuer chacun de ces diagrammes d'énergie à une géométrie possible de BH,. Y-a-t-1l accord entre le modèle VSEPR et celui des OM ? Justifier. Q50. En déduire, à partir de cette étude orbitalaire et des différentes données fournies en fin de sujet, une(des) structure(s) possible(s) de l'espèce chimique BH. 14/16 Données relatives au problème 2 Données à 298 K Constantes : Constante d'Avogadro : N4= 6,02-10* mol | Constante des gaz parfaits : R=8,31 J-K !-mol ! (RT/F)In10 = 0,06 V avec F = 96 500 C'mol ! Rayons covalents et ioniques en nm : Espèce H B Na Rayon covalent (nm) 0,040 0,080 Rayon 1onique (nm) 0,160 (hydrure H°) 0,030 0,1 Électronégativité (Pauling) : (B) = 2,04 ; 7(H) = 2,20 Masse molaire en g:mol! : MH) = 1,0 ; M(B)= 11 ; MC) = 12 ; MO)= 16 ; M(Na) = 23 Valeurs d'énergie des orbitales atomiques de valence du bore : -- 14,7 eV et -- 5,7 eV Valeurs d'énergie des orbitales moléculaires du fragment H : -- 16,6 eV, -- 13,6 eV (niveau d'énergie dégénéré) et -- 9,6 eV Allure conventionnelle des orbitales moléculaires du fragment H! : À y Y Y 1 (2 O3 4 Coefficients des OA pour les 4 OM de BH, , dans sa géométrie « réelle », de plus faibles valeurs d'énergie : OA 25 2Px 2py 2pz SH: SH2 SH: SH4 OM lai 0,50 0 0 0 0,24 0,24 0,24 0,24 I t2z 0 0 0 0,40 0 0 0,52 | --0,52 It2y 0 0 0,40 0 0,52 | --0,52 0 0 1 t2x 0 -- 0,40 0 0 0,37 0,37 | --0,37 | --0,37 Enthalpie standard de formation A:H° : Espèce CsHis(e) HO(1 CO2(2) ArH°(kJ-mol ) -- 230 -- 240 -- 390 Masse volumique de l'octane : ACsHisc) = 720 kg-m * 15/16 Potentiels standard d'oxydoréduction E° en volt : couple Na'(ag/Na(s) BO; (247 BH; (20) H(aay H2(9) E(V) -- 2,70 -- 0,41 0,00 couple SO (aa SO2(2) O2(g/H20( Ch@)/CT (9 S20$ (a9/SO£" (aq) E(V) + 0,17 + 1,23 + 1,36 + 1,96 Surtension anodique n: sur Pt en volt : Couple O2(ey HO) CLey/CT (ao) S,05" (a9/SO£" (aq) ma(V) ï 0,3 + 0,1 + 0,1 Surtension cathodique n. sur Pt en volt : Couple H* (aa) H2(9) Na (aay/Na(s) SO (a9/SO2(2) ne(V) -- 0,1 -- 0,4 -- ],4 Diagramme £-pH simplifié du bore construit en ne tenant compte que des espèces suivantes : BH (aq), H3BO3(aq) et BO; (ad) ) 10 t EM 0,5 F 0,0 F _ _ _ _-- _ _-- _ _-- _ _-- _ _-- _ _ _-- _-- _ _-- _-- -- 0 FT C 1,5 | | | | | | | | | | | | | > " 0 2 4 6 8 10 12 14 La concentration totale des espèces dissoutes est égale à c° = 1,00 mol-L'!. La droite tracée en traits pointillés délimite une partie du domaine de stabilité thermodynamique de l'eau. Constante d'acidité : pKa (H3B0O;/BO; ) = 9,2 FIN 16/16 IMPRIMERIE NATIONALE - 20 1160 - D'après documents fournis