CCINP Chimie PC 2023
| Thème de l'épreuve | Synthèse de l'épothilone A. Le cyanure de potassium. |
| Principaux outils utilisés | cristallographie, cinétique chimique, oxydoréduction, diagrammes E-pH, courbes courant-potentiel, orbitales moléculaires, chimie organique |
| Mots clefs | fragments, hydrazones, extraction de l'or, cyanuration, électrolyse |
Corrigé
:👈 gratuite pour tous les corrigés si tu crées un compte
👈 l'accès aux indications de tous les corrigés ne coûte que 1 € ⬅ clique ici
👈 gratuite pour tous les corrigés si tu crées un compte
- - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - -
👈 gratuite pour ce corrigé si tu crées un compte
- - - - - - - - - - - -
Énoncé complet
(télécharger le PDF)












Rapport du jury
(télécharger le PDF)





Énoncé obtenu par reconnaissance optique des caractères
SESSION 2023 PC3C
CONCOURS
COMMUN
INP
ÉPREUVE SPÉCIFIQUE - FILIÈRE PC
CHIMIE
Durée : 4 heures
N.B. : le candidat attachera la plus grande importance à la clarté, à la
précision et à la concision de la rédaction.
Si un candidat est amené à repérer ce qui peut lui sembler être une erreur
d'énoncé, il le signalera sur sa copie
et devra poursuivre Sa composition en expliquant les raisons des initiatives
qu'il a été amené à prendre.
RAPPEL DES CONSIGNES
«_ Utiliser uniquement un Stylo noir ou bleu foncé non effaçable pour la
rédaction de votre composition ; d'autres
couleurs, excepté le vert, peuvent être utilisées, mais exclusivement pour les
schémas et la mise en
évidence des résultats.
. _ Ne pas utiliser de correcteur.
« Écrire le mot FIN à la fin de votre composition.
Les calculatrices sont autorisées.
Le sujet est composé de deux problèmes indépendants.
Chaque problème est constitué de parties indépendantes.
Des données sont disponibles à la fin de chaque problème.
Toute réponse devra être clairement justifiée.
1/18
PROBLÈME 1
Synthèse de l'épothilone A
Les épothilones constituent une nouvelle classe de molécules macrocycliques
cytotoxiques à
16 chaïnons au fort potentiel en chimiothérapie. Plusieurs épothilones sont
actuellement en cours
de développement clinique pour le traitement de divers cancers. Ce problème
s'intéresse plus
particulièrement à la synthèse supportée sur résine de l'épothilone A par
l'équipe de K. C. Nicolaou
(Journal of the American Chemical Society, 1997, 119, 7960 et Angewandte Chemie
International
Edition 1997, 36, 2097) à partir des fragments suivants (figure 1) :
S
| d--
| N
SK
OH
fragment |
(résine}" 0
ARR ON épothilone A
O0 Oo O0 n " Me = méthyle = CH;
SiMe;tBu O tBu = tertbutyle = C(CH:);
fragment Il fragment III
Figure 1
Les parties de ce problème sont indépendantes et le candidat est libre de les
traiter dans l'ordre qu'il
souhaite. Pour l'écriture des mécanismes, chaque fois qu'il le juge nécessaire,
le candidat pourra
utiliser des notations simplifiées des molécules lui permettant de se
concentrer uniquement sur les
groupes caractéristiques concernés.
Partie 1 - L'épothilone A
Q1. Nommer les cinq familles fonctionnelles entourées dans la structure de
l'épothilone A
(figure 2).
famille
fonctionnelle 1
== 7 S
famille à Y--
fonctionnelle 2
NN 9 N
"HO 7: |
\ --- famille
D fonctionnelle 5
| | O0." OO
famille TSL. Tu ------ famille
fonctionnelle 3 fonctionnelle 4
Figure 2
2118
Q2. Attribuer le descripteur stéréochimique R ou S à l'atome de carbone
asymétrique repéré par
l'indice de position 7 sur la structure de l'épothilone À (figure 2). Justifier
la réponse.
Q3. Atitribuer le descripteur stéréochimique E ou Z à la double liaison
carbone-carbone hors du
cycle de l'épothilone À. Justifier la réponse.
Q4. Identifier tous les éléments stéréogènes de l'épothilone À et déterminer le
nombre de
stéréoisomères de configuration différents de l'épothilone A. Justifier la
réponse.
Partie Il - Synthèse du fragment |
La synthèse du fragment I peut être réalisée à partir du
2-méthyl-4-éthoxycarbonylthiazole 1 comme
substrat de départ et débute ainsi (schéma 1) :
S S Le S
| D -- 1.7 JL D -- oxydation contrôlée | »
co. Î N 2. hydrolyse HO N F N
O0 : 2 0 3
Schéma 1
Q5. Proposer un réactif pour la transformation 1 -- 2.
Expliquer pourquoi une oxydation contrôlée est nécessaire pour la
transformation 2 -- 3.
Le spectre infrarouge (IR) de l'espèce 3 présente, entre autres, une bande
d'absorption de forte
intensité au nombre d'onde 1 695 cm.
Q6. Proposer une attribution pour cette bande.
Le composé 3 permet d'accéder au fragment | à l'aide de la suite réactionnelle
suivante
(schéma 2) :
ci©
H PhP H ®
Cl --" > PPh;
(Sn2)
O 4 O 5 Ph = phényle = CéHs s
Et = éthyle = CH )
| EisN, EtOr benzène = CsHe | N
|
K
< 4. opn : , OH | [ >-- © 6 _ | )-- 1. organomagnésien 8 fragment |
N benzène, reflux | N 2. hydrolyse +
0 3 n 7 énantiomère
O
Schéma 2
3/18
Q7. Repérer le(s) site(s) électrophile(s) de l'espèce 4. Justifier la réponse.
Donner le type VSEPR (AX:E:) de l'atome de phosphore de la triphénylphosphine
(Ph:3P).
Justifier le caractère nucléophile de cet atome.
Q8. Proposer une structure pour l'organomagnésien 8.
Proposer un mécanisme modélisant la réaction de l'espèce 7 avec
l'organomagnésien 8. On
ne s'intéressera pas à la stéréosélectivité de la réaction.
Indiquer si le mélange du fragment | et de son énantiomère est optiquement
actif. Justifier
[la réponse.
Lors de l'étude de la transformation de l'espèce 7 avec l'organomagnésien 8,
des prélèvements du
milieu réactionnel sont effectués, à intervalles de temps réguliers, à l'aide
d'une seringue. Après
traitement, les prélèvements sont analysés par résonance magnétique nucléaire
du proton (RMN 'H)
à 500 MHz dans le chloroforme deutérié (CDCIH:). Au cours du temps, on observe,
entre autres :
-- un signal disparaissant à 9,57 ppm (singulet, 1H) ;
-- des signaux apparaissant à 5,79 -- 5,87 ppm (multiplet, 1H), 5,02 ppm
(doublet, J = 17,1 Hz, 1H)
et 4,97 ppm (doublet, J = 10,3 Hz, 1H).
Q9. Montrer que les prélèvements permettent de suivre l'avancement de la
réaction en attribuant
chacun des signaux à un ou des atomes d'hydrogène caractéristiques. Justifier
la réponse.
On utilisera les notations de la figure 3.
H? _s
Hc | 7 CHes
|
O 7
HEUR
fragment |
Figure 3
4/18
L'allylborane chiral (-)-Ipc2B(allyl) réagit comme un organomagnésien. En
l'additionnant à basse
température sur le composé 7, les auteurs sont parvenus à obtenir très
majoritairement le
fragment L. Ils ont pu déterminer les proportions du fragment | et de son
énantiomère à l'aide de la
méthode de dérivatisation de Mosher consistant à faire réagir quantitativement
le mélange obtenu
avec le chlorure d'acide chiral 9. Dans le schéma 3, l'espèce 10a provient de
la réaction entre le
chlorure d'acide 9 et le fragment I et l'espèce 10b de la réaction entre le
chlorure d'acide 9 et
l'énantiomère du fragment | :
CH30 CF:
S CI < 1. (-)-IpcB(allyl) | D-- 0 Et,O, -100 °C | No 9 KL + énantiomère > 10a + 10b
2. hydrolyse (1,5 %) pyridine, 20 °C
OH
fragment I
(98,5 %)
| NS
LE NON N7
--)-Ipc;B(allyl) Et,O = diéthyléther pyridine
Source : J. À. Dale, D. L. Dull, H. S. Mosher, The Journal of Organic
Chemistry, 1969, 34, 2543.
Schéma 3
Q10. Représenter l'espèce 10a et proposer un mécanisme rendant compte de sa
formation.
Q11. Indiquer la relation d'isomérie qui lie les composés 10a et 10b.
Expliquer pourquoi la réaction quantitative avec le chlorure d'acide 9 permet a
priori de
déterminer les proportions du fragment | et de son énantiomère par analyse en
résonance
magnétique nucléaire du proton (RMN 'H).
Le pouvoir rotatoire «à du mélange obtenu lors de la réaction de l'espèce
chimique 7 avec
l'allylborane (-)-Ipc:2B(allyl), composé de 98,5 % de fragment let 1,5 % de son
énantiomère, mesuré
à 22 °C à une concentration de 1,00:10 2 g-mL-' dans le chloroforme (CHCI:)
avec une cuve de
1,00 dm en utilisant la raie D du sodium, est égal à -- 0,202°.
Q12. Déterminer le pouvoir rotatoire spécifique [«]L°° du fragment | dans les
mêmes conditions.
9/18
Partie II - Synthèse du fragment II
La synthèse du fragment Il utilise le B-cétoaldéhyde 11 commercial comme
substrat de départ
(schéma À) :
L 1. ()-Ilpc2B(allyl) agent de silylation 13
RNA EtO, -100 °C VX 2,6-lutidine PSY
2. hydrolyse CH,Cb, 25 °C
O ©
11 2 (soul stérécisomère) 14° NSiMe1Bu
coupure S o H { | à
oxydante
gd, | + À re
= O7 H
O O\ ñ 16
15 SiMe-Bu VE | NS
dati < OH To N° PYCENCE : (--)-Ipc,B(allyl) Et,O = diéthyléther 2,6-lutidine 0 ane au Me = méthyle = CH; 2 Bu = tertbutyle = C(CH:); fragment II 7 Schéma 4 Q13. En assimilant la réactivité de l'allylborane (-)-Ipc2B(allyl) à celle d'un organomagnésien, justifier la chimiosélectivité de la réaction 11 -- 12. Q14. L'agent de silylation 13 est un donneur de silicium électrophile. La silylation de l'alcool du composé 12 (réaction 12 + 13 -- 14) est beaucoup plus rapide avec le trifluorométhanesulfonate de tertbutyldiméthylsilyle 13a qu'avec son analogue chloré 13b (figure 4 ; source : E. J. Corey, H. Cho, C. Rücker, D. H. Hua, Tetrahedron Letters, 1981, 22, 3455). Justifier cette différence de réactivité. O [| BuMe,SiT OST CFS iBuMe,Si--Cl | O 13b 13a Me = méthyle = CH; Bu = tertbutyle = C(CH:); Figure 4 Q15. Déterminer la variation du nombre d'oxydation des deux atomes de carbone de la double liaison de l'espèce 14 lors de la transformation 14 -- 15 + 16. Justifier la réponse. Justifier l'adjectif " oxydante " pour qualifier cette transformation. 6/18 Partie IV - Synthèse du fragment II La synthèse du fragment III débute à partir de l'espèce 17 selon la séquence de réactions ci-dessous (schéma 5) : NaBH MeOH, 0 °C 2 18 silylation puis oxydation débenzylation BuMe,Si <= << OH contrôlée tBuMe,Si< H 18 - 07 TE, OT Me = méthyle = CH; 19 20 0 tBu = tertbutyle = C(CH;): Schéma 5 Document 1 - Les hydrazones chirales de Corey et Enders L'introduction stéréosélective d'un substituant sur la position «à des dérivés carbonylés a fait l'objet de nombreuses études. La méthode développée par E. J. Corey et D. Enders en 1976 repose sur une séquence réactionnelle comprenant la réaction d'un aldéhyde ou d'une cétone avec la (2S)-1-amino-2-méthoxyméthylpyrrolidine (SAMP) et la déprotonation de l'hydrazone chirale obtenue par le diisopropylamidure de lithium [(CH3)2CH]2NLi suivie du piégeage, avec un électrophile (R°X), de l'azaénolate de configuration E généré. Ensuite, la fonction carbonyle et l'auxiliaire chiral SAMP sont régénérés par ozonolyse : CA | A O (SAMP) le (CH): CHE NL 2. _-- 3)? CHINE >
XuR - CH3O pe CH:0
R2 60 °C THE, 0 °C S
R2
hydrazone | R!_
-- azaénolate
C4 ©
R°X UN O3 (ozone) "
- 5 ON - ac R' + SAMP
--100 °C ( °C CH30 7 AR CH,Cb, --78 °C R 3
R
R?2
RS
Source : E. J. Corey, D. Enders, Tetrahedron Letters, 1976, 17, 3.
Q16. En vous aidant du document 1, proposer une séquence réactionnelle, en
représentant
chaque intermédiaire, pour la synthèse stéréosélective de l'espèce 17 en
utilisant notamment
certains des composés À à E représentés dans la figure 5.
O O CH30 { \
1 ACC Ce o CHa UN
H H TS |
D
Figure 5
Q17. Proposer un mécanisme rendant compte de la formation de l'espèce 18.
7118
La transformation 17 -- 18 est suivie par chromatographie sur couche mince
(CCM) en effectuant
des prélèvements du milieu réactionnel, à intervalles de temps réguliers (f =
5, 10, 15 et 20 min), à
l'aide d'un capillaire. La phase stationnaire polaire est constituée d'une fine
couche de gel de silice
(SiO2) avec indicateur de fluorescence. L'éluant utilisé est un mélange
d'hexane et de diéthyléther
(Et20) (3:2 en volume). Les tâches sont révélées avec une lampe à ultraviolets
(UV) et entourées
au crayon à papier (figure 6).
front du on /
solvant 77 Dépôt 1 : 1 mg du composé 17 dans
0,2 mL de dichlorométhane (CH,Cl).
° . Dépôt 2 : 1 mg du composé 17 dans
00 0 0 0,2 mL de dichlorométhane (CH,Cl;) +
Ô 0 prélèvement du milieu réactionnel à t.
OO
Dépôt 3 : prélèvement du milieu
réactionnel à £.
ligne de
dépôt
1
2
1 2
-- 9
D @
© @
© @
© @
© @
©
Q
®
®
Dé > @
-- 9
t= 5 min t=10min ft=15min t=20 min
Figure 6
Q18. À chaque tâche révélée sur les plaques de chromatographie sur couche mince
(CCM),
attribuer le produit qui lui correspond. Justifier les positions relatives de
ces tâches.
Estimer le temps au bout duquel la transformation peut être considérée comme
totale.
Justifier la réponse.
Document 2 - Éthers de benzyle et de silyle
Un alcool peut être protégé sous forme d'éthers de benzyle ou de silyle, via
des réactions de
substitution nucléophile S\2. La déprotection d'un éther de benzyle s'effectue
sous atmosphère de
dihydrogène (H:) en présence d'un métal de transition, alors que celle d'un
éther de silyle nécessite
un traitement par une source d'ions fluorure (F°) en présence d'eau. Ces deux
protections des
alcools sont dites " orthogonales "" car les conditions de déprotection de
l'une n'affectent pas l'autre.
Br
Nat ou |)
R--OH R--ON
(CH) (82
éthers de benzyle
H;, métal de transition |
R1 R!
NS base | _R*
R--OH + R£-Si-GP SIL
/ (SN2) R--O RS
RS
(GP = groupe partant)
éthers de silyle
source de F7
H,0
Source : T. W. Greene, P. G. M. Wuts, Protective Groups in Organic Chemistry,
3" Edition,
Wiley Interscience, New-York, 1999.
Q19. L'espèce est obtenue par silylation puis débenzylation du composé 18. En
vous aidant du
document 2, justifier l'ordre choisi pour effectuer ces deux réactions pour une
synthèse
sélective de l'espèce 19. Justifier la réponse.
8/18
Le fragment IIT est finalement obtenu avec la séquence de réactions décrites
ci-dessous
(schéma 6) :
NaH (1 équiv) 1. CI
22 - 23
TK Q OH _-
7° 21 DMF, 25 °C 2. hydrolyse
transformations O
? impliquant 20
24
O
SN fragment III
DMF = N,N-diméthylformamide
Schéma 6
Q20. Représenter l'intermédiaire [22]. Quel gaz accompagne sa formation 7?
Q21. Représenter l'espèce 23 et proposer un mécanisme rendant compte de sa
formation (la
résine utilisée est un polystyrène réticulé chimiquement inerte).
Q22. Proposer une séquence réactionnelle, en représentant chaque intermédiaire,
pour la
formation du composé iodé 24 à partir de l'espèce 23.
Partie V - Accès à l'épothilone A
Les trois fragments sont tout d'abord assemblés selon la séquence réactionnelle
suivante
(schéma 7) :
Gésne}o
Gésne} 0
È [(CH3)CHINLi O HO
< OH (2 équiv) fragment III 7 RSI: de . OH = THE, --78 °C puis hydrolyse acide \ O Oo O T 5 ï SiMe: Bu SSiMe;Bu fragment II 26 S D-- | | S ( \ résine O | |) oe OH 7 | N THF = tétrahydrofurane fragment! > 7e Me = méthyle = CH;
. O | tBu = tertbutyle = C(CH:)3 |
O © O0
SiMe;tBu
/
Schéma 7
9/18
Q23. Représenter l'énolate [25] et justifier l'emploi de 2 équivalents de
diisopropylamidure de
lithium [(CH3)2CH)]2NLi pour sa formation.
Proposer un mécanisme rendant compte de la formation du composé 26. On ne
s'intéressera
pas à la stéréosélectivité de la réaction.
Q24. Proposer des conditions opératoires pour optimiser le rendement de la
formation de l'espèce
chimique 27. On considérera que l'alcool du composé 26 n'est pas réactif en
raison d'un
important encombrement stérique.
Finalement, l'épothilone À est obtenue à partir du composé 27 en trois étapes
décrites ci-dessous
(schéma 8) :
fésne} 0
HO
+
Y
\Y
Me = méthyle = CH;
.. | Bu = tertbutyle = C(CH3)3
28 ----+
O OH O
épothilone A
Schéma 8
Q25. Proposer un réactif pour effectuer la transformation 28 -- épothilone À.
On ne s'interessera
pas à la stéréosélectivité de la réaction.
Identifier, sans le représenter, le sous-produit, minoritaire et de formule
brute C26H39NO7S,
qui accompagne la formation de l'épothilone À de formule brute C;6H39NOGS.
10/18
Données relatives au problème 1
Numéros atomiques et électronégativités de Pauling
Élément H C N O P CI
Z 1 6 7 8 15 | 17
k 2,20 | 2,55 | 3,04 | 3,44 | 2,19 | 3,16
Données RMN 'H
Gamme de déplacements chimiques de quelques atomes d'hydrogène caractéristiques
et valeurs
typiques des constantes de couplage 2J et 3J des atomes d'hydrogène
éthyléniques"
Atomes d'hydrogène Ô (ppm)
O-H 1,0 -- 6,0
C=C-CH 1,6 -- 2,3
--CH-0-- 3,5 -- 4,8
C=C-H 4,6 -- 7,0
CHO (aldéhyde) 9,1 -- 10,3
Données IR
Structures J (Hz)
H
L 7 3J = 12-18
4H 3J= 5-12
à 2 J très faible (< 3 Hz) : a H souvent non observée Gamme de fréquences de vibration de quelques liaisons caractéristiques" Liaisons o (cm!) Intensité C=O (aldéhyde) 1 720 -- 1 740 Forte C=O (aldéhyde conjugué) | 1 660 -- 1 705 Forte C=N (imine) 1 640 -- 1 690 Variable C=C (alcène) 1 645 -- 1 675 Faible C=C (alcène conjugué) 1 620 -- 1 650 Faible "Source : E. Pretsch, W. Simon, J. Seibl, T. Clerc, W. Fresenius, J. F. K Hubert, E. Pungor, G. A. Rechnitz, W. Simon, Tables of Spectral Data for Structure Determination of Organic Compounds, 2"4 Edition, 1989. Constantes d'acidité (supposées indépendantes de la température ; les valeurs < 0 et > 14 sont extrapolées)
Couple pK:
CF3S0:H / CF:S0; -- 14,7
HCI / CF -- 5,9
E" aq) / SE aq) 3 -- 5
er (aq VE N(aq) 9,2
ROH / RO° 16 -- 18
O O
R' R' --- 22
_ RS
H2 / H 35
[(CH3)2CHI2NH / [(CH3)2CHI2N 36
11/18
PROBLÈME 2
Le cyanure de potassium
À température ambiante sous pression atmosphérique, le cyanure de potassium de
formule KCN se
présente sous forme d'un composé cristallin incolore semblable au sucre et très
soluble dans l'eau.
Très toxique pour les mammifères, il a notamment été utilisé comme mort aux
rats jusqu'en 1970. II
constitue l'une des seules substances qui forme des composés solubles de l'or
dans l'eau et est
ainsi utilisé en bijouterie pour exécuter des dorures, ainsi que pour extraire
l'or du minerai. Le
cyanure de potassium présente en outre de nombreuses applications en chimie
organique.
Dans le problème 2 seront étudiées la structure et la synthèse du cyanure de
potassium, ainsi que
son utilisation dans le procédé d'extraction de l'or.
Partie 1 - Structure et synthèse du cyanure de potassium
À 25 °C et sous pression atmosphérique, la structure cristallographique du
cyanure de potassium
est analogue à celle du chlorure de sodium NaCl : les anions CN" occupent tous
les noeuds d'un
réseau Cubique à Faces Centrées et les cations K* occupent tous les sites
octaédriques. Chacun
des ions sera assimilé à une sphère.
Q26. Représenter la maille conventionnelle légendée du cyanure de potassium et
vérifier la
stæoechiométrie du cristal.
Q27. Justifier quantitativement le fait que le cyanure de potassium soit " très
soluble dans l'eau '
à 298 K, en négligeant la basicité des ions cyanures CNT.
La figure 7 représente le diagramme des niveaux d'énergie des Orbitales
Moléculaires (O.M.) de
lion cyanure :
Eu 1 E
PR
P6 P;
X
2p, 2P, 2p, ee
ps 2p, 2p, 2p, 7
Ps Pa y
1 D C--N
25
... ds
P;
C N
Figure 7
12/18
La figure 8 représente les surfaces d'isodensité des O.M. de l'ion cyanure :
Q28.
Q29.
RE ee
OM e OM f
k& Y
Figure 8
Attribuer les surfaces d'isodensité des O.M. de a à fde la figure 8 aux niveaux
d'énergie des
O.M. o i de la figure 7. Préciser le type © ou x de chacune de ces O.M. de a à
f ainsi que
son caractère liant, non liant ou antiliant.
Établir la configuration électronique de l'ion cyanure CN- et confronter la
structure de Lewis
et le modèle des O.M. pour décrire l'ion cyanure.
L'une des synthèses les plus répandues du cyanure de potassium est réalisée en
milieu aqueux
tamponné à pH = 12,0 par traitement d'une solution aqueuse de potasse (K*(aq) +
HO(aa))
considérée en excès par un volume V, d'une solution aqueuse d'acide
cyanhydrique HCN(aq) de
concentration C: = 1,75 mol:-L" selon la transformation modélisée par la
réaction d'équation
chimique :
HCN(aq) + HO(aq) = H20(1) + CN'(aq)
On obtient alors une solution aqueuse de cyanure de potassium (K*(aq) +
CN'(aa)). Plusieurs étapes
non détaillées ici permettent ensuite d'isoler le cyanure de potassium sous
forme solide.
Q30.
Q31.
Q32.
Rappeler les caractéristiques d'une solution-tampon.
Proposer un protocole opératoire permettant de synthétiser 1,0 L d'une solution
tampon à
pH = 12,0 et de concentration totale en quantité de matière d'espèces dissoutes
phosphorées
1,0 mol:L"" à l'aide de tout matériel de laboratoire nécessaire, d'eau
distillée et des espèces
solides suivantes : NaH2PO4(s) ; Na2HPO4(s); Na3PO4(s). On justifiera
clairement le
protocole proposé.
En considérant la transformation de la synthèse comme quantitative, estimer le
volume VA
d'acide cyanhydrique aqueux nécessaire pour synthétiser une masse de 1,00 kg de
cyanure
de potassium. Détailler le calcul.
13/18
La figure 9 représente le diagramme potentiel-pH à 298 K faisant apparaître les
domaines de
Stabilité des espèces HOCN(aq), CNOT(aq), HCN(aq) et CN'(aq) délimités en
traits pleins. Les
frontières correspondant au diagramme potentiel-pH de l'eau ont été ajoutées en
pointillés. La
concentration de tracé est fixée à Ciacs = 1,0:10 2 mol:L-' et représente la
concentration totale en
espèces dissoutes ; à la frontière entre les domaines de stabilité de deux
espèces dissoutes, leurs
concentrations sont considérées comme égales.
E (V)
A
1,5 T
LL _
Fe
1,0 + FE
» ._
» " a.
| HOCN Re
0,5 TC _ . ee
fl CNO N
£ 2 4 6 8 10 12 14
0 ---- > DH
Re : P
0,5 , ST
ri TE =
_] nn. ...
»: | ._
| HCN
10 -
+ CN-
us À
Figure 9
Source : J. S. Afr. Inst. Min. Metall, vol. 90, no. 2. Feb. 1990.
Q33. À l'aide de la figure 9, déterminer la valeur du pK, de deux couples
acide-base du système
étudié à définir ; justifier succinctement.
Q34. Montrer par un calcul que la transformation de l'acide cyanhydrique en
cyanure de potassium
est quantitative au pH retenu pour la synthèse.
En réalité, les ions cyanures réagissent lentement en milieu aqueux basique
désaéré.
Q35. En utilisant la figure 9, justifier cette transformation. Écrire
l'équation de la réaction
modélisant cette transformation et déterminer approximativement sa constante
thermodynamique d'équilibre à 298 K en utilisant la même figure. Conclure.
Une étude cinétique de cette transformation des ions cyanures en milieu aqueux
désaéré a été
réalisée par M.D. Adams en 1990. Dans cette étude, l'auteur fait l'hypothèse
que la vitesse de la
réaction s'écrit sous la forme :
v = k[CN-É
a étant l'ordre partiel par rapport à CN" et k; la constante de vitesse de la
réaction.
L'auteur prépare initialement à 50 °C un volume V = 1,0 L d'une solution
aqueuse de cyanure de
potassium (K*{(aq) + CN-(aq)) de concentration initiale Co = 1,0-10-* mol:-L-T
dans un milieu
tamponné de pH = 13,3. Il effectue un suivi de la concentration C(f) en ions
cyanure CN" du mélange
réactionnel en titrant à différents instants ft; un échantillon de volume V" =
10,0 mL du milieu
réactionnel par une solution aqueuse de nitrate d'argent (Ag"'(aq)+NO;(aq)) de
concentration
Cag = 1,0:10 7 mol-L'. Chacun des titrages réalisé aux différents instants ft;
est suivi par
potentiométrie.
14/18
Les résultats d'une régression linéaire associée au suivi cinétique de la
réaction figurent sur la
courbe de la figure 10 où C(f) est exprimé en mol:-L". Les barres d'erreurs
apparaissent pour
chaque point expérimental.
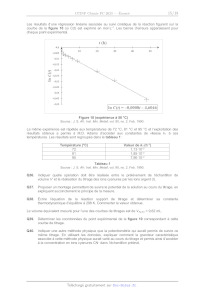
-4,6 I >
À
D,
4,605 "3
-4,61 + ru,
24,615 +
-4,625 +
4,63 + UE
In C(Ô
e
e
e
e
e
e
e
°e
e
-4,635 +
4,64 À
4,65
In C( = -0,00087 -- 4,6046
Figure 10 (expérience à 50 °C)
Source : J. S. Afr. Inst. Min. Metall, vol. 90, no. 2. Feb. 1990.
La même expérience est répétée aux températures de 72 °C, 81 °C et 95 °C et
l'exploitation des
résultats obtenus a permis à M.D. Adams d'accéder aux constantes de vitesse k;
à ces
températures. Les résultats sont regroupés dans le tableau 1 :
Q36.
Q37.
Q38.
Température (°C) Valeur de k: (h")
72 1,13-107°
81 1,85-10
O5 7,90-107
Tableau 1
Source : J. S. Afr. Inst. Min. Metall, vol. 90, no. 2. Feb. 1990.
Indiquer quelle opération doit être réalisée entre le prélèvement de
l'échantillon de
volume V' et la réalisation du titrage des ions cyanures par les ions argent
(1).
Proposer un montage permettant de suivre le potentiel de la solution au cours
du titrage, en
expliquant succinctement le principe de la mesure.
Écrire l'équation de la réaction support de titrage et déterminer sa constante
thermodynamique d'équilibre à 298 K. Commenter la valeur obtenue.
Le volume équivalent mesuré pour l'une des courbes de titrages est de Vagéa =
9,62 mL.
Q39.
Q40.
Déterminer les coordonnées du point expérimental de la figure 10 correspondant
à cette
courbe de titrage.
Indiquer une autre méthode physique que la potentiométrie qui aurait permis de
suivre ce
même titrage. En utilisant les données, expliquer comment la grandeur
caractéristique
associée à cette méthode physique aurait varié au cours du titrage et permis
ainsi d'accéder
à la concentration en ions cyanures CN° dans l'échantillon prélevé.
15/18
Q41. En utilisant la figure 10, déterminer l'ordre partiel a par rapport à CNT
ainsi que la valeur de
la constante de vitesse k, et son incertitude-type associée à 50 °C en
détaillant le
raisonnement.
Q42. En utilisant les résultats du tableau 1, déterminer la valeur de l'énergie
d'activation de cette
réaction en détaillant le raisonnement.
Partie Il - Extraction de l'or par cyanuration
L'un des procédés les plus utilisés pour extraire l'or d'un minerai brut met en
jeu la cyanuration. Le
minerai est d'abord finement broyé, puis mis en solution aqueuse sous forme de
complexe
AU(CN), par cyanuration. La solution ainsi obtenue est ensuite traitée par du
charbon actif, puis
une électrolyse permet ensuite de récupérer l'or séparé de la majorité des
autres constituants du
minerai.
11.1 - Cyanuration de l'or
L'étape de cyanuration consiste à faire passer l'or métallique du minerai en
solution aqueuse sous
forme de complexe AU(CN)., . Pour cela, l'or est dissous dans une solution
aqueuse aérée contenant
du cyanure de potassium selon la transformation modélisée par la réaction
d'équation :
4 Au(s) + 8 CN'(aq) + O2(aq) + 2 H20(1) = 4 AU(CN), (aq) + 4 HO (aq)
Q43. Déterminer le nombre d'oxydation de l'or dans le complexe AU(CN),.
Q44. Indiquer le type de réaction qui se produit lorsque l'or est dissous dans
une solution aqueuse
aérée contenant du cyanure de potassium. Justifier.
11.2 - Adsorption par le charbon actif
Le charbon actif permet d'absorber sélectivement certaines espèces présentes en
solution.
Concernant la solution obtenue, ce dernier retient sélectivement le complexe
Au(CN), selon
l'équilibre :
AU(CN), (aq) = AU(CN), (ads) associé à une enthalpie standard d'adsorption
AasH° < 0 où AU(CN), (ads) représente le complexe adsorbé sur le charbon actif. Le charbon actif est ainsi introduit dans la solution obtenue à l'issue de l'étape de cyanuration, l'ensemble étant refroidi à température 4; = 0 °C pendant quelques heures. L'ensemble est ensuite filtré sous vide et l'essorat contenant le charbon actif est récupéré, puis plongé dans une solution d'eau chaude de température 4; = 80 °C pendant quelques dizaines de minutes. Le mélange est enfin filtré sous vide et on récupère le filtrat. Q45. En utilisant la relation de Vant Hoff appliquée à l'équilibre d'adsorption du complexe, interpréter les températures 4; et 0: imposées lors de ces étapes mettant en jeu le charbon actif. 16/18 1.3 - Électrolyse permettant d'obtenir l'or métallique L'étape suivante consiste à réduire le complexe Au(CN), (aq) du filtrat aqueux précédemment obtenu par électrolyse afin de former l'or métallique brut. Elle est réalisée à pH = 14 en appliquant une tension de 1,7 V avec une intensité de courant correspondante de 20 mA. La cathode utilisée est en laine d'acier (filaments fins d'acier) tandis que l'anode est en plomb. Q46. Représenter un schéma légendé du dispositif permettant de réaliser l'électrolyse, en précisant le sens de circulation des électrons et les polarités des électrodes. Q47. Écrire toutes les réactions pouvant se produire à chaque électrode. Q48. À l'aide d'un tracé des courbes courant-potentiel, préciser la réaction électrochimique se déroulant à chaque électrode et justifier la tension appliquée lors de l'électrolyse. On prendra en compte le fait que les potentiels standard sont donnés à pH = 0. Q49. Préciser l'intérêt de l'utilisation, à la cathode, de laine d'acier comparativement à une plaque d'acier. Justifier le choix du plomb à l'anode plutôt que l'acier pour cette électrolyse. Q50. Estimer la durée de l'électrolyse permettant d'obtenir un dépôt de 1,0 g d'or en estimant le rendement de cette électrolyse à 90 %. 17/18 Données relatives au problème 2 à 298 K Numéros atomiques Élément H | C | N | K | Au Z 1 6 7 19 | 79 Masses molaires atomiques Élément H C N O | Na | P K | Au M (g:mol) 1,0 | 12,0 | 14,0 | 16,0 | 23,0 | 31,0 | 39,1 | 197,0 Constantes d'acidité (supposées indépendantes de la température) Couple H,PO; (aq) / HPOY" (aq) HPOY (aq) / POS (aq) Pa 7,2 12,3 Constante d'autoprotolyse de l'eau : pK: = 14,0 Produits de solubilité (supposés indépendants de la température) Couple KCN(s) AgCN(s) PKs -- 2,08 15,8 Potentiels standard à pH = 0 (les espèces qui n'apparaissent pas sont supposées électropassives) Couple | H:0*(aq)/H:(g) Au(CN); (aq)/Au(s) O2(g)/ H20(1) E° (V) 0,00 -- 0,60 1,23 Surpotentiels anodiques en oxydation (tous les autres couples sont supposés rapides) Couple O2(g)/H20(1) sur plomb O2(g)/H20(1) sur acier n (V) + 0,6 + 1,0 Surpotentiels cathodiques en réduction (tous les autres couples sont supposés rapides) Couple H20(1)/H:(g) sur plomb H20(1)/H2(g) sur acier n (V) -- 0,9 -- 0,4 Conductivités molaires ioniques (supposées indépendantes de la température) Espèce Ag'(aq) NO; (aq) K'(aq) CN"(aq) À (MmS-m°-mol) 6,2 7,1 7,3 7,8 À 298 K : RTIn(10}/F = 0,06 V Constante de Faraday : F = 9,65:10* C:mol"! Constante d'Avogadro : NA = 6,02-10* mor"! Constante des gaz parfaits : R = 8,31 J:K-"-:mol"' Conversion d'unités de température : 7 = 0 + 273 avec Ten K et Oen °C FIN 18/18