CCINP Chimie PC 2024
| Thème de l'épreuve | Le zirconium et la zircone, Synthèse des salicylihalamides A et B |
| Principaux outils utilisés | cristallographie, cinétique chimique, thermodynamique, mélanges binaires, chimie organique, orbitales moléculaires, chimie de coordination, procédés industriels continus |
| Mots clefs | catalyseur, procédé continu, couplage de Stille, allylborane |
Corrigé
:👈 gratuite pour tous les corrigés si tu crées un compte
👈 l'accès aux indications de tous les corrigés ne coûte que 1 € ⬅ clique ici
👈 gratuite pour tous les corrigés si tu crées un compte
- - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - -
👈 gratuite pour ce corrigé si tu crées un compte
- - - - - - - - - - - - - - -
Énoncé complet
(télécharger le PDF)













Rapport du jury
(télécharger le PDF)







Énoncé obtenu par reconnaissance optique des caractères
SESSION 2024 PC3C
CONCOURS
COMMUN
INP
ÉPREUVE SPÉCIFIQUE - FILIÈRE PC
CHIMIE
Durée : 4 heures
NB. : le candidat attachera la plus grande importance à la clarté, à la
précision et à la concision de la rédaction.
Si un candidat est amené à repérer ce qui peut lui sembler être une erreur
d'énoncé, il le Signalera sur Sa copie
et devra poursuivre sa composition en expliquant les raisons des initiatives
qu'il a été amené à prendre.
RAPPEL DES CONSIGNES
« Utiliser uniquement un Stylo noir ou bleu foncé non effaçable pour la
rédaction de votre composition ; d'autres
couleurs, excepté le vert, bleu clair ou turquoise, peuvent être utilisées,
mais exclusivement pour les schémas
et la mise en évidence des résultats.
. Ne pas utiliser de correcteur.
« Écrire le mot FIN à la fin de votre composition.
Les calculatrices sont interdites.
Le sujet est composé de deux problèmes indépendants.
Des données sont disponibles à la fin de chacun des deux problèmes.
Toute réponse devra être clairement justifiée.
1/16
PROBLÈME 1
Le zirconium et la zircone
Partie | - Le zirconium métallique
1.1 - Atomistique
Du fait de sa forte résistance à la corrosion, le zirconium métallique est
employé dans l'industrie
chimique utilisant des agents corrosifs. Il sert également dans les revêtements
des moteurs à
réaction ou en tant qu'élément d'alliages aux caractéristiques mécaniques
améliorées. En raison de
ses propriétés qu'il conserve à température élevée et couplé à sa faible
absorption des neutrons, le
zirconium est aussi utilisé dans la construction de réacteurs nucléaires
fonctionnant à une
température pouvant atteindre 400 °C.
Q1. Énoncer, explicitement et en les nommant, les règles de construction de la
configuration
électronique d'un atome dans son état fondamental.
Q2. Écrire la configuration électronique du zirconium dans son état
fondamental. En déduire les
nombres d'oxydation extrêmes du zirconium.
Q3. Déterminer le numéro atomique de l'hafnium, de symbole Hf, situé dans la
même colonne de
la classification périodique que le zirconium et à la période suivante.
Justifier.
1.2 - Hydrure de zirconium ZrHx
Le dihydrogène H2 constitue un combustible de choix dans les propergols
destinés aux fusées
spatiales. Son stockage, problématique, peut être toutefois envisagé sous forme
atomique au sein
de divers matériaux : métaux et alliages par exemple. Ainsi, l'action directe
du dihydrogène H2 sur
le zirconium métallique engendre un hydrure, de formule ZrHx, avec x entier
naturel à déterminer.
La structure cristalline du zirconium métallique est de type cubique faces
centrées (CFC). Dans la
structure cristalline de l'hydrure ZrHx, les atomes d'hydrogène H s'insèrent
dans des sites interstitiels
du réseau CFC du zirconium métallique.
Q4. Quelle est la nature de la réaction conduisant à la formation d'hydrure de
zirconium ZrHx à
partir de dihydrogène et de zirconium métallique ? Justifier.
Q5. Représenter la maille conventionnelle du réseau CFC du zirconium
métallique. Situer
explicitement les centres des sites interstitiels de type octaédrique, notés O,
et de type
tétraédrique, notés T, du réseau CFC du zirconium métallique.
On note ro et rr le rayon d'un atome assimilé à une sphère, et r(Zr) le rayon
du zirconium métallique.
Les indices © et T représentant respectivement les sites octaédriques et
tétraédriques, dans
lesquels peuvent s'insérer l'atome sans déformation du réseau CFC du zirconium
métallique.
Q6. Déterminer les rapports ro / r(Zr) et rr / r(Zr).
Les atomes d'hydrogène H se situent dans la totalité des sites interstitiels
tétraédriques, l'occupation
de ces sites assurant à l'hydrure de zirconium ZrHx une meilleure cohésion.
Q7. En déduire la formule brute de l'hydrure ZrHx.
2116
L'aptitude au stockage du dihydrogène par un métal, noté Mét, s'exprime par sa
capacité volumique
d'absorption, notée Cya(Mét). Celle-ci est définie comme le rapport me avec
Mm(H) la masse
d'atomes d'hydrogène H absorbés dans la maille conventionnelle du métal Mét et
V' le volume de la
maille conventionnelle du métal Mét pur.
Q8. Exprimer la capacité volumique d'absorption C,A(Zr) du zirconium
métallique, en fonction de
la masse molaire de l'hydrogène VM{H) et du rayon du zirconium métallique r(Zr).
1.3 - Étude de la liaison zirconium -- dihydrogène
Afin d'interpréter la rupture de la liaison H-H, lors de la formation de
lhydrure ZrHx, l'interaction
entre le zirconium métallique et le dihydrogène H: est modélisée à l'aide de la
théorie des orbitales
moléculaires (OM). Pour simplifier, la surface du métal est réduite à un seul
atome métallique de
zirconium. Cet atome est positionné à l'origine d'un repère orthonormé Oxyz.
L'approche du
dihydrogène H, représentée figure 1, se fait selon l'axe Oz, les 2 atomes
d'hydrogène demeurant
dans un plan parallèle au plan Oxy. L'axe internucléaire de la liaison H-H est
choisi parallèle à l'axe
Oy et perpendiculaire à l'axe Oz.
X
KY
Figure 1 - Approche du dihydrogène H:
Pour cette étude, seules les orbitales atomiques (OA) d de valence du zirconium
sont prises en
compte. Leur allure est indiquée en fin de problème. Les valeurs d'énergie des
OM du
dihydrogène H: et des OA d de valence du zirconium sont également fournies.
Q9. Représenter le diagramme énergétique des OM du dihydrogène H: et associer à
chaque
niveau d'énergie la représentation conventionnelle de l'OM correspondante.
Préciser le
caractère liant, non-liant ou anti-liant de ces OM, ainsi que leur symétrie 6
ou x.
Q10. Rappeler les deux conditions d'interaction entre deux orbitales.
Identifier les OA d de valence
du zirconium pouvant interagir avec les OM de Hz.
Q11. Montrer, à l'aide de la représentation de deux diagrammes énergétiques
distincts, que deux
transferts d'électrons sont possibles : H2 -- Zr (donation) et Zr -- H2
(rétrodonation). Que dire
alors de la liaison H-H lorsque le dihydrogène se lie au zirconium métallique ?
Justifier.
1.4 - Complexe du zirconium
Le zirconium intervient également dans la formation de certains complexes, de
type métallocène
notamment. Ces derniers permettent de réaliser des réactions de polymérisation
par coordination
d'alcènes, comme par exemple celle du propylène (ou propène d'après la
nomenclature officielle).
Le complexe de zirconium est noté, pour simplifier, [Cp2ZrX2], Cp étant
l'acronyme du groupe
cyclopentadiényle, de formule C;H;, X représentant un halogène ou un groupe
méthyle CH.
L'utilisation de métallocènes à base de zirconium permet, entre autres, de
contrôler les
enchaînements des motifs dans la macromolécule de polypropylène formée.
1 Thèse, Synthèses et études cinétiques de précatalyseurs zirconocènes utilisés
pour la polymérisation isosélective des
a-oléfines, Xavier DESERT, 2022
3/16
Q12. Justifier, par l'écriture de formes mésomères limites, la relative
stabilité de l'anion
cyclopentadiényle Cp®, de formule Cs HS.
Le mécanisme simplifié de cette réaction de polymérisation par coordination du
propylène est
proposé figure 2. L'enchaînement des éfapes il et lin), avec n = 1, 2, 3...,
conduit à la croissance
de chaîne de la macromolécule de polypropylène. Une étape de terminaison
(précisée
ultérieurement et non représentée figure 2) conduit à la macromolécule de
polypropylène.
| 1Q
e ® _/ _ _ Q X
- X
| Cpa2rX ---- | Cp, | CL Cp22rX ---- Cpozr À
étape i étape ii, ( étape ili(1)
LOU \- ro r--
étape Il:
_-- A Re -- 1 J® [-- ,10
COMPIEXES CpoZr Cp,2r LT Cpozr À
à représenter .e ' se A us
pe Iil,3) étape Ii,3 étape Il)
Figure 2 - Mécanisme simplifié de la polymérisation par coordination du
propylène
Q13. Représenter les deux complexes susceptibles d'être formés à l'issue de
l'étape ill du
mécanisme simplifié de la réaction de polymérisation.
On suppose que l'enchaînement des motifs est celui observé lors des étapes iily
du mécanisme
représenté figure 2. Une étape de terminaison possible pour cette réaction de
polymérisation par
coordination du propylène est une G-élimination (ou élimination-1,2) non
réductrice, conduisant à
une macromolécule de polypropylène.
Q14. Représenter la macromolécule de polypropylène obtenue à l'issue de l'étape
de
B-élimination (ou élimination-1,2) non réductrice.
Partie Il - Le dioxyde de zirconium, co-catalyseur dans la synthèse du
méthanol
1.1 - Étude thermodynamique de la synthèse du méthanol
Le dioxyde de zirconium ZrO: ou zircone, est considéré, au même titre que le
charbon solide C{s),
comme un support stable de différents catalyseurs métalliques'* et permet une
dispersion optimale
des métaux déposés. La zircone est ainsi utilisée, en tant que co-catalyseur
dans la réaction (1),
transformant en phase gazeuse le dioxyde de carbone en méthanol. L'oxyde de
zinc ZnO et le cuivre
métallique Cu solides sont les catalyseurs de la réaction (1), modélisée par
l'équation-bilan
ci-dessous :
CO2(g) + 3 H2(g) = CH3OH(g) + H20(g) (1)
2? Thèse, Développement d'un procédé de synthèse de méthanol à partir de CO et
H2, Sofiane ARAB, 2018
$ Thèse, Hydrogénation catalytique de CO2 en méthanol en lit fixe sous
chauffage conventionnel et sous plasma à DBD,
Maxwell Josias QUEZADA FELIZ, 2020
4/16
Q15.
Q16.
Q17.
Q18.
Déterminer la variance d'un système physico-chimique siège de la réaction (1).
Que devient
cette valeur si le dioxyde de carbone et le dihydrogène sont initialement
introduits dans le
réacteur dans un rapport de quantité de matière 1/3 (proportion
stwoechiométrique de la
réaction (1)) ?
Calculer, à 300 K, les valeurs de l'enthalpie standard AH, et de l'entropie
standard AS4
de la réaction (1). Commenter les signes de ces valeurs.
Calculer, à 300 K, la valeur de l'enthalpie libre standard AG, de la réaction
(1). Commenter.
Définir le rendement R en méthanol formé au cours de la réaction (1). Exprimer
la constante
d'équilibre Ka) de la réaction (1) en fonction de R, le dioxyde de carbone et
le dihydrogène
étant initialement introduits dans le réacteur dans un rapport de quantité de
matière 1/3.
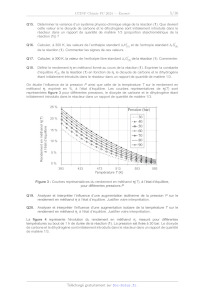
On étudie l'influence de la pression P ainsi que celle de la température 7 sur
le rendement en
méthanol R, exprimé en %, à l'état d'équilibre. Les courbes représentatives de
R(7) sont
représentées figure 3 pour différentes pressions, le dioxyde de carbone et le
dihydrogène étant
initialement introduits dans le réacteur dans un rapport de quantité de matière
1/3.
Q19.
Q20.
25 -
Pression (bar)
F 20 % "730
Fes - 0- 40
SE 15 % ---- 60
É D s | --e-- 70
S © 10% L
+
oe ©
ST 5%
TD
C
DO 2
SSSR SSL RE -----"
0 % Trot =.
393 433 473 513 553 593
Température T (K)
Figure 3 - Courbes représentatives du rendement en méthanol R(T), à l'état
d'équilibre,
pour différentes pressions P
Analyser et interpréter l'influence d'une augmentation isotherme de la pression
P sur le
rendement en méthanol R à l'état d'équilibre. Justifier votre interprétation.
Analyser et interpréter l'influence d'une augmentation isobare de la
température 7 sur le
rendement en méthanol R, à l'état d'équilibre. Justifier votre interprétation.
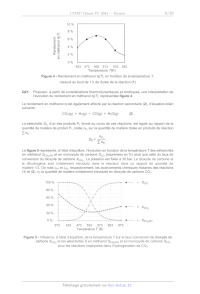
La figure 4 représente l'évolution du rendement en méthanol R, mesuré pour
différentes
températures au bout de 1 h de durée de la réaction (1). La pression est fixée
à 30 bar. Le dioxyde
de carbone et le dihydrogène sont initialement introduits dans le réacteur dans
un rapport de quantité
de matière 1/3.
5/16
10 %
8 %
6 %
4%
Rendement
en méthanol R(T)
2 D
0 %
453 473 493 513 533 553
Température T{K)
Figure 4 - Rendement en méthanol R(T), en fonction de la température 7,
mesuré au bout de 1 h de durée de la réaction (1)
Q21. Proposer, à partir de considérations thermodynamiques et cinétiques, une
interprétation de
l'évolution du rendement en méthanol R(T), représentée figure 4.
Le rendement en méthanol R est également affecté par la réaction secondaire
(2), d'équation-bilan
suivante :
CO:(g) + H2(g) = CO(g) + H20(g) (2)
La sélectivité SP, d'un des produits Pi, formé au cours de ces réactions, est
égale au rapport de la
quantité de matière de produit P;, notée n}. sur la quantité de matière totale
en produits de réaction
2 PP, :
_ MP,
P;--
2 MP,
La figure 5 représente, à l'état d'équilibre, l'évolution en fonction de la
température T des sélectivités
en méthanol ScH,on et en monoxyde de carbone S , > RTS 3 +
? 9
2 sk 0
Couplage de Stille TH Br
|
IN
ICO
Figure 8 - Schéma rétrosynthétique de la synthèse du composé 1
# Georgina A. Holloway, Helmut M. Hügel, and Mark A. Rizzacasa, J. Org. Chem.,
2003, 68, 2200-2204
9/16
1 - Structure du (-)-salicylihalamide A
Q26.
(--)-salicylihalamides A et B.
Q27.
C15 du (--)-salicylihalamide A.
2 - Réaction de couplage de Stille
Nommer les quatre groupes fonctionnels, encadrés figure 7 dans les
représentations des
Déterminer, en justifiant la réponse, le stéréodescripteur des centres
stéréogènes C13 et
La réaction de couplage de Stille utilise différents dérivés du palladium dont
le diacétate de palladium
Pd(OAc}h, l'anion acétate étant noté AcO® (ou éthanoate de formule CH3COO®). Le
cycle
catalytique de la réaction de couplage de Stille, entre un vinylstannane, noté
RCH=CHSnBu3, avec
Bu le groupe butyle, et un dérivé bromé, noté R'-Br, R et R' désignant des
groupes alkyles, est
présenté figure 9.
Pd(OAc)
PPh:
Ph = CH
étape 0
\
Pd(PPh3)2 R'--Br
(0)
étape d étape a
Ph;P R'
N2 7
PR
Br PPh;
Figure 9 - Cycle catalytique de la réaction de couplage de Stille
Q28.
Q29.
palladium Pd(OAc)z.
Q30.
composé obtenu lors de l'étape d.
Indiquer la nature des étapes a et d du cycle catalytique de la réaction de
Stille. Justifier.
Identifier le catalyseur de la réaction de couplage de Stille. Préciser le rôle
du diacétate de
Représenter, en utilisant les notations R et R' et sans tenir compte de la
stéréochimie, le
Q31. Écrire, à partir du cycle catalytique, l''équation-bilan modélisant la
réaction de couplage de
Stille.
10/16
La réaction de couplage de Stille, entre le vinylstananne 2 et le dérivé bromé
3, conduit au composé 4
selon le schéma présenté figure 10 :
O couplage de
D.
a
gK © Stille
Figure 10 - Réaction de couplage de Stille
Q32. Représenter la formule topologique du vinyistannane 2 permettant la
formation du composé 4
à partir de 3, en précisant notamment la structure du groupe R.
3 - Préparation du composé 11, précurseur du vinylstannane 2
Le composé 11, précurseur du vinyistannane 2, est préparé à partir de
l'aldéhyde 5 selon la
séquence réactionnelle présentée figure 11 :
OMe
PMP
O O7 "O
AC 1) BU4NF, THF = 1) O3 O O
# > Tores -- A on MOT
2) Me 2) NaBH4 HO
5 6 7 ve g
PMP
x 1) TsCI, pyridine O © bIBA-H BMPO > BMPO OH
-- ZT
2) --MgBr Me éd Me Me
9 10 11
précurseur du vinylstannane 2
Figure 11 - Synthèse du composé 11
La transformation 5 -- 6 utilise, entre autres réactifs, l'allylborane de
représentation topologique
suivante :
Me
BR
: 12
Figure 12 - Représentation de l'allylborane
11/16
L'allylborane est intermédiairement transformé en carbanion avant de réagir
avec l'aldéhyde 5.
Q33. Identifier, en justifiant votre réponse, les protons à caractère acide de
l'allylborane.
Q34. Quelle est la nature de la sélectivité observée lors de la transformation
5 -- 6 ?
L'action de sels de fluorure, tels que le fluorure de potassium KF ou le
fluorure de
tétrabutylammonium BU4NF, permet de transformer un éther de silyle R-OTBS en
alcool R-OH
(étape 1 de la transformation 6 -- 7).
Q35. Représenter le composé 6° obtenu par action de BUNF sur le composé 6.
Proposer des
conditions opératoires optimales (réactifs, montage et solvant) pour former le
composé 7 à
partir de 6' (étape 2 de la transformation 6 -- 7).
Q36. Proposer, en fonction des conditions opératoires retenues, un mécanisme
pour la
transformation 6° -- 7.
Sous l'action de l'ozone O3, suivie de celle de NaBH4, le composé 7 est
transformé en alcool 8.
Q37. L'ozone est-il polaire ? Justifier.
Le composé 8 est ensuite successivement traité par le chlorure de tosyle TsCI,
en présence de
pyridine, puis par le bromure d'acétylure de magnésium HC=C-MgBr pour obtenir
le composé 9. Le
traitement de ce dernier composé par le DIBAI-H conduit alors à l'alcyne
terminal 10 (réaction non
étudiée). Ce dernier est finalement transformé, selon une séquence
réactionnelle à préciser, en
précurseur 11 du vinylstannane 2.
Q38. Quel est l'intérêt de transformer le composé 8 avec le chlorure de tosyle
TsCI en présence
de pyridine ? Représenter le composé 8° alors obtenu.
Q39. Proposer, en s'aidant des ordres de grandeurs de constante d'acidité
fournis dans les
données, des réactifs à partir desquels le bromure d'acétylure de magnésium
HC=C---MgBr
peut être formé.
Q40. Proposer une séquence réactionnelle permettant la transformation de 10 en
précurseur 11
du vinylstannane 2. Quels seraient les inconvénients d'une telle séquence ?
4 - Préparation du dérivé bromé 3
Le dérivé bromé 3 a été préparé à partir de l'acide 12 selon la séquence
réactionnelle suivante :
OH O O
propanone
COH soc, O NBS 4
Me DMAP Me peroxyde 5°
12 13 de benzoyle
Figure 13 - Préparation du dérivé bromé 3
12716
Le spectre infrarouge du composé 3 présente, entre autres, deux bandes
caractéristiques à
1 748 cm! et 1 608 cm.
Q41. Atiribuer les bandes observées en infrarouge.
Le spectre RMN 'H du composé 3, enregistré à 500 MHz dans le chloroforme
deutéré (CDCI),
présente les signaux répertoriés dans le tableau 1 suivant :
déplacement chimique à (ppm) multiplicité intégration relative
1,69 singulet 6H
2,67 singulet 2H
6,79 doublet, J = 8,0 Hz 1H
6,91 doublet, J = 8,0 Hz 1H
7,37 triplet, J = 8,0 Hz 1H
Tableau 1 - Signaux du spectre RMN 'H du composé 3
Q42. Attribuer aux protons correspondants les différents signaux du spectre RMN
'H. Pour
l'attribution des signaux du spectre RMN 'H, prenez soin de présenter votre
réponse sous
forme de tableau en conservant pour les atomes de carbone la numérotation
adoptée
figure 13 pour le composé 3.
On suppose que le chlorure de thionyle SOC: permet de transformer uniquement
l'acide
carboxylique 12 en chlorure d'acyle correspondant. La DMAP agit alors en tant
que base et la
propanone en tant qu'électrophile.
Q43. Comparer la réactivité électrophile de l'acide carboxylique 12 à celle du
chlorure d'acyle
correspondant. Proposer un mécanisme pour la formation du composé 13 à partir
du chlorure
d'acyle issu de 12.
Il est possible d'utiliser directement du dibrome au lieu du NBS, donneur
d'atomes de brome, pour
réaliser la transformation 13 -- 3 dont le mécanisme réactionnel est proposé
ci-dessous. On se
place alors sous irradiation lumineuse, à une longueur d'onde bien
particulière, pour favoriser la
formation d'atomes de brome Br' par rupture homolytique de la liaison Br-Br
lors de l'étape
renversable (1). Le " " " représente un électron de valence célibataire de
l'atome de brome Br° ou
du radical R° :
Br e 2 Br° (1)
kK
Br + R-H 5 H-Br + R° (2)
e k e
R + Br-Br -- R-Br + Br (3)
Q44. Déterminer, en exploitant les valeurs d'énergie de liaison données en fin
de problème, un
ordre de grandeur de la longueur d'onde à laquelle il conviendrait de se placer
pour former,
lors de l'étape (1), des atomes de brome Br.
Q45. Établir, à partir du mécanisme réactionnel proposé et en appliquant l'AEQS
aux atomes de
brome Br" et aux radicaux R', la loi de vitesse de cette réaction de bromation.
Q46. Expliquer pourquoi, au laboratoire, l'usage du dibrome est limité et
pourquoi l'utilisation du
NBS lui est préférée.
13/16
5 - Macrolactonisation et fonctionnalisation de la chaîne latérale du composé 1
Le composé 4, issu de la réaction de couplage de Stille est ensuite transformé
en composé 1, selon
une réaction de macrolactonisation réalisée sous l'action de NaH dans le THF
figure 14. La
macrolactonisation est favorisée par une dilution élevée. Le composé 1 est
alors obtenu après une
hydrolyse acide.
OPMB 4) NaH, THF
9 Me 2) hydrolyse acide
IB
Figure 14 - Macrolactonisation
Q47. Expliquer le rôle du NaH dans la réaction de macrolactonisation réalisée
sur le composé 4.
Justifier que cette réaction soit réalisée à forte dilution.
Q48. Proposer un mécanisme réactionnel pour la formation du composé 1 à partir
de 4.
Le composé 1 est ensuite traité par le triflate de triisopropylsilyle TIPSOTf
pour obtenir 14. On
précise que l'anion triflate TfO® a pour formule CF; SOS. La chaîne latérale du
composé 14 est
fonctionnalisée, selon des conditions opératoires à préciser, afin de former
l'alcool 15 représenté
figure 15 :
TIPSOTF
D.
La
|
Figure 15 - Formation de l'alcool 15
Q49. Quel est l'intérêt de la transformation 1 -- 14 ? Pourquoi utiliser le
triflate de triisopropylsilyle
TIPSOTf au lieu du chlorure correspondant TIPSCI ?
Q50. Proposer des conditions opératoires adéquates pour réaliser la
transformation 14 -- 15.
14716
Données relatives au problème 2
Constante de Planck : h = 6,6-10-% J:s
Célérité de la lumière : c = 3,0:108 m:s!
Nombre d'Avogadro : NA = 6,0:10% mor!
Numéros atomiques Z et électronégativités 7 de Pauling
Élément H C O F Si CI
Z 1 6 8 9 14 17
% 2,20 2,55 3,44 3,98 1,90 3,16
Formules topologiques de groupes fonctionnels désignés par leur acronyme
PMB ou P TBS PMP TIPS
para-méthoxybenzyle | tert-butyldiméthylsilyle | para-méthoxyphényle
trisopropylsilyle
Me Me Me
-H0{ )oMe -Si--C- Me 7 )oMe TSI CH
Me
Me Me - 73
Formules PRO ratee de certains composés désignés par leur acronyme ou leur nom
» : ds Ce 0.
O
d
pyridine DMAP Leone THF rousse tosyle
Énergies de liaison
Liaison Br-Br C-Br C-H C-C
Energie (kKJ-mol) 190 280 415 350
Valeurs de déplacements chimiques 6 du proton en RMN 'H
Proton H | -CH-C- | -CH-C=C- | H-C=C- | -CH-C=O | -CH-OR | -CH=C- | -CH=O
ô(ppm) 10,9---1,3) 1,6-2,5 | 1,8---53,1 | 2,0 -3,0 | 3,3 ---3,7 | 4,5 -- 6,0 |
9,5 -- 10,0
Nombres d'onde o de vibration d'élongation de quelques liaisons en infrarouge
Liaison OH CH C=C C=O
6 (cm!) 3 300 -- 3 600 2910 --- 2970 1 580 -- 1 620 1 710 -- 1 750
Oxydants couramment utilisés en chimie organique
CrO3, pyridine H2CrO:, H2SO4, acétone
Oxydation des alcools primaires en aldéhydes | Oxydation des alcools primaires
en acides
carboxyliques
Oxydation des alcools secondaires en cétones | Oxydation des alcools
secondaires en cétone
15/16
Ordre de grandeurs de constantes d'acidité (supposées indépendantes de la
température ;
les valeurs > 14 sont extrapolées)
Couple acido-basique pKa
Acide carboxylique RCO-H(aq) / RCOS (aq) 3--9
4-diméthylaminepyridinium CzH:19N2H% (aq)/DMAP(aq) 10,1
Phénol CéH5OH(aq)/CsH:5O° (aq) 10
Alcool ROH/R° 16-18
Aldéhyde/cétone R'R:CHCORS/RTR2CCOR*E - 22
Alcyne R-C=CH/R-C=C® - 25
H,/H° 35
Amine [(CH3)}>CHINH/[(CHs3)>CHIN© 36
RH/ RMgX 40 -- 44
R, R', R2, R* désignant des groupes alkyles, X un halogène.
Données relatives à certaines espèces chimiques*
Dibrome
Formule brute Br
Masse molaire 159,8 g-mol"!
Propriétés physiques
Température de fusion --/,2 °C
Température d'ébullition 58,8 °C
Densité à 20 °C 3,12
Pression de vapeur saturante à 20 °C 23,3 KPa*
Mentions de danger H314 Provoque de graves brûlures de la peau et de
graves lésions des yeux
PA H330 Mortel par inhalation
& L > H400 Très toxique pour les organismes aquatiques
N-bromosuccinimide
Formule brute C4H4BrNO>2
Masse molaire 177,9 gmol"
Propriétés physiques
Température de fusion 175 °C
Température d'ébullition 221 °C
Pression de vapeur saturante à 20 °C Donnée non disponible
Mentions de danger H272 Peut aggraver un incendie ; comburant.
H290 Peut être corrosif pour les métaux.
H315 Provoque une irritation cutanée.
> ë H317 Peut provoquer une allergie cutanée.
H319 Provoque une sévère irritation des yeux.
H341 Susceptible d'induire des anomalies génétiques.
H400 Très toxique pour les organismes aquatiques.
H314 Provoque de graves brûlures de la peau et de
graves lésions des yeux
H330 Mortel par inhalation
H400 Très toxique pour les organismes aquatiques
FIN
° Extraites du site du fournisseur de produits chimiques Sigma-Aldrich.
16/16
NATIONALE - 241101 - D'après documents fournis
IMPRIMERIE