CCINP Chimie 2 PC 2002
| Thème de l'épreuve | Chimie des solutions, généralités sur les courbes intensité-potentiel, synthèse d'un précurseur de la progestérone |
| Principaux outils utilisés | courbes intensité-potentiel, réactions acido-basiques, chimie organique |
| Mots clefs | précurseur de la progestérone, ultramicroélectrode, stress oxydatif, exocytose d'adrénaline |
Corrigé
:👈 gratuite pour tous les corrigés si tu crées un compte
👈 l'accès aux indications de tous les corrigés ne coûte que 1 € ⬅ clique ici
👈 gratuite pour tous les corrigés si tu crées un compte
- - - - - - - - - - - - - - - - - - - - - - - - - - -
👈 gratuite pour ce corrigé si tu crées un compte
- - - - - - - - - - - - -
Énoncé complet
(télécharger le PDF)









Énoncé obtenu par reconnaissance optique des caractères
SESSION 2002 A PCCH2 10
(ONCOURS (OMMUNS POIYIECHNIOUES
EPREUVE SPECIFIQUE -- FILIERE PC
CHIMIE 2
Durée : 4 heures
Les calculatrices sont interdites.
N.B. : Le candidat attachera la plus grande importance à la clarté, & la
précision et à la concision de la
rédaction.
Si un candidat est amené à repérer ce qui peut lui sembler être une erreur
d'énoncé, il le signalera sur sa
copie et devra poursuivre sa composition en expliquant les raisons des
initiatives qu'il a été amené à
prendre.
Partie A
Les ultramicroélectrodes, de dimension au moins micrométrique ou encore plus
petite, constituent
une classe à part et permettent en particulier d'étudier certains processus
fondamentaux de la
biologie. Cet aspect est développé dans le problème à partir de deux exemples :
-la caractérisation d'une réponse d'un stress oxydatif au niveau d'une seule
cellule vivante
--l'exocytose vésiculaire d'adrénaline par les cellules chromaffines surrénales.
La procédure la plus commode pour la réalisation d'une ultramicroélectrode
disque--plan, de rayon
r, consiste à introduire dans la partie effilée d'un tube de verre (matière
inerte) un fil de platine
mince. On scelle ensuite l'ensemble en ramollissant le verre par léger
chauffage. On fait ensuite
apparaître le disque en coupant la pointe du capillaire, la surface plane étant
ensuite obtenue par
polissage. Ce type d'électrode est ensuite utilisé par exemple pour des mesures
in vitro tel qu'en 1--
3c (voir Figure 3).
AVERTISSEMENT :
Aucune connaissance sur les ultramicroélectrodes et les processus biologiques
étudiés n'est
nécessaire pour traiter ] 'ensemble du problème.
Certaines valeurs numériques exigées dans le problème pourront être obtenues à
l'issue de calculs
simplifiés.
Les différentes parties du problème sont largement indépendantes.
DONNEES à 298 K
. Constantes :
Faraday : F = 96500 C.mol'1 ; --I--{FT--ln10= 0,06 V ;
Constante d'Avogadro : NA = 6.1023 mol.L'1 ; Tt :=: 3
Tournez la page S.V.P.
. Potentiel standard (en volt) à 298 K et pH = 0 :
0-- Surtension anodique (en volt) sur Pt :
Îl(HzOz(aCl)/Ûz (EUR)) = + 094 ; Tl(H2O/Ûz (g)) = + 0,7 ;
. Surtension cathodique (en volt) sur Pt :
n(Oz(g)/HzOz(aq)) = - 0,4 ; n(Oz(g)/HzO) = -- 0,7 ;
. Constantes d'équilibre en solution aqueuse :
- Solubilité du chlorure d'argent :
AgCl(s> : Ag+ + Cl' KS] = [Ag+J.lc1--J=1o--w
- Constantes d'équilibre mettant en jeu l'ion Ni2+ :
- +
B= [N1HA ] : 10+7,0
.2+ -
Ni2+(aq) + HA°(aq) : Ni(HA)+(aq) [Nl ]-[HA ]
Ni(OH)g(S) : Ni2+(aq) + 2HO'(aq) K52 ={Ni2+].[OH--]Z =10--15,8
, . , . . . . . .2+
On neglzgera toute autre reactzon faisant intervenir ! 'zon Nl dans l'eau.
- Constantes d'acidité de l 'adrénaline, notée H 214 :
OH K3 : [H2A] ' [H+] : 10--8,7
HO [H3A+]
0 H K2 : [HA--L [H+] : 10_10,2
|'\1 [Hz/\]
HO CH3 [AZ--} [H+]
K1 : __ : 10--14,2
adrénaline H2A [HA--]
1-1
1--2
Généralités sur les courbes intensité de courant-potentiel (courbes
intensité-potentiel)
Le montage expérimental permettant d'établir les courbes intensité--potentiel
comporte en
général trois électrodes dont une électrode indicatrice inattaquable (appelée
également électrode
de travail), d'aire suffisamment petite pour que les quantités d'espèces
consommées soient
négligeables, plongée dans une solution contenant un couple Ox/Red échangeant n
Faraday par
mole, aux concentrations respectives [OX] et [Red], représenté par le processus
électrochimique
(l), de potentiel standard E OOx/Red :
Red (-- Ox + ne' (l)
_)
Le schéma d'un tel montage à trois électrodes (voir Figure 1) (comprenant un
potentiostat,
milliampèremètre, noté mA, un millivoltmètre, noté mV) est le suivant :
potentiostat
lnd : électrode indicatrice
Ref : électrode de référence
Aux : électrode auxiliaire ou contre
électrode
Aux lnd Ref
solution
Figure 1 : Montage à trois électrodes
I-1a Justifier que l'électrode Ag(s) | AgCl(s) ) KCl(aq) (l mol.L") est une
électrode de
référence. Déterminer son potentiel par rapport à l'électrode normale à
hydrogène.
l-1b Pourquoi ne doit--il pas passer de courant au travers de l'électrode de
référence ?
Indiquer les branches où l'intensité du courant est nulle ou quasi nulle.
Préciser la nature du métal constituant l'électrode indicatrice inattaquable.
I-1c Qu'appelle--t-on un système rapide ? un système lent ?
Donner l'allure des courbes i = f(E) correspondantes en rappelant la convention
habituellement choisie pour le signe de l'intensité du courant qui traverse.
Indiquer clairement la réaction se produisant à l'électrode indicatrice ayant
lieu pour
chaque portion de courbes.
I-ld Qu'observe--t-on en imposant à l'électrode indicatrice des potentiels
positifs très élevés
et négatifs très faibles en absence d'espèces autres que le solvant?
Modélisation
On se propose d'étudier dans cette question la relation existant entre
l'intensité i et la
concentration en réducteur Red, introduit seul en solution et appartenant au
système
électrochimique (l) considéré comme rapide. On applique à l'électrode
indicatrice un potentiel
supérieur au potentiel standard E°Ox/Red. Il s'établit alors un flux de
matière, JRed, qui
s'accompagne d'un courant d'intensité i proportionnel à ce flux. On adopte en
première
approximation un profil de concentration linéaire dans une couche de solution,
dite couche de
Tournez la page S.V.P.
I-3
dfiusion, d'épaisseur ôdif (voir Figure 2). On note [Redlsolution et
[REURd]électrode les
concentrations en réducteur, respectivement en solution et à proximité
immédiate de la surface
de l'électrode. On supposera dans cette question que la couche de diffusion est
de très faible
épaisseur et indépendante du temps (solution agitée ou électrode tournante).
[Red]
.............. [Red]solution
solution
[Redlé/ectrode X
ôdif distance à l'électrode
couche solution
de diffusion homogène
Figure 2 : Profil de concentration
Dans ces conditions et pour le système électrochimique (1), la relation entre
l'intensité i et le
flux JRed est :
i = -- n.F.A.JRed
avec A l'aire de l'électrode indicatrice.
__)
_,
I-2a En appliquant la première loi de F ick ( J = -- DRed.grad[Red]), donner
l'expression de
l'intensité i en fonction de [Red]......--... et [Red]électrode, D}... le
coefficient de diffusion de
l'espèce Red, A la surface de l'électrode et ôdif.
I-2b Lorsque le potentiel auquel est porté l'électrode indicatrice est
nettement supérieur au
potentiel standard E °Ox/Red, l'intensité tend vers une valeur limite, noté
il,-..., ce qui se
traduit par l'existence d'un palier sur la courbe intensité-potentiel.
Quelle est alors la valeur de la concentration à proximité immédiate de la
surface de
l'élEURth0dEUR, [RGd]électrode?
En déduire l'expression de il,--... pour une ultramicroélectrode disque-plan,
de rayon r.
Etude des ultramicroélectrodes disque-plan, de rayon r
En régime de diffusion convective stationnaire (solution agitée ou électrode
tournante), la
couche de diffusion est maintenue constante au cours du temps. Au contraire, en
régime de
diffusion pure (pas de convection « mécanique » en solution, ce qui est le cas
lors de mesure
in vitro), l'épaisseur de la couche de diffusion, ôdif, des espèces
électroactives, ici Red, seul
en solution, dépend de la distance parcourue par diffusion pour une molécule.
Pour une
expérience de durée t, cette distance est donnée par :
ôdif : 2DRed°t
On admet que :
0 si ôdif << a la dimension du rayon r, la couche de diffusion est approximativement plane ou linéaire ; 0 si ôdif >> à la dimension du rayon r, la taille de la couche de diffusion ne
pouvant pas
physiquement dépasser la dimension de l'électrode, la diffusion devient alors
sphérique et
son épaisseur ôdif est constante et approximativement égale à deux fois le
rayon r de
l'électrode. La courbe intensité--potentiel présente alors un palier comme dans
le cas I-2b.
On peut alors considérer dans ce cas que le volume de solution affecté par le
processus
électrochimique, nommé volume de solution sondée, est une demi--sphère partant
de la
surface de l'électrode et de rayon ôdif.
I-3a Avec une ultramicroélectrode de rayon 5 mn, (et un coefficient de
diffusion de l'espèce
considérée D}... = 10"5 cm2/s), quel est le temps de mesure au-delà duquel le
volume
sondé (couche de diffusion) est constant ?
I-3b Evaluer pour cette électrode le volume de solution sondée ? Conclusion.
I-3c On considère une ultramicroélectrode disque--plan de rayon 5 um distante
de 1 pm
d'une plaque de verre sur laquelle a été déposée une cellule vivante en
solution aqueuse
(voir Figure 3) :
matière inerte
solution
matière inerte
solution
cellule
ultramicroélectrode
plaque de verre
Figure 3 : Montage de mesure in vitro (l'échelle n 'est pas respectée)
Quel est approximativement le volume de solution sondée dans ce cas précis ?
Une cellule subissant par exemple un stress oxydatif (voir partie Il) libère
jusqu'à
10 millions de molécules électroactives.
Estimer alors la concentration à proximité immédiate de l'électrode.
Tournez la page S.V.P.
II - Etude du stress oxydatif d'une cellule
Une cellule vivante, placée en solution aqueuse de pH = 7 et saturée en
dioxygène Oz est
soumise à un stress << oxydatif >>. On suit la concentration en dioxygène et en
peroxyde
d'hydrogène, H202, produit par la cellule à la suite de ce stress à partir de
mesures
électrochimiques où les coefficients de diffusion de toutes les espèces sont du
même ordre de
grandeur. Ces dernières sont obtenues suite à la mise en oeuvre du montage
présenté à la
question I-3c. La << réponse >> de la cellule au stress oxydatif est
enregistrée à l'aide d'une
ultramicroélectrode polarisée soit à + 0,6 V, soit à -- 0,2 V, potentiels
mesurés par rapport à
une électrode Ag(s) | AgCl(s) | KCl(aq) (l mol.L'l). Le courant est mesuré en
picoAmpère,
pA, et ses variations en fonction du temps sont représentées sur les figures 4a
et 4b.
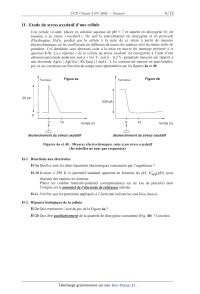
iamd/que Flgure 43 icathodique F'gure 4b
25 pA
200 pA
0
0 15 temps (8) 0 15 temps (5)
déclenchement du stress oxydatif déclenchement du stress oxydatif
Figures 4a et 4b : Mesures électrochimiques suite à un stress oxydatif
(les échelles ne sont pas respectées)
II-1 Réactions aux électrodes
II-1a Quelles sont les demi-équations électroniques concernées par l'expérience
'?
lI-1b Evaluer à 298 K le potentiel standard apparent en fonction du pH,
Eâpp(pH) pour
chacune des espèces en solution.
Placer les courbes intensité-potentiel correspondantes sur un axe de potentiel
dont
l'origine est le potentiel de l'électrode de rétérence utilisée.
II--1c Vérifier que les potentiels appliqués à l'électrode indicatrice sont
bien choisis.
II-2 Réponse biologique de la cellule
II-2a Que représente l'aire du pic de la Figure 4a ?
II-2b Que dire qualitativement de la quantité de dioxygène consommé (Fig. 4b) ?
Conclure.
III - Etude de l'exocytose d'adrénaline
L exocytose correspond à une éjection de neurotransmetteurs par suite d'une
stimulation de
la cellule. Ici nous allons nous intéresser à l' éjection de l' adrénaline H2A,
aisément détectable
par une technique électrochimique après stimulation de la cellule par des 1ons
N12+
Cette partie, indépendante des deux premières, porte sur l'étude des solutions
aqueuses
d'adrénaline en présence de sels de nickel Ni2+
Ill-1 Acido-basicité de l'adrénaline
lll-la--D'après la formule de l'adrénaline, quels sont les sites présentant en
solution aqueuse
des propriétés acides ou basiques ?
III--lb Sachant que la valeur de pK2 égale à 10,2 est associée à l'une des
fonctions phénol,
établir le diagramme de prédominance des espèces en fonction du pH.
Ill-lc Expliquer la différence d'acidité observée entre les deuxième et
troisième acidités.
III--2 Titrage d'une solution d'adrénaline par l'hydroxyde de sodium
Ill-Za Calculer le pH d'une solution aqueuse d'adrénaline à la concentration
0,1 mol.L'1
introduite sous la forme du sel H3A+,C1Ï
III-2b Peut--on titrer séparément par la soude les différentes acidités de
l'adrénaline ?
Ill-3 Titrage d'une solution d'adrénaline en présence de sels de nickel (Il)
Ill-3a Soit une solution S de H3A+,Cl+ à 0,1 mol.L'1 et de Niz+,2Cl+ à 0,1
mol.L'+. En faisant
l'hypothèse que le complexe NiHA+ se forme à partir de cette solution, quelle
serait la
valeur de pH de cette solution '?
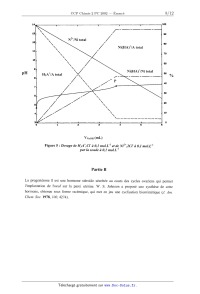
A l'aide d'un logiciel approprié la courbe de tirage de 10 mL de la solution S
par la soude
NaOH à 0,1 mol.L'1 a été simulée ainsi que le diagramme de distribution des
variations des
pourcentages de toutes les espèces solubles en quantité non négligeable
(pourcentages
rapportés à A total ou Ni total).
III--3b En exploitant la figure 5 (nature des espèces présentes, échelle des
abscisses, rythme
de variation des pourcentages):
. indiquer si l'hypothèse émise en III-- 3a est à retenir. Justifier votre
réponse.
. écrire la réaction de titrage par la soude de H3A+ en présence de Ni2
+jusqu'au
point P.
III-3c Quelle est la réaction au-delà du point P ?
Tournez la page S.V.P.
14 100
13 / 90
N2+/Ni total _
12 80
Ni(HA)VA total
11 70
10
60
° Ni(HA)*/Ni total 50
a ___-__..._
40
7 /
30
6
20
° / ,/ \\
l / \
\ :o
4 / '
/ , / \\ _____________
0
30 1 2 3 4 6 6
VNaOH (mL)
Figure 5 : Dosage de H 3A+,Cf à 0,1 mol.L'l et de Ni2+,2Cf à 0,1 mol.L"
par la soude à 0,1 mol.L'l
Partie B
%
La progestérone I est une hormone stéroïde séerétée au cours des cycles
ovariens qui permet
l'implantation de l'oeuf sur la paroi utérine. W. S. Johnson a proposé une
synthèse de cette
hormone, obtenue sous forme raeémique, qui met en jeu une cyclisation
biomimétique (J. Am.
Chem. Sac. 1978, 100, 4274).
I stéroïde : numérotation
I - Stéréochimie, spectroscopie infrarouge
La numérotation des carbones d'un stéroïde est rappelée ci-dessus.
I-1 Indiquer les carbones asymétriques de la progestérone I à l'aide d'un
astérisque.
I-2 Donner la configuration absolue des carbones 10 et 13 en la justifiant.
1--3 Les cycles B et C présentent une jonction trans. Représenter en
conformation chaise dans
l'espace deux cycles à six carbones accolés par une liaison C--C et présentant
cette même
stéréochimie. On figurera les liaisons C--H d'un des deux cycles en précisant
lesquelles sont axiales
(a) et lesquelles sont équatoriales (e).
I-4 La progestérone présente deux fonctions cétone, dont les vibrations de
valence sont observées
à 1670 et 1700 cm"1 en spectroscopie IR. Attribuer ces absorptions en
justifiant votre raisonnement.
II - Formation du cycle A
Le cycle A est formé par un processus << d'ouverture--fermeture » qui met en jeu des réactions très classiques. Le schéma ci-dessous résume ce processus. La structure des molécules a été simplifiée en remplaçant les cycles B, C et D par des groupements R1 et R2. CH3 ---R' 1.03 KOH 5% --------------> III ----> I
R2 2. Zn, AcOH MeOH
CH3
Il
Tournez la page S.V.P.
10
II-1 Représenter la structure du composé III.
II--2 Comment appelle--t-on la réaction de cyclisation de ce composé III en
composé I ?
II-3 Proposer un mécanisme pour cette cyclisation.
III -- Synthèse du précurseur de la progestérone, spectroscopie RMN 1H
Une des étapes--clé de la synthèse est une réaction de Wittig, qui permet
d'obtenir un composé VI
de configuration E. Les matières premières sont le dérivé iodé IV et l'aldéhyde
insaturé V.
fTÛ
CH} !
@@
IV V
CH3
III-1 L'aldéhyde V présente en particulier les signaux donnés dans le tableau
ci-dessous en
1 '
RMN H (spectre enregistré dans le chloroforme deutérié CDCI3 à 60 MHZ).
Attribuer ces signaux à l'aide des tables figurant en annexe et justifier la
multiplicité observée.
___---
___---
III-2 Rappeler comment préparer un alcène, à l'aide d'une réaction de Wittig, à
partir d'un
halogénure R3-CH2-I, de triphénylphosphine, d'un aldéhyde R4-CHO et de tout
autre réactif
nécessaire.
III--3 En déduire la structure du composé VI.
III-4 Le composé IV présente des fonctions cétone qui ont été protégées en vue
de la réaction de
Wittig. Expliquer pourquoi ces protections sont nécessaires ?
ll
III-5 Comment effectue-t--on la protection d'une fonction cétone ? On précisera
le réactif et le
catalyseur nécessaires.
III-6 Le composé VI est traité en milieu hydroorganique acide afin de
déprotéger les fonctions
cétone. Donner le mécanisme de déprotection d'une fonction cétone.
III--7 Donner la structure du produit VII ainsi obtenu à partir de VI.
IV -- Cyclisation biomimétique sur un modèle
Johnson a tout d'abord étudié la cyclisation sur le diènynol VIII qui conduit
par traitement dans le
pentane avec un excès d'acide méthanoïque (système biphasique eau / solvant,
agitation 15 minutes
à température ambiante) au bicycle IX (J. Am. Chem. Sac. 1971, 93, 4330).
IV-1 L'alcool tertiaire VIII fournit aisément un carbocation dans le milieu
acide considéré. Ecrire
ce carbocation et justifier sa stabilité.
cn3
cn3
H3C
CH3
H
CH3 CH3 O
VIII IX
IV-2 Ce premier carbocation est un électrophile qui peut conduire à la
formation de deux nouveaux
carbocations en s'additionnant sur la double liaison "centrale". Représenter
ces deux cations et
discuter leur stabilité relative.
IV--3 Le carbocation le plus stable s'additionne ensuite sur la triple liaison.
Proposer en conséquence
un mécanisme pour la formation de IX .
V - Formation de la progestérone
Le processus précédent, d'additions électrophiles "en cascade", a été appliqué
au composé X selon
le schéma suivant :
Tournez la page S.V.P.
12
H3C
CH3 o .
/ \;O
H3C H
X XI
V-1 Proposer un mécanisme de cyclisation de X en précurseur XI de la
progestérone.
V-2 Comment peut--on transformer le groupement porté par le carbone 17 en
groupement
acéter ?
V-3 Proposer en conséquence un schéma de synthèse de la progestérone à partir
de XI.
Annexe 1 : déplacements chimiques caractéristiques
(les atomes concernés sont figurés en gras)
t .es d'atomes d'h dro_ène domaine de déo1acement chimi-ue . om
R-CH3
R-CH2-R'
RCH=CR'CH3
R2C=CHR'
R--E--CH3
R-CHO
Annexe 2 : constantes de couplages
H-C--C-H
H-C-C=C-H
Fin de l'énoncé