CCINP Chimie 2 PC 2003
| Thème de l'épreuve | Séparation de l'américium en sels fondus LiCl–KCl. Synthèse du bulnésol. |
| Principaux outils utilisés | diagrammes binaires, diagrammes potentiel-pH, cristallographie, solutions non aqueuses, chimie organique |
| Mots clefs | bulnésol |
Corrigé
:👈 gratuite pour tous les corrigés si tu crées un compte
👈 l'accès aux indications de tous les corrigés ne coûte que 1 € ⬅ clique ici
👈 gratuite pour tous les corrigés si tu crées un compte
- - - - - - - - - - - - -
👈 gratuite pour ce corrigé si tu crées un compte
- - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - -
Énoncé complet
(télécharger le PDF)







Énoncé obtenu par reconnaissance optique des caractères
SESSION 2003 PCCH2 1 0
A
CONCOURS (OMMUNS POIYÏECHNIOUES
EPREUVE SPECIFIQUE - FILIERE PC .
CHIMIE 2
Durée : 4 heures
Les calculatrices sont autorisées
N.B. : Si un candidat est amené à repérer ce qui peut lui sembler être une
erreur d'énoncé, il le
signalera sur sa copie et devra poursuivre sa composition en expliquant les
raisons des initiatives
qu 'il a été amené à prendre.
Partie A
AVERTISSEMENT : Aucune connaissance sur la chimie des sels fondus et celle des
lanthanides
n 'est nécessaire pour traiter ce problème.
Les techniques de séparation des radionucléides présents dans le combustible
nucléaire usé
privilégient les procédés hydrométallurgiques. Toutefois d'autres procédés sont
en cours d'étude,
notamment en milieux sels fondus à haute température. Ces milieux présentent de
nombreux
avantages : minimum d'opérations menées sur des solutions concentrées,
recyclage des matériaux
en vue d'une réutilisation dans le cycle du combustible nucléaire, bonne
résistance des milieux
fondus à l'irradiation permettant ainsi de traiter des matériaux peu refroidis,
absence de
modérateurs de neutrons . ..
Les sels fondus constituent des solvants particuliers, considérés comme des
solvants ionisés, dans
lesquels il est possible de dissoudre aisément des composés inorganiques et de
travailler à des
températures élevées. Il s'agit souvent de mélange de sels ioniques :
LiCl-KCI ; NaCl-KC] ; LiNO3 --KNO3
Les activités des ions constituant le sel fondu (par exemple Li+, K+, C1' pour
le mélange de sels
LiCl--KCl) sont égales à 1. Pour les autres espèces dissoutes notées Ai, les
activités, a Ai , seront
assimilées au rapport :
avec m A- la molalité de l'espèce Ai dissoute et m° la molalité standard prise
à 1 molkg'1
1 .
DONNEES
. Rayons ioniques en pm :
__"--
0 Masse atomique :
MCI = 35,5 g-mol'1 ; MK = 39,1 g-mol'1 ; MU = 6,9 g--mol'1
. Températures de fusion sous 1 bar :
ng1 = 883K; T{gg, = 1043K
. Constantes :
Faraday : F = 96500 C-mol'1 ; R = 8,314 J-K".mol'1
I -- Etude préliminaire : les sels fondus
1 -- Etude cristallographique des solides ioniques LiCl et KC]
a -- A partir des données, quel type de réseau cristallin, à maille cubique,
peut--on envisager pour
LiCl '? Représenter la maille élémentaire de LiCl.
b - KC] a une structure cristalline identique à celle de LiCl : est--ce
compatible avec les données '?
Justifier.
c - Est--il a priori possible d'avoir une miscibilité partielle à l'état solide
de KC] dans LiCl ou
l'inverse ?
2 -- Etude du mélange binaire liquide--solide LiCl--KCI
Le mélange binaire LiCl--KC1 donne un eutectique à T = 625 K, sous la pression
standard, pour une
composition de 55 % (en masse) en KC1. On supposera les deux solides non
miscibles et le mélange
liquide idéal. '
a -- Donner la composition en fraction molaire de KCl du mélange eutectique.
Quel est l'intérêt
d'utiliser un mélange de composition de l'eutectique ?
b - Donner l'allure du diagramme binaire liquide--solide isobare en fonction de
la fraction
molaire de KCl. Nommer les courbes. Quelles sont les espèces et leur état
physique dans les
différents domaines du diagramme ainsi que sur l'isotherme T = 625 K ?
c -- Comment ces diagrammes binaires sont--ils tracés expérimentalement ?
Détailler
succinctement.
d - Justifier l'existence d'une relation entre la température T et la fraction
molaire de KC] dans
le liquide, XL(T), lors de l'équilibre liquide--solide.
3 - Nature des espèces solvatées dans le se] fondu LiCl-KCl
Un composé mis en solution dans un sel fondu s'insère dans la structure ionique
de celui--ci. Tout
soluté se trouve ainsi soumis, comme avec les solvants moléculaires, au
phénomène de solvatation
par les espèces constitutives du se] fondu servant de solvant. En plus des
interactions de type
électrostatique, il se développe fréquemment des phénomènes de complexation. '
a -- Sous quelle(s) forme(S) peut-on trouver l'espèce Zn2+ en solution dans le
sel fondu LiCl--
KCl ?
b -- Quelle peut être la conséquenée des différents états de solvatation de ce
cation sur ses
propriétés d'oxydoréduction '? Justifier simplement votre réponse.
' Dans la suite du problème, on note Mn+ la forme solvate'e d'un cation
métallique M dans le sel
fondu LiCI--K Cl indépendamment de sa solvatation réelle.
Il - Oxoacidité et oxobasicité
L'anion oxyde OZ", présent dans de nombreux composés (oxydes métalliques,
oxoanions, eau. . .) est
extrêmement basique. Il existe à l'état « libre » en solution dans le sel fondu
LiCl--KCl, la formation
de LizO ou KzO étant notamment négligeable. Par analogie avec les réactions
acido--basiques de
Brônsted, il a été développé une systématique des réactions mettant en jeu OZ",
réactions
d'oxoacidîté, entre un oxoacide et une oxobase selon :
. 2-
<-- + oxobase oxoac1de O Les réactions d 'oxoacidité peuvent influer sur d'autres systèmes réactionnels, notamment d'échange d'électrons, et forment la partie essentielle de la chimie dans les sels fondus. 1 - Etude générale de l'oxobasicité a - A quel type de basicité appartient OZ" ? b - Avec quel composé peut--il réagir ? 2 - Exemple de couples 21 - Dans le cas du couple Mg2+/ MgO, quelle est l'espèce pouvant être qualifiée d'oxobase et d'oxoacide ? b - L'eau et l'alumine A1203 peuvent être considérées comme des amphotères d'oxoacidité. Sachant que dans le cas de l'eau, les différentes espèces sont H+, H20 et HO" alors que dans celui de l'alumine, il s'agit des composés AlOg', "Ale3 et AlO+, écrire les différents équilibres d'oxoacidité montrant le caractère amphotère de ces deux espèces. 3 - Mesure du niveau d'oxoacidité d'un se] fondu Afin de caractériser le niveau d'oxoacidité d'un sel fondu, on définit pOZ' : pOZ' = --log...(mÿ) avec mo" molalité des ions OZ" (en mol--kg") pOZ' peut être mesurée à partir d'électrodes appropriées telle que Pt / NiO(s) / Ni(s). a - Donner l'équation de l'équilibre électrochimique entre NiO(s) et Ni(s) dans le sel fondu. b -- La chaîne électrochimique, Pt / NiO(s) / Ni(s), constitue--t--elle une électrode indicatrice en ion OZ" '? Justifier. 4 - Dosage d'oxoacidité On dose à 743 K, dans le sel fondu LiCl-KCl, une solution de AlCl3 par une solution de Na2CO3, les espèces étant totalement dissociées en leurs ions constitutifs dans le sel fondu. On précise que (30? est une monooxobase forte. Dans les conditions du dosage, on admet que les seules formes de l'aluminium à considérer sont: Al3+, AIO+ et Ale3(s). On notera Kd et KS les constantes d'équilibre des réactions suivantes dans le sel fondu LiCl--KCl à 743 K : Kd A10+ ---->' A13+ + 02- (1)
K
A1203(S) ' S 2Al3+ + 302" (2)
_+
versé
y : initial
Courbe de dosage de Als+par le carbonate de sodium dans le sel fondu LiCl--KCI
a - Que signifie dans le cas des ions carbonate le terme de monooxobase forte ?
b -- Expliquer qualitativement le sens de variation de p02' au cours du dosage.
c -- Un exemple de courbe de dosage de Al3+ est donné ci-dessus. On y
représente p02' = f(y), y
étant le rapport du nombre de moles de carbonate de sodium versé sur le nombre
de moles '
d'ions Al3+ à doser. Ecrire l'équation--bilan ayant lieu en début de dosage.
Que se passe--t-il au point B ?
. - . initial . , . .
d" DOHIIEURÏ 1EURS EURXPÎÛSSIOHS de p02 en fOHCÏIOH de Kd , KS et m 3+ aux
pOIHÏS C&fâCÎÔÏISÎIC1UÔS
Al
initial
)
Al3+
A et B de la courbe de dosage, avec m molalité initiale de Al".
e - En déduire alors les valeurs numériques de Kd et KS , sachant que miniïl =
0,073 mol--kg'l.
Al
III - Etude du comportement de l'américium dans l'euteetigue LiCl-KCI à 743 K
1 - Diagramme de répartition de l'américium
Le diagramme de répartition de l'américium (III) dans le sel fondu LiCl-KCI à
743 K est
schématiquement représenté ci-après. Il présente 4 domaines principaux
correspondant aux espèces
Am", AmO+, AmOCl(s) et Am203(s) :_
Am3 +
AmOCl(s)
7-- AmO+ Am203(s)
-8 -7 -6 -5 -4 -3 -2 -1 o logmmAm3+
Diagramme de répartition de Am(III) dans le sel fondu LiCl--K Cl à 743 K
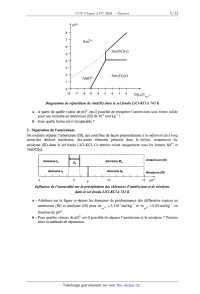
a - A partir de quelle valeur de p02' est-il possible de récupérer l'américium
sous forme solide
pour une molalité en américium (III) de 10'4 mol-kg"1 ?
b - Sous quelle forme est-il récupérable ?
2 - Séparation de l'américium
On souhaite séparer l'américium (III), qui contribue de façon prépondérante à
la radiotoxicité à long
terme des déchets nucléaires, des autres éléments présents dans le milieu,
notamment du
néodyme (III) dans le se] fondu LiChKCl. Ce dernier existe uniquement sous les
formes Nd3+ et
NdOCl(s).
omaine , . .
domaine |a " " domaine |||a Amencmm (III)
a
domaine lb : domaine llb Néodyme (...)
2-
0 5 7 10 15 pO
Influence de ! 'oxoacidité sur la précipitation des chlorures d 'américium et
de néodyme
dans le sel fondu LiCl--KCl à 743 K
a - Attribuer sur la figure ci-dessus les domaines de prédominance des
différentes espèces en
3+ =3,5-10_3mol-kg_1 et m =0,09 mol--kg] en
Am Nd
américium (III) et néodyme (III) pour m 3+
fonction de p02'.
'b - Pour quelles valeurs de p02' est-il possible de séparer l'américium et le
néodyme ? Préciser
alors la méthode de séparation.
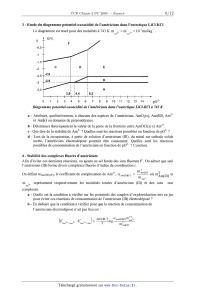
3 - Etude du diagramme potentiel--oxoacidité de l'américium dans l'eutectique
LiCl--KCI
Le diagramme est tracé pour des molalités à 743 K m 3+ : m % : 10--2mol-kg_l .
E(V)
E
: B
5 5 A
14,4 15,2
01234567891011121314 p02'
Diagramme potentiel--oxoacidîæ' de [ 'américium dans [ 'eutectique LiCl--KCI à
743 K
a - Attribuer, qualitativement, à chacune des espèces de l'américium, AmOz(s),
Am(lIl), Am2+
et Am(s) un domaine de prépondérance.
b -- Déterminer théoriquement la valeur de la pente de la frontière entre
AmOCl(s) et Am2+.
c -- Que dire de la stabilité de Am2+ ? Quelles sont les réactions possibles en
fonction de p02' ?
d - Lors de la récupération, à partir de solution d'américium (III), du métal
sur cathode solide
inerte, l'américium électrodéposé pourrait être consommé. Quelles sont les
réactions
possibles de consommation de l'américium en fonction de p02' ? Conclure.
4 - Stabilité des complexes fluorés d'américium
Afin d'éviter ces dernières réactions, on ajoute au sel fondu des ions fluorure
F'. On admet que seul
l'américium (III) forme divers complexes fluorés d'indice de coordination i .
T
m
, . . . 3+ _ Am(III) \ T
On defimt 0tAm o
50 %
Schéma 3
9 -- Ecrire les formules semi-développées des produits intermédiaires 2 et 3.
Donner le
mécanisme de formation de 2 et 3. Pourquoi 3 conduit--il directement au produit
d'élimination ?
Les dfiérentes réactions qui viennent d'être rappelées vont être utilisées dans
la synthèse du
bulne'sol.
Il - S nthèse du bulnésol : études réliminaires
1 - Combien le bulnésol possède--t--il de carbones asymétriques ? Donner leur
configuration
absolue à l'aide des règles de Cahn, Ingold et Prélog en justifiant.
Le B-cétoester 4 est traité par la méthylvinyl cétone en présence d'éthanolate
de sodium pour
fournir 5 (C14H2204) qui ne possède pas en infra--rouge d'absorption entre 3000
et 3500 cm"'.
C02Et
+ /Y .... 5
O 0 EtOH
Schéma 4
2 - Donner la formule semi-développée de 5.
Le composé 5 est soumis à une réaction d'aldolisation intramoléculaire suivie
de crotonisation en
milieu acide. Deux composés sont ainsi formés. Le produit majoritaire 6 (83%)
est une molécule
bicyclique "pontée" de formule brute (C14H2503). Le produit minoritaire 7,
isomère de 6, est aussi
une molécule bicyclique mais de type "non pontée".
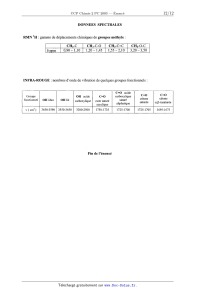
Données spectrales "_ » 1
partielles de 6 CH3 ; tnplet ; 1,28 ppm bande à 1740 cm'
CH3 ; singulet ; 1,69 ppm bande à 1710 cm'1
3 - Donner les formules semi--développées de 6 et 7.
Pour éliminer le produit 7, le mélange des composés 6 et 7 est soumis à une
réaction de
saponification qui conduit aux produits 8 (issu de 6) et 9 (issu de 7) qui sont
aisément séparés au
niveau des traitements.
Protocole expérimental : Le mélange de 6 et 7 est chaufi'é & reflux avec de la
potasse (KOH) en
excès dans le méthanol pendant 24 heures. Après refroidissement du mélange
réactionnel, celui--ci
est dilué avec de l'eau et extrait avec de l 'éther. La phase organique est
lavée avec un peu de
solution aqueuse de soude à 10 %, de l 'eau et enfin de l'eau saturée en NaCl.
Après séchage de la
phase organique sur MgSO4, filtration et évaporation sous vide, le résidu
obtenu fournit par
distillation sous vide, l'énone 9.
"..
9
Les phases aqueuses alcalines sont rassemblées et acidifiées & froid avec une
solution aqueuse
d'acide chlorhydrique pour fournir l'acide carboxylique 8 qui précipite.
4 - Ecrire le schéma réactionnel conduisant à 9. De quel type de réaction
s'agit--il ?
5 - Donner la formule semi-développée de 8. Pourquoi 6 ne subit-il pas le même
type
d'évolution que 7 ?
6 - Expliquer pourquoi les produits 8 et 9 sont facilement séparés lors des
traitements, en
reprenant chaque étape du mode opératoire et en précisant dans quelle phase se
trouvent les
différents composés et sous quelle forme.
111 -- Synthèse du {i)-bulnésol
Dans un premier temps la synthèse du (i)-bulnésol a été tentée à partir du
B--cétoester 10 substitué
en position C(5). Le traitement de 10 par l'éthanolate de sodium en présence de
méthylvinyl cétone
conduit quantitativement à la formation du composé 11 ne comportant pas de
système bicyclique.
Quand le composé 11 a été soumis à une réaction d'aldolisation--crotonisation
en milieu acide
sulfurique concentré, aucun produit n'a pu être isolé (schéma 5). Il semble que
dans ce cas, il se
forme des composés solubles dans l'eau qui sont perdus lors des traitements.
3 C02Et( /\n/
4
5 O aldolisation ?
NaOEt crotomsatuon
10
Schéma 5
Finalement, les auteurs ont pu réaliser la séquence réactionnelle souhaitée à
partir du composé 12,
analogue de 11 substitué par un chlore sur le noyau aromatique (schéma 6). Le
traitement de 12 par
l'éthanolate de sodium en présence de méthylvinyl cétone conduit
quantitativement à la formation
du composé 13 ne comportant pas de système bicyclique. La séquence
aldolisation-crotonisation en
milieu acide sulfurique concentré de 13 permet d'obtenir le composé bicyclique
souhaité 14
(C21H2504C1) de type I, avec un rendement de 66 %.
C02Et W
() H2804 cone
cu--©--o O 13 14
NaOEt aldolisation
12 crotonisation
Schéma 6
1 - Donner les formules semi--développées de 11, 13 et 14 sans tenir compte de
la stéréochimie.
2 - Proposer une explication au résultat observé lors du traitement de 11 en
milieu acide
sulfurique concentré.
3 -- Les auteurs ont pu résoudre ce problème en introduisant un groupement
chloré sur le noyau
aromatique. Quel est son rôle ? Le choix d'un chlore vous paraît-il judicieux '?
Le composé 14 a pu être transformé en 8 étapes en dérivé 15.
O
o=< 15 Le traitement de 15 par LiA1H4 permet d'obtenir 16 qui est soumis à une oxydation de Jones (CrO3, HZSO4) pour fournir 17 qui est ensuite estérifié par le diazométhane (CH2N2) ce qui conduit à 18. 4 -- Le diazométhane est habituellement représenté comme un hybride de résonance entre deux structures de Lewis. Ecrire ces deux structures. Proposer un mécanisme qui rende compte de la formation d'un ester RCOzMEUR à partir d'un acide carboxylique traité par CH2N2. 5 - Donner les formules semi--développées de 16, 17 et 18 en précisant leur stéréochimie. 6 - Deux étapes permettent de transformer 18 en bulnésol. Quelles sont-elles ? Préciser les réactifs nécessaires. Une autre synthèse totale du bulnésol a été réalisée par Heathcock et Ratcliffe (J. Am. Chem. Sac. 1971, 97, 1746), par réarrangement d'un squelette bicyclique. Un intermédiaire avancé de cette synthèse est le composé bicyclique 20 qui a été synthétisé à partir de la cétone bicyclique 19. 7 - Proposer une suite de réactions permettant de transformer 19 en 20. PhCHZO Schéma 7 DONNEES SPECTRALES RMN 1H : gamme de déplacements chimiques de groupes méthyle : _- CH3-C-O CH3 C=C 0,90--1,10 1,20--1,45 1,55-- INFRA-ROUGE : nombres d'onde de vibration de quelques groupes fonctionnels : C=O acide Groupe OH acide C=O carboxylique ç=0 Ct=O fonctionnel OH libre OH lié carboxylique ester saturé saturé CEURt0ne ce one , ac cli-ue aliphatique saturée a,B--1nsaturee 3650--3590 3550-3450 3200-2500 1750-1735 1725-1700 1725--1705 1695--1675 Fin de l'énoncé