CCINP Chimie 2 PC 2004
| Thème de l'épreuve | Chimie du verre de silice. Synthèse de spongianes. |
| Principaux outils utilisés | atomistique, cristallographie, diagrammes d'Ellingham, solutions aqueuses, thermochimie, cinétique chimique, chimie organique |
Corrigé
:👈 gratuite pour tous les corrigés si tu crées un compte
👈 l'accès aux indications de tous les corrigés ne coûte que 1 € ⬅ clique ici
👈 gratuite pour tous les corrigés si tu crées un compte
- - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - -
👈 gratuite pour ce corrigé si tu crées un compte
- -
Énoncé complet
(télécharger le PDF)








Rapport du jury
(télécharger le PDF)





Énoncé obtenu par reconnaissance optique des caractères
SESSION 2004 ' PCCH2 10
CONCOURS (0MMUNS POlYIECHNIOUES
EPREUVE SPECIFIQUE - FILIERE PC
CHIMIE 2
Durée : 4 heures
Les calculatrices sont autorisées
N.B. : Si un candidat est amené à repérer ce qui peut lui sembler être une
erreur d 'énoncé, il le
signalera sur sa copie et devra poursuivre sa composition en expliquant les
raisons des initiatives
qu 'il a été amené à prendre.
Partie A
Un déchet est dit « ultime » s'il « n 'est pas susceptible d'être traité dans
les conditions techniques
et économiques du moment, notamment par extraction de la part valorisable ou
par réduction de
son caractère polluant ou dangereux ». Parmi ces déchets se trouvent les
résidus d'épuration des
fumées d'incinérateurs d'ordures ménagères (ou REFIOM) représentant 400000
tonnes
annuellement produites en France.
Différentes solutions ont été retenues pour stabiliser ces déchets, dont la
cimentation, procédé
simple et peu coûteux, mais présentant l'inconvénient d'augmenter le volume de
ces déchets. La
vitrification constitue cependant une alternative intéressante. En effet, à la
suite d'un traitement
thermique éliminant l'eau et la matière organique, la fraction minérale de ces
déchets contient
essentiellement des oxydes de silicium et de différents métaux. Ces oxydes sont
la base de la
plupart des verres industriels ou naturels. On obtient alors une importante
réduction de volume, un
confinement dans une matrice très stable ainsi qu'une valorisation possible.
Ce problème aborde la chimie du verre de silice et son comportement à long
terme. Aucune
connaissance sur cette chimie n 'est nécessaire pour traiter ce problème.
DONNEES
. Effet d'écran exercé sur l'électron i de la couche @ par l'électron j de la
couche B, selon les
sous--couches respectives où se situent ces deux électrons :
écran de j j : couche j : couche
suri B 5 a-2 :
...
0 Masse atomique : Si : 28 g.mol'1
. Numéro atomique : Al : 13 ; Si : 14 ; Ca : 20.
. On rappelle que le rayon d'une orbitale atomique est pOA : n_{ - a() avec ao
: 53 pm,
Z
rayon de Bohr, n et Z* étant relatifs au groupe d'électrons de valence (avec
2," charge
effective perçue par un électron).
. Changement d'état : fusion du silicium :
T = 1683 K; A,usi,mH° = 46 kJ.moi"'
fusion
. Données thermodynamiques :
Composé Enthalpie standard de formation à Entropie standard absolue à 298 K,
298 K, A,H° (kimor') . ' . ")
- R= 8,31 J.K".mor'
1- Etude préliminaire : le silicium
I.1- Atomistique
I.1.1-- Donner la configuration électronique du silicium dans son état
fondamental en
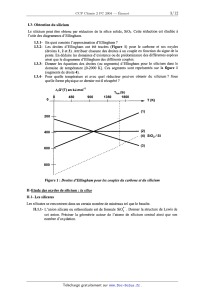
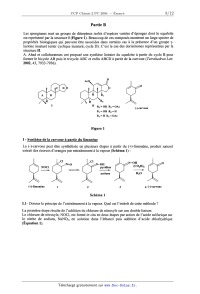
rappelant les << règles de construction». En déduire le nombre d'électrons de valence et la valence principale du silicium. I.1.2- La comparaison de certaines grandeurs physiques du silicium et d'un autre élément de sa colonne dans la classification périodique se traduit par : _m-- o. 120 Elément de la colonne du silicium 0,080 ' 2,5 I.1.2.a- Définir chacune de ces deux grandeurs physiques. I.1.2.b- Donner l'expression de l'électronégativité dans l'échelle de Mulliken. I.1.2.c- Attribuer qualitativement ces valeurs à un des éléments de la colonne du silicium. I.1.2.d- Justifier par un calcul adéquat à l'aide du modèle de Slater, l'évolution du rayon covalent pour le silicium et l'autre élément de sa colonne. I.2- Cristallographie du silicium I.2.1- Quelle est la nature des interactions entre les atomes de silicium '? I.2.2- Quel pourrait--être le type de réseau cristallin à maille cubique du silicium en fonction de la valence principale de cet atome '? Donner un schéma clair de cette maille cubique. Préciser le nombre d'atomes par maille. I.2.3-- Calculer le paramètre de maille en fonction du rayon du silicium ainsi que la compacité de cette maille cubique. I.2.4-- Préciser, en fonction du rayon du silicium, la taille maximale des lacunes tétraédriques et octaédriques, présentes dans cette maille élémentaire cubique du silicium. I.3- Obtention du silicium Le silicium peut être obtenu par réduction de la silice solide, Si02. Cette réduction est étudiée à l'aide des diagrammes d'Ellingham. 1.3.1- En quoi consiste l'approximation d'Ellingham ? 1.3.2- Les droites d'Ellingham ont été tracées (Figure 1) pour le carbone et ses oxydes (droites 1, 2 et 3). Attribuer chacune des droites à un couple en fonction du signe de la pente. En déduire les domaines d'existence ou de prédominance des différentes espèces ainsi que le diagramme d'Ellingham des différents couples. I.3.3- Donner les équations des droites (ou segments) d'Ellingham pour le silicium dans le domaine de température [0-2000 K]. Ces segments sont représentés sur la figure 1 (segments de droite 4). 1.3.4- Pour quelle température et avec quel réducteur peut--on obtenir du silicium ? Sous quelle forme physique ce dernier est--il récupéré '? A,G°(T) en kJ.mo|'1 Tfus(Si) 450 900 1350 1800 0 H... (1) 200 _; 400 --' : (2) ; (4) SiOZISi 3 600 ( ) 800 Figure 1 : Droites d 'Ellingham pour les couples du carbone et du silicium Il--Etude des oxydes de silicium : la silice 11.1- Les silicates Les silicates se rencontrent dans un certain nombre de minéraux tel que le basalte. II.1.1- L'anion silicate ou orthosilicate est de formule SiOÎ. Donner la structure de Lewis de cet anion. Préciser la géométrie autour de l'atome de silicium central ainsi que son nombre d'oxydation. II.1.2-- On rencontre fréquemment les silicates SiOÎ dans certains minéraux de formule brute Ca){Aly(Si0,)3 . Donner les valeurs de x et y. II.1.3-- Ecrire l'équation--bilan de la réaction entre le silicium et l'eau conduisant à la formation des anions silicate. Indiquer la variation des nombres d'oxydation des éléments impliqués dans la réaction. II.2- La silice La silice (à l'état de cristal ou de verre) est un assemblage d'unités tétraédriques de silicium et d'oxygène. Deux unités tétraédriques sont liées entre elles par un seul atome d'oxygène, nommé oxygène pontant. Elles sont notées [Si0...] (notation condensée) afin de rendre compte que l'atome de silicium est entouré de 4 atomes d'oxygène, ceux-ci se partageant entre deux unités. On sera amené à utiliser dans la suite du problème deux types de re}présentation (Figure 2) : -- une représentation géométrique d'une unité [SiO... 9 - une représentation développée de deux unités [SiO4/2] mettant en évidence l'atome d'oxygène pontant liant entre elles ces deux unités : représentation géométrique O oxy gene d'une unité [Si0...] . silicium ? ? représentation développée O--Si--O--Si--O de deux unités [Si0...} 5 + (') oxygène pontant Figure 2 : Représentation d'unités tétraédriques de silicium II.2.1- Préciser la stoechiométrie entre les atomes d'oxygène et de silicium dans une unité tétraédrique [Si04/2] de silice. Il.2.2-- Dans la silice cristal, six unités [SiO4/2] forment un motif régulier et cyclique, deux unités étant liées entre elles par un seul atome d'oxygène pontant. Représenter le cycle formé à l'aide de la représentation géométrique d'unité [Si0...]. II.2.3- Dans le verre de silice, le nombre d'unités [SiO...] du motif cyclique ne reste pas constant. Quel qualificatif utiliser pour un tel matériau '? II.3- Modificateurs et intermédiaires Certains oxydes métalliques, présents dans les REFIOM, par exemple les oxydes de sodium Na20 ou d'aluminium Ale3, ne peuvent pas seuls donner un matériau tel que le verre. Cependant, ajoutés à la silice, ils vont s'inclure dans sa structure et en modifier les propriétés, en affectant le caractère ionique ou covalent de certaines liaisons. II.3.1- La présence d'oxyde de sodium Na20, oxyde modficateur, entraîne la suppression d'un atome d'oxygène pontant et la formation de deux atomes d'oxygène non pontant. II.3.1.a-A l'aide de la représentation développée, donner la structure résultant de la transformation : 2 [SiOm] + Na20. Il.3.l.b-- Comment évolue le caractère des liaisons entre les deux unités tétraédriques [so...] ? 11.3.2-- L'oxyde d'aluminium Ale3, oxyde intermédiaire, a un rôle de formateur de réseau en présence d'oxyde modificateur Na20. Il transforme des atomes d'oxygène non pontant en atomes d'oxygène pontant. L'aluminium forme comme le silicium des unités tétraédriques avec l'oxygène. Il.3.2.a- Quelle est la charge globale d'une unité tétraédrique d'aluminium ? En déduire sa notation condensée. II.3.2.b-A l'aide de la représentation déveloîpée, donner une structure possible résultant de la transformation : (2 [SiO4/2 + Na20) + Ale3. Préciser les charges apparaissant sur certains atomes de la structure précédente. Justifier la stoechiométrîe de la transformation à l'aide de la notation condensée. Il.3.2.c- Comment évolue le caractère des liaisons entre les unités tétraédriques ? II.4- Etude thermodynamique de la transition vitreuse La vitrification d'un verre de silice se fait par refroidissement de mélanges d'oxydes de silice fondus. Il est fréquent de suivre l'évolution du volume molaire ou de la capacité thermique à pression constante du mélange en fonction de la température (Figure 3) et de repérer ainsi la température de transition vitreuse Tv généralement plus basse que la température de fusion Tf : vm cp T" T Tv T Figure 3 : Evolution du volume molaire Vm et de la capacité thermique molaire à pression constante Cp d'un verre en fonction de la température T II.4.1- Quelle est l'allure des courbes d'évolution du volume molaire V... et de la capacité thermique molaire à pression constante Cp lors de la fusion d'un cristal de silice en fonction de la température ? II.4.2- Représenter l'allure des courbes donnant l'évolution de l'enthalpie en fonction de la température T à pression constante pour un verre et un cristal de silice en supposant que lors de la transition vitreuse, l'enthalpie de changement d'état est quasi-nulle. 11.4.3- Y-a-t-il continuité ou discontinuité du potentiel chimique à la température de transition vitreuse d'un verre et de fusion d'un cristal ? III- Etude du comportement à long terme {CLT} Les essais de mise en solution aqueuse sont généralement menés à 363 K, température maximale qui ne devrait pas être dépassée pour un stockage au contact avec de l'eau. Les études de CLT visent à répondre principalement aux deux questions suivantes : . évolution des propriétés intrinsèques du verre ; . modélisation de la cinétique d'altération par l'eau. III.1-- Mécanisme de base de l'altération par l'eau Lorsque le verre de silice est mis en contact avec de l'eau, trois étapes principales d'altération se produisent. III.1.1- Interdiffusion L'eau diffuse à l'intérieur du verre sain (phénomènes d'hydratation) puis s'échange avec les ions les plus mobiles des oxydes modificateurs tels que Na20 (interdiffusion). III.1.1.a- Quelles sont les interactions possibles eau-verre responsables des phénomènes d'hydratation de la silice '? III.1.1.b- Préciser à l'aide de la représentation développée le bilan de la réaction d'interdfiusion : (2 [Sio...]+ Na20) + 2 H20. Ill.1.l.c- Comment varie alors le pH de la solution '? III.1.2- Condensation La condensation d'eau conduit à la formation d'une pellicule d'altération appelée «gel». Cette pellicule est responsable de la diminution des atomes d'oxygène pontant entre les unités de silice [s10,,,]. III.1.2.a- Préciser l'équation--bilan à l'aide de la représentation simplifiée de la réaction de condensation : 2 [SiO...] + H20. III.1.2.b- Cette réaction est--elle réversible ? Justifier par analogie avec une fonction organique analogue. III.1.3- Dissolution à 363 K Lors de la dissolution, la silice se dissout selon l'équilibre : Sl02 (S) + 2 H20 : H4SÎO4 (aq) (sz : 3 à 363 K) La formation d'acide silicique H4SiO4, considéré comme un diacide dans l'eau à cette température, s'accompagne alors des équilibres : H4Si04 (aq) + HgO : H3Sio; (aq)+ H3O+(aq) (pK1=9,2à363 K) H3Sio; (aq)+ H20 2 HgSiOî' (aq)+ H3o+ (aq) (pK2=10,7à363 K) III.1.3.a- Donner l'expression de la concentration totale en silicium dissout, Cgml, en fonction des différentes espèces solubles du silicium. III.1.3.b- Donner l'expression de log(Cätal) en fonction du pH moyennant certaines approximations. III.1.3.c- En déduire alors l'allure de la courbe log(Cätal) en fonction du pH. III.2- Etude de la vitesse initiale v0 de dissolution du verre La vitesse de dissolution initiale du verre vo, mesurée pour des concentrations identiques, varie en fonction de la température. On mesure : 100%: .-------I III.2.1- Quelle est la relation entre la vitesse initiale vo et la température '? Préciser les hypothèses émises. III.2.2-- Du tableau de mesures ci-dessus, justifier vos hypothèses et déduire une valeur numérique de la grandeur physico-chimique impliquée dans la relation entre vo et T. III.2.3-- Le milieu ainsi que la composition du verre influent sur son altérabilité. III.2.3.a- Quelle peut être l'influence du pH sur la vitesse initiale de dissolution d'après la question III.1.3 ? III.2.3.b- Quelle peut être l'influence de la teneur en oxydes modificateur Na;0 et intermédiaire A1203, sur la vitesse initiale de dissolution du verre ? III.3- Relation entre la vitesse et l'affinité chimique de la réaction de dissolution Un modèle de la vitesse de dissolution en système fermé est donné par l'équation générale suivante : .. _ ui . _ .. ;_)]}O v -- k {[il ai [] exp( R1T& avec I] a? , produit des activités en solution des espèces i participant à la dissolution, ] Ui coefficient stoechiométrique de la ileme c l'ordre de la réaction, k constante de vitesse et A affinité chimique On ne considère dans cette question que le seul équilibre de dissolution de la silice en acide silicique H4Si04, l'ordre 0 de cette réaction étant de l. La solution est supposée idéale. espèce III.3.1- Rappeler la relation entre l'affinité chimique A et la constante d'équilibre K° ainsi que le quotient de réaction, noté Qr. Donner l'expression de l'affinité chimique A de l'équilibre de dissolution de la silice en acide silicique H4Si04, en fonction de C (concentration en acide silicique en H4Si04 H4SÎO4 III.3.2- Quelle est la valeur de l'affinité initiale ? En déduire l'expression de la vitesse v en solution) et C (concentration en acide silicique à saturation). . 0 . * fonction de vu, de Qr et K , pu1s de vo, CH4Sio4 et CH48i04 . III.3.3- Quelle est, dans ce modèle, la valeur de la vitesse au bout d'un temps supposé infini ? III.3.4- Ce modèle en système fermé est-il satisfaisant pour une description du comportement à long terme d'un verre de silice ? Partie B Les spongianes sont un groupe de diterpènes isolés d'espèces variées d'éponges dont le squelette est représenté par la structure 1 (Figure 1). Beaucoup de ces composés montrent un large spectre de propriétés biologiques qui peuvent être associées dans certains cas à la présence d'un groupe y- lactone insaturé (ester cyclique insaturé, cycle D). C'est le cas des dorisénones représentées par la structure II. A. Abad et collaborateurs ont proposé une synthèse linéaire du squelette à partir du cycle B pour former le bicycle AB puis le tricycle ABC et enfin ABCD à partir de la carvone (Tetrahedron Lett. 2002, 43, 7933-7936). " R1=OH R2=0Ac R1=OH R2=H R1=H R2=OAC (--)-carvone Figure 1 - S nthèse de la carvone à artir du limonène La (--)-carvone peut être synthétisée en plusieurs étapes à partir du (+)-limonène, produit naturel extrait des écorces d'oranges par entraînement à la vapeur (Schéma 1) : --OH N=0 --OH NGC] pyridine (C02H)2 acétone H20 (+)-- --limonène 4 (-)--carvone Schéma 1 I.1- Donner le principe de l'entraînement à la vapeur. Quel est l'intérêt de cette méthode ? La première étape résulte de l'addition du chlorure de nitrosy1e sur une double liaison. Le chlorure de nitrosyle, NOC1, est formé in situ en deux étapes par action de l'acide sulfurique sur le nitrite de sodium, NaNOZ, en solution dans l'éthanol puis addition d'acide chlorhydrique (Équation 1). NaNO2 + EtOH ___--> Et--O--NO ___--> Cl" + No+
HzSO4 ] HC]
H20
Équation 1
I.2- Donner la structure de Lewis de l'ion nitrite. Proposer un mécanisme pour
la formation du
nitrite d'éther et de l'ion nitrosyle à partir de cet intermédiaire.
I.3-- Ecrire les formes mésomères du cation nitrosyle.
I.4-- Par analogie avec l'hydrohalogénation, donner le mécanisme de la réaction
d'addition de
NOCl sur le limonène. Justifier la régiosélectivité de l'addition. Expliquer
brièvement le fait
que seule la double liaison intracyclique soit réactive.
I.5- La réaction d'addition est--elle stéréospécifique '? Représenter les
stéréoisomères possibles de 1.
1.6-- Comment s'appelle l'équilibre entre 1 et 2 ? Pourquoi est-il déplacé vers
la droite ?
I.7-- L'élimination de HCl est réalisée par traitement par la pyridine de
l'oxime 2 dissoute dans
l'acétone en chauffant au reflux.
Ecrire le bilan de formation de 3 à partir de 2. A quel type de mécanisme
appartient cette
réaction ? Selon la nature de l'amine, une autre réaction pourrait se produire.
Laquelle ? A
partir de ces remarques, justifier le choix de la pyridine comme base.
I.8-- Proposer un mécanisme pour l'hydrolyse de l'oxime 3 en carvone 4
catalysée par l'acide
oxalique (C02H)2.
I.9- Le tableau 1 donne les valeurs de pKa de différents diacides :
Tableau 1
Comparer entre elles les valeurs des pKa1 et des pKaz des diacides saturés et
expliquer les
variations observées selon la longueur de la chaîne carbonée.
Donner les structures des bases conjuguées des acides butènedioïques Z et E.
Expliquer la
valeur très basse du pKa1 de l'acide (Z)--butènedioïque et commenter la valeur
du pKa;_.
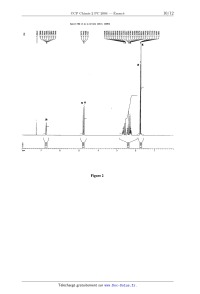
I.10-- Le spectre RMN 1H (en solution dans CDCl3) de la carvone est donnée dans
la figure 2. A
l'aide des tables figurant en annexe, attribuer les signaux marqués d'une
étoile en précisant
dans chaque cas la multiplicité observée.
Quelles bandes caractéristiques devraient être observées en infrarouge '?
(Table infrarouge en
annexe)
Spectre RMN ... de la Carvone (CDC13. 400MH2)
«umMN.u
n0hmh.u
NO--5h.«
OE«VNN.«
m--unn.«
omomh.n
NMVNN.N ,
mmomm.m &" . |)I
îNOOM.N \ i!f . mmmv.m
omnom . N *
l\lll
oemm...m.m
omn...m.m /
wwe--m....
moem...m.m..:::fu u - .z: i
ooemov.m | . voeom.m
:...S.... [I'll
moe......w.m .||umuuuu
......oevoe.m
oeoemm.m
mm......m.m
mvmmm.m
m...oeoe....m
......omm.m
mmmmm.m
oewmmm...m
oewo...m.m
&"
««vvn.< OEOEOOEN . Vl/ * .. EUR / N«VOEN.V * | 'Il! mmoeo.m MNNOEN.V \\ mommu.oe OVWMN.OE MOEQMN.m MNNVN.OE mm...wn.oe ...xm , ,/mmmmqw --momn.m ul\\\\llllll Ovmmh.w oemwmh.m NVOOEN.N | EQO _aLGUu=-- Figure 2 ppm II- Synthèse du bicycle La synthèse d'une dorisénone débute par la formation du bicycle AB (Schéma 2) 1 LDA 1- LDA Br THF THF \"" 2 Mel z BT'H2C" ç= -an Schéma 2 \ II.1-- Comment préparer le diis0propylamidure de lithium (LDA) a partir de l'amine correspondante ? Quel est l'ordre de grandeur des pKa des couples RNHÜRNHZ et RNHg/RNH' '? 11.2- Les alkylations successives de la carvone 4 pour conduire au composé 6 sont diastéréosélectives. Représenter les énolates formés dans chaque étape et les mécanismes d'alkylation. Justifier la régiosélectivité de la réaction du 2,3-dibromopropène conduisant au composé 6. II.3- Le traitement de 6 par l'acide trifluoracétique (pKa % 0) à température ambiante conduit à un mélange inséparable de deux bromures vinyliques 7 dans un rapport 60:40. II.3.1-- Représenter les carbocations susceptibles de se former par traitement de 6 par l'acide. Quel est le plus stable ? Justifier. 11.3.2-- Proposer un mécanisme pour la cyclisation et représenter les deux isomères 7 sans préciser lequel est majoritaire. III - S nthèse d'une dorisénone Les étapes suivantes conduisent à une lactone tétracyclique 13 selon le Schéma 3 : 0Me . HCO;H- H20 ::0 ------------>
DMF
COzMC
L'énone 7 est d'abord transformée en deux étapes en époxydécalone 8.
III.1- Ecrire l'équation-bilan de la réaction d'époxydation par un peracide.
III.2-- Combien de centres asymétriques possède le composé 8 '? Donner la
configuration absolue de
chaque centre en justifiant (respecter la numérotation).
III.3-L'époxydécalone 8 est transformée en deux étapes en hydroxy aldéhyde
insaturé 10. Donner
le nom de la réaction pour passer de 8 à 9 ainsi que les réactifs nécessaires.
III.4- Le composé 9 n'est pas isolé, il est hydrolysé en milieu acide en
hydroxy aldéhyde insaturé
10. Donner le mécanisme de l'hydrolyse en milieu acide d'un époxyde en se
plaçant dans le
cas de l'oxyde du cyclohexane.
III.5- Le cycle C du composé 12 est formé par une réaction de Diels--Alder
intramoléculaire entre le
diène du bicycle 11 et un diénophile. Donner la structure du composé A
précurseur de 12.
Ecrire le schéma de la réaction de Diels-Alder permettant d'obtenir 12.
III.6--Le diène 12 est traité par un mélange d'anhydride éthanoïque et d'iodure
de zinc pour
conduire quantitativement à la lactone tétracyclique 13 de formule brute
C22H3004. Ce
composé possède le squelette des structures II et présente des bandes
infrarouge à 1735 cm"1
et 1785 cm". Proposer une structure pour 13.
ANNEXE : DONNEES SPECTRALES
RMN 1H : gamme de déplacements chimiques :
-- GHz-GHz CH3-CH=CH CHÊ'SË=C GHz--CO nc=oco-
,
M...--
. .
J = 6
-_-----
INFRAROUGE : nombres d'onde de vibration de quelques groupes fonctionnels :
C=O
ester saturé
acyclique
C=O
ester insaturé
cyclique
_3550-3450 1790-1750 1750--1735 1725-1705 1695-1675 1690--1640
groupe
fonctionnel
Fin de l'énoncé