CCINP Chimie 2 PC 2006
| Thème de l'épreuve | Le fer et ses oxydes. Polymérisation du styrène. Synthèse de sesquiterpènes. |
| Principaux outils utilisés | cristallographie, cinétique chimique, solutions aqueuses, thermochimie, diagrammes d'Ellingham, diagrammes potentiel-pH, oxydoréduction, polymères, chimie organique |
Corrigé
:👈 gratuite pour tous les corrigés si tu crées un compte
👈 l'accès aux indications de tous les corrigés ne coûte que 1 € ⬅ clique ici
👈 gratuite pour tous les corrigés si tu crées un compte
- - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - -
👈 gratuite pour ce corrigé si tu crées un compte
- - - - - - - - - -
Énoncé complet
(télécharger le PDF)








Rapport du jury
(télécharger le PDF)







Énoncé obtenu par reconnaissance optique des caractères
SESSION 2006 PCCH2 10
A
CONCOURS (OMMUNS POIYIICHNIOUES
EPREUVE SPECIFIQUE -- FILIERE PC
CHIMIE 2
Durée : 4 heures
Les calculatrices sont autorisées
N.B. : Si un candidat est amené à repérer ce qui peut lui sembler être une
erreur d 'énonce', il le
signalera sur sa copie et devra poursuivre sa composition en expliquant les
raisons des initiatives
qu 'il a été amené à prendre. '
Les parties 1, II et III sont indépendantes et dans chacune d'elles, un certain
nombre de
questions peuvent être traitées séparément.
Partie I : Chimie du fer et des oxy-hydroxydes de fer
Le fer est le quatrième élément le plus important de la croûte terrestre (5,6%
en masse). Des oxydes,
hydroxydes ou oxy-hydroxydes de fer apparaissent lors de l'altération des
roches pour se retrouver
ensuite au niveau des sols. Ils peuvent subir alors des cycles d'oxyd0réduction
suivant les
conditions du milieu ou la présence de microorganismes. Ils « oscillent » entre
la forme Fe(II) phase
mobile dans le milieu géologique et Fe(lll) phase peu--mobile avec une faible
solubilité. Ces oxydes
de fer ont la capacité de limiter la migration des polluants dans de nombreux
écosystèmes et de
réguler la distribution des nutriments apportés aux plantes (phosphore,
nitrates, sélénium. . .).
Ce problème aborde différents aspects de la chimie du fer ainsi que quelques
aspects des propriétés
complexantes des oxy--hydroxydes de fer.
Données
. Rayons atomiques. et masse molaire : .
- Rayons atomiques du fer et du carbone : rFe = 0,124 nm ; rc = 0,077 nm
- Masse molaire du fer : MFe = 56 g- mol"1
. Données thermodynamiques à 298 K :
- Enthalpies libres molaires standard deformation 46° (en k.] - mol"! ) :
- Enthalpies molaires standard deformation A,H ° (en [c] - mol"! ) et entropies
molaires standard S...°
(en J.mor1.K1) .-
. Constante des gaz parfaits : R = 8,31 J- K"1 - mol"1
. Constante d'Avogadro : N{, = 6,02.1023mol'1
Onlîappelle que la constante thermodynamique de l'équilibre d'autoprotolyse de
l'eau, K,, vaut
10' à 298 K
A- Le fer et ses oxydes
1- Etude cristallographique du fer
Le fer ou, variété allotropique stable aux pressions et températures usuelles,
cristallise dans une
structure de type cubique centré. Ce réseau présente des sites interstitiels
octaédriques et
tétraédriques. Les sites octaédriques sont centrés par exemple au point (1/2,
0, 0) ou au point (%., 1/2,
1), alors que les sites tétraédriques sont centrés par exemple au point (1/2,
0, %). Ces sites interstitiels
peuvent être occupés par des atomes, notamment par des atomes de carbone, ce
qui donne lieu, à la
formation de solutions solides F eCX constituant les aciers.
a- Représenter clairement la maille conventionnelle du fer oc. Préciser la
coordinence ainsi
que le nombre de motifs appartenant en pr0pre à cette maille.
b- Calculer la compacité de ce type d'empilement ainsi que la masse volumique
du fer oc.
c-- Représenter un site octaédrique et un site tétraédrique. Quel est leur
nombre par maille ?
d-- Exprimer la taille maximale d'un atome occupant l'un de ces sites
octaédriques et
tétraédriques en fonction du rayon du fer, rFe, en tenant compte pour ce calcul
de la plus
courte distance entre l'un des sommets de la cavité et le site interstitiel.
e-- En déduire, à partir des données numériques, quels sont les sites
interstitiels occupés par
l'atome de carbone dans le fer oc. ' '
2- Etude des oxydes de fer en phase sèche
Le fer et plus particulièrement les oxydes de fer(ll) ou (111) sont utilisés en
tant que catalyseur dans
la synthèse industrielle, en phase gazeuse, d'ammoniac à partir de dihydrog'ene
et de diazote. Le
catalyseur est à base de magnétite F e304(s) ou de wüstite F eO(S). On souhaite
déterminer dans cette
question quel est l'oxyde de fer le plus stable thermodynamiquement à la
température T où a lieu la '
réaction de formation de l'ammoniac. Les équilibres des couples étudiés Red/Ox
pour la
construction du diagramme d'Ellingham' du fer et de ses oxydes seront ramenés à
une mole de,
di0xygène gazeux Oz(g). On supposera qu'il n'y a pas de changement d'état
physique dans le
domaine de température considéré. «
a- Rappeler en quoi consiste l'approximation nécessaire à la construction du
diagramme
d'Ellingham. '
b- Donner l'expression des enthalpies libres standard, A,G°, en fonction de la
température T
exprimée en Kelvin, pour chacun des couples F e(s)/F e0(8) et Fe0(s)/Fe304(s).
c- Tracer sur la copie l'allure des droites A,G° en fonction de la température
T pour
300K< T< 1500 K. d- En déduire le domaine de stabilité thermodynamique du fer Fe(s) et des oxydes de fer FeO@ et Fe3O4(s). Montrer que pour un domaine de température à préciser la wüstite F eO(S) n'est pas stable thermodynamiquement. Ecrire l'équation de la réaction traduisant cette instabilité thermodynamique. e-- Déterminer l'expression de ApG° en fonction de T pour le couple à considérer dans le domaine de température où la wüstite Fe0(s) n'est pas stable thermodynamiquement. Tracer, sur le diagramme précédent, le segment de droite correspondant et en déduire le domaine de Stabilité thermodynamique du fer F e(s) et de ses oxydes Fe0(s) et Fe3O4(S) pour 300K<103 Pa, en déduire le taux d' humidité de l'air (en %) nécessaire à l'hydroxylation de l'hématite Fe203(5) en goethite FeO(OH)(S) à cette température. Concluré. 4-- Stabilité thermodynamique du fer et de ses oxydes en solution aqueuse L'allure du diagramme potentiel--pH du fer est présentée ci- après pour une concentration totale en fer dissous de 10°2 mol L". A ce diagramme potentiel-pH du fer est superposé celui de l'eau représenté en poäntillé. Ce diagramme tient compte des espèces les plus stables du fer et de ses oxydes: Fe(s), Fe(aq),F e(;q), FEUR3Û4(s) EURt FEURÛ(ÛH)(s) E(Vl a- Identifier chacun des domaines de prédominance ou d'existence (repérés I à V sur le d1agramme représenté ci-dessus) des espèces du fer prises en compte. Justifier votre réponse à l'aide du degré d'oxydation de l'élément fer. b-- Déterminer la pente des segments de droite (AB) et (BC). Donner la valeur du pH de frontière entre les domaines IV et V. c-- Préciser les domaines de corrosion, d'immunité ou de passivation du fer. Proposer une méthode pour l1m1ter 1 oxydation du fer. d-- Donner les équations des réactions d'oxydation du fer par une solution aqueuse basique ainsi que par une solution aqueuse basique et aérée. B- Etude des. phénomènes de sorption sur la goethite On définit la sorption comme l'ensemble des processus aboutissant au transfert d'un soluté vers la surface d'un solide immergé en solution aqueuse, nommé sorbant. On distingue deux catégories de sorption en fonction de la nature des interactions intermoléculaires soluté--sorbant mises en jeu : la physisorption et la chimisorption. Ces phénomènes de sorption aux interfaces sorbant--solution aqueuse sont responsables de la migration dans les milieux géologiques de composés toxiques ' cationiques ou anioniques.'Les milieux géologiques «réels >> étant trop
complexes, des sorbants
simples tels les oxy-hydroxydes de fer, représentés par la goethite FeO(OH)(S),
seront étudiés dans la
suite du problème.
Par la suite les conventions suivantes seront adoptées :
Un sorbant solide sera noté avec le symbole « ="-î » précédant l'espèce solide,
par exemple pour la
goethite. =FeO(OH), notée plus simplement îFeOH.
On adoptera pour exprimer la concentration volumique d' un soluté en solution
aqueuse la notation
usuelle « [] » et la notation {} pour exprimer la concentration de surface,
exprimée en mol kg],
c est--à- dire le nombre de males d' une espèce sorbée pour ] kg de solide
sorbant.
On admettra que l'activité d' une espèce sorbée est égale au rapport de sa
concentration de surface,
exprimée en mol kg", sur la concentration de surface standard de ] mol kg'1.
On se propose donc dans cette partie d'étudier le mécanisme de sorption d' un
cation métallique sur
la goethite EFeOH, ainsi que la complexation sur ce même sorbant d'un dérivé
an1on1que du
sélénium.
5-- Etude cinétique
Une modélisation simple du mécanisme de complexation d'un cation métallique M2+
sur un sorbant
est calquée sur les mécanismes de complexation en phase homogène. Dans le cas
d'une
complexation en phase hétérogène sur de la goethite solide, EFeOH, d'un cation
métallique M2+
hexahydraté, initialement en solution aqueuse et noté M(HZO)Ë+ , le mécanisme
réactionnel est
proposé ci--dessous (l'équilibre (l) est considéré comme rapidedevant l'étape
(2), étape la plus
lente) :
kl '
M(HZO)Ë+ + EFeOH : EFeOH""M(HZO)Ë+ (1)
k_] y '
2 km H
EFeOH""M(HZO)6+ --> -=--Fe--o: + H20 (2)
M52+
On présente ci-après le mécanisme de complexation en phase homogène aqueuse du
cation
F e(HZO)Ë+ par un ligand anionique noté L"' :
k.l
Fe(HZO)Ë+ + L"' : Fe(HZO)6L(Z"")+ . . (l')
.k'_' '
Fe(HZO)6L(Z'")+ .'î3 Fe(HZO)5L(2"")++ H20 (2')
. , . . _ + , .
a- Donner la configuration electronique du fer, 32 Fe et du cation ferreux 32
Fe2 . Determmer
leurs nombres d'électrons de valence.
b- Justifier que le cation ferreux Fe2+ Soit en solution aqueuse hexahydraté.
Comparer sa
stabilité à celle du complexe Fe(H20)6L@*">+ .
c-- Peut-on appliquer l'AEQS (Approximation des Etats Quasi-Stationnaires) au
complexe
F e(HZO)6 L(2°'n)+ ? Justifier v0tre réponse.
d- Donner l'expression de la vitesse de formation en phase homogène aqueuse du
complexe
Fe(H;,_O)5 L(2"")+ , noté plus simplement FeL(2'")+ en fonction des différentes
constantes
de vitesse et des concentrations [Fe(HZO)Ë+] et [L""] .
e-- Donner l'expression de la vitesse de formation surfacique d{EFeO- M(H20);
/dt, notée
simplement d{ë FeO--M'}/dt, en fonction des différentes constantes de vitesse
et des
concentrations {EFeOH} et [M(HZO)Ë+], sachant que l'équilibre (l) est rapide et
que
l'étape (2) est lente.
6- Dérivés du sélénium
Le sélénium, dont l'isotope ËZ Se (de période : 65000 ans) est un des produits
de fission de
l'uranium, contribue à la radioactivité de longue durée de certains déchets
radioactifs. On trouve le
sélénium dans l'environnement, sous forme d'ions séléniure, Se2', d'ions
sélénite SeO3' ou d'ions
sélénate SeO4_ , soit essentiellement sous forme anionique.
a-- Donner les configurations électroniques de l'atome de sélénium 3,9, Se et
de 1' mn séléniure
Se2' dans leur état fondamental. Déterminer le nombre d' électrons de valence
du sélénium.
b- Préciser les nombres d'oxydation minimal et maximal du sélénium.
c- Représenter les formes mésomères les plus probables des ions sélénite SeO{
et sélénate
SeO[ . Préciser, pour chacun de ces anions, la géométrie autour de l'atome
central de
sélénium ainsi que le nombre d'oxydation de cet élément.
7- Solution aqueuse d'ions sélénite
Les ions sélénite SeO{ présentent des propriétés acido-basiques en solution
aqueuse. Le graphe ci--
dessous donne les courbes de distribution de ces ions sélénite SeO{ en fonction
du pH de la
solution :
a- Quel est le comportement acido-basique des ions sélénite SeO{ en solution
aqueuse ?
Ecrire les équations des réactions traduisant ce comportement.
b- Identifier chacune de ces courbes de distribution, numérotées sur le graphe
ci-- -dessus de
(l)à a(3), à une espèce dérivant des ions sélénite SeO3. Justifier simplement
votre
réponse.
Déterminer, à partir des trois courbes de distribution, les valeurs numériques
des
. . , . , . . i---2 i--3 . _
constantes d'ac1d1te assoc1ees aux couples ac1do--bas1que HiSeO3 / HHSeO3 ,
avec 1 --
'1 ou 2. '
d-- Estimer, en justifiant les approximations faites, le pH-d'une solution
aqueuse de sélénite
de sodium, NaZSeO3, de concentration 0,001 mol- L' .
8- Type de complexes formés par les ions sélénites Se032' sur la goethite
La cinétique de sorption ou de désorption des ions sélénites SeO{ sur la
goethite EFeOH est
extrêmement rapide. On souhaite établir dans cette question si les ions
sélénites SeO{ se fixent sur
un Ou deux sites hydroxylés de la goethite. Il y a alors formation
respectivement soit de E F eOSeOQ ,
soit de (:=- FeO)2 SeO. On définit le coefficient de distribution Kd des ions
sélénites-SeO{ :
{ESEUROY} . »
[SeOÊ']
E FeOSeO£ ou de (5 FeO)2 SeO.
Kd : , où ESeO3" représente les ions sélénites sorbés sur la goethite, sous
forme de
a- Donner les équations des réactions d'échange d'un ion sélénite Se_OÎ ,
initialement en
solution aqueuse de pH fixé à 5, avec un oudeux groupes hydroxylés OH de la
goethité
EFeOH, et exprimer leurs constantes d'équilibre.
b- En déduire qu'à faible taux de sorption des ions sélénites SeO? , le
logarithme du
coefficient de distribution, log(Kd),de ces ions est une fonction affine du pH.
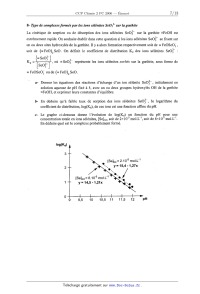
c-- Le graphe ci--dessous donne l'évolution de log(Kd) en fonction du pH pour
une
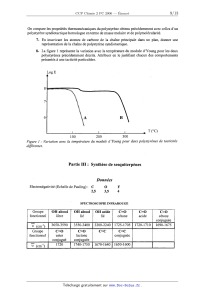
concentration totale en ions sélénites, [Se]... soit de 2><10'5 mol.L'l, soit de 8><10'5 mol.L'l. En déduire que] est le complexe probablement formé. [Se]tot = 2.10'5 mo...."1 y = 15,4 -1,27x [Se]tot = 8.10"5 mol.L'1 y = 14,5 -1,21x Partie II : Polymérisation du styrène On se propose d'étudier la polymérisation radicalaire en solution dans le toluène du styrène amorcée par l'AIBN (azobisisobutyronitrile) à 60°C. CN CN Me +N=N+Me AIBN ' Me Me Cette polymérisation se déroule en trois phases : l'amorçage, la propagation et la terminaison. En ce qui concerne l'étape d'amorçage, on fera l'hypothèse que l'efficacité de l'amorceur est égale à 1. De plus, l'étape de terminaison s'effectue par recombinaison (aussi appelé couplage). styrène Les conditions expérimentales sont les suivantes : [AIBN]g = 4><10'2 mol.L"; [Styrène]o = 1 mol.L"'. Par la suite, on utilisera comme notation : A pour l'amorceur AIBN . . . , ' . . I pour les radicaux issus de la decomposrtmn de l'amorceur M pour le monomère (styrène) ' . . . . . . . Rn pour le rad1cal issu de l'addition d'un radical sur le monomere ka et Va pour la constante de vitesse et la vitesse d'amorçage kd pour la constante de vitesse de décomposition de l'amorceur kp et Vp pour la constante de vitesse et la vitesse de propagation kt et V. pour la constante de vitesse et la vitesse de terminaison \ 1- Présenter les équations de réaction associées a chacune des trois phases de la polymérisation en l'absence de transfert de chaîne en utilisant les notations indiquées ci dessus. En supposant que la réactivité des chaînes actives est indépendante de leur degré de polymérisation moyen, on établira les relations entre vitesse, constante de vitesse, et concentrations des espèces impliquées dans chacune des phases de la polymérisation. 2- En supposant un état quasi-stationnaire en centres actifs et une terminaison par recombinaison des chaînes actives, établir la relation qui relie V. et V,. En déduire comment varie la concentration totale en macroradicaux. 3- Justifier pourquoi on peut assimiler la vitesse globale de polymérisation à la vitesse de propagation. 4-- Montrer alors que la vitesse initiale de propagation Vp varie comme: Vp : K.[Styrène]o [AIBN]ÏJ2 , où K est fonction de kp, kd et kt. . . . . -10 -1 -1 . . . 5- On mesure une v1tesse initiale d'amorçage Va = 1,6x10 mol.L .s ams1 qu'une v1tesse initiale de propagation Vp = 1,86><10'7 mol.L".s". Le rapport des constantes de vitesse de propagation et de terminaison kp/ kt est égal à 2,5x10'6. En déduire kd, kp et kt en précisant les unités de chacune des constantes de vitesse. 6--- Compte tenu de la méthode de synthèse utilisée, quelle tacticité vont présenter les chaînes de polystyrène ainsi obtenues ? On compare les propriétés thermoméCaniques du polystyrène obtenu précédemment avec celles d'un polystyrène syndiotactique homologue en terme de masse molaire et de polymoléculafité. 7-- En inscrivant les atomes de carbone de la chaîne principale dans un plan, donner une représentation de la chaîne de polystyrène syndiotactique. 8-- La figure 1 représente la variation avec la température du module d'Young pour les deux polystyrènes précédemment décrits. Attribuer en le justifiant chacun des comportements présentés à une tacticité particulière. Log E 7 6 A B T (QC) 100 200 300 Figure 1 : Variation avec la température du module d 'Young pour deux polystyrènes de tacticités dfiérentes. ' ' On compare les propriétés thermomécaniques du polystyrène obtenu précédemment avec celles d' un polystyrène syndiotactique homologue en terme de masse molaire et de polymolécularité. 7-- En inscrivant les atomes de carbone de la chaîne principale dans un plan, donner une représentation de la chaîne de polystyrène syndiotactique. 8- La figure 1 représente la variation avec la température du module d' Young pour les deux polystyrènes précédemment décrits. Attribuer en le justifiant chacun des comportements présentés à une tacticité particulière. Log E 8 Il ...... 7 6 ':_A B T (QC) 100 200 300 Figure ]: Variation avec la température du module 61" Young pour deux polystyrènes de tacticités différentes. * Partie III : Synthèse de sesquiterpènes Données Electronégativité (Echelle de Pauling) : C 0 F 2,5 3,5 4 SPECTROSCOPIE INFRAROUGE OH alcool OH 1alcool OH1 iacide C=O C=O libre cétone acide cétone con u uée . 10% 1690- 1675 3650- 3590 3550- 3400 3200 2%240% 1725-- 1705% 1720-- 17 Groupe C=C conjuguée fonctionnel % 1720EUR 1740 1750 1670 1640 1650 1 - Groupe fonctionnel lactoneEUR RMN DU PROTON f--,--Ï CArfls-C-- . -C-CHz-C- COZR 2 _ _ -CHz-CO-Ar ' CH-OO-C- ' CH3-O-Ar ----- {___-__ïï'äïî-' Les sesquiterpènes phénoliques tels que le mutisianthol 1 et l'héritol 3 sont extraits de substances naturelles. Ces composés présentent des propriétés biologiques intéressantes. Ils ont été synthétisés à partir d'un intermédiaire commun, la tétralone 2 selon le Schéma 1 14 Schéma ] A- Synthèse de la tétralone La synthèse des composés 1 et 3 nécessite tout d'abord la mise au point de la préparation de la tétralone 2. , Le 2-méthylanisole, produit commercial et bon marché est transformé en tétralone en six étapes ' présentées dans les schémas suivants. _ La première étape met en jeu le 2-méthylanisole 4 et l'anhydride succinique, dans une réaction catalysée par le chlorure d'aluminium. 0 M Me0 C02H °° 1- AIC13 + 0 _ z- H20/H+ 4 0 5 0 Schéma 2 1-- Ecrire le mécanisme de la réaction du chlorure d'éthanoer sur le benZène en présence d'AlCl3. 2-- Quel est le nom de cette réaction '? Ecrire une structure de Lewis pour AlCl3. Préciser son rôle dans la réaction. Combien d'équivalents en AlCl3 sont nécessaires ? Pourquoi est--11 nécessaire d'hydrolyser le milieu réactionnel ? 3-- Par analogie, proposer un mécanisme pour la première étape de la synthèse de la tétralone. Le céto-acide obtenu 5 est ensuite réduit par l'amalgame de zinc. L'acide 6 formé est traité par un mélange d'acide trifluoroéthanoïque (TFA) et d'anhydride trifluoroéthanoïque (TFAA) pour conduire au composé bicyclique 7. Me.. CO,H Me Zn(Hg) TFAA ___--__) ---------->
HC ] TFA
6 7
Schéma 3
4- Ecrire la formule semi--développée de l'acide trifluoroéthanoïque. Quel est
l'effet inductif
du fluor ? Représenter le déplacement des électrons dans la liaison C--F .
5-- Quel rôle joue l'acide trifluoroéthan0ïque vis-à-vis du groupe COOH ? Quel
intermédiaire
est formé ? En déduire un mécanisme de formation de 7. A quel type de réaction
pouvez--
vous rattacher cette cyclisation ?
L'action sur la cétone bicyclique 7 de l'iodure de méthylmagnésium en solution
dans l'éther donne
un produit A qui par traitement à HC] 10% à température ambiante (TA) conduit
au produit B.
Me ' Me Me '
1- CH3MgI H2 003
___--> B ___--> ___-->
2- HC], TA Pd/C
Schéma 4
6- Ecrire le mécanisme de la réaction 7 ----> B
7-- Représenter les composés A et B.
L'hydrogénation catalytique du produit B conduit au composé bicyclique 8.
8-- Représenter schématiquement le mécanisme de la catalyse hétérogène dans le
cas de
l'hydrogénation. '
L'oxydation de 8 par l'oxyde de chrome conduit à la tétralone 2 qui présente en
infrarouge deux
bandes à 1680 cm"1 et 1610 cm'l. Le spectre RMN 1H (90 MHZ) dans CDC13 présente
les signaux
suivants :
_ Multiplicité _
Intégration du signal
' 6 en . m
3 rotons
2 rotons
3 rotons '
2 rotons
1 mm
3 rotons
9- Attribuer les bandes infrarouge caractéristiques aux liaisons
correspondantes.
10- Attribuer en RMN 1H chaque signal au proton correspondant. Justifier dans
chaque cas la
multiplicité des signaux (il est demandé de faire un tableau pour plus de
clarté). '
B- Synthèse du (zh)--mutisianthol
La tétralone 2 est ensuite transformée en 6 étapes en ($)--mutisianthol
(Tetrahedron, 2003, 59, 5817)
selon les Schéma 5 et 6. La première étape est la réduction de la tétralone 2
en tétralol 9 qui, traité
par l'acide p--toluène Sulfonique (TSOH) en quantité catalytique, conduit au
composé 10. Cet
intermédiaire, soumis au traitement par le trinitrate de thallium dans le
méthanol, fournit le composé
11 dans lequel on observe une contraction de cycle. (Schéma 5)
Me0 MeO ' Me0 {
? TsOH ., TI(N03) .
------> ----> . _--'>
C6H6 MeOH _
==
5
/
2 0 9 OH . 10 11NIeO/\0Me
Schéma 5
11- Proposer des conditions opératoires permettant de transformer 2 en 9.
_12- Sachant que l'acide p-toluène sulfonique joue le même rôle qu'un acide tel
que HZSO4,
représenter la formule du composé 10. A quel type de mécanisme appartient la
réaction
9 ------> . 10 ? '
13- Nommer les fonctions présentes dans le composé 11.
Après traitement à l acide acétique (AcOH) aqueux, l'aldéhyde 12 est transformé
en deux étapes
en (:t)-- mutisianthol. Il est obtenu à partir de 13 par traitement avec du
chlorure d' aluminium et '
de 1' éthanethiol (EtSH) (Schéma 6).
MeO
--------> --------->
H20 ©
Schéma 6
14- Ecrire le mécanisme de formation l'aldéhyde 12.
15-- Proposer des conditions expérimentales permettant de transformer
l'aldéhyde 12 en
V composé 13. Ecrirel' équation bilan de la réaction.
16- Pr0poser une méthode pour préparer un étheroxyde R-O--R' à partir d'un
alcool R-OH. '
17- Combien de centres asymétriques possède le (:Q-mutisianthol ? Donner la
configuration
absolue de chaque centre en la justifiant.
C - Synthèse du (à)-héritol
Le (£)-héritol 3 (Tetrahedron, 1991, 47, 5759) est préparé à partir de la
tétralone 2 en 5 étapes
(Schémas 7 et 8). .
La première étape de la réaction est l'action sur la tétralone 2 d'un mélange
de bromopropanoate
d'éther et de zinc. Il se forme un dérivé organozincique analogue à un
organomagnésien. Le
composé 14 obtenu, après traitement, sous forme d'un mélange de
diastéréoisomères est ensuite
déméthylé (étape 2) dans les mêmes conditions que dans le Schéma 6, puis la
fonction hydroxyle est
protégée sous la forme d'éther tétrahydropyraner (THP) (étape 3).
com
Schéma 7
18-- Ecrire la formule semi-développée de l'organozincique formé à partir du
2-bromopropanoate d'éthyle. Quel traitement est nécessaire pour obtenir
finalement 14 ?
19- En utilisant la formule ROH pour le composé 15, écrire le mécanisme de la
réaction de
protection. Justifier la" régiochimie obtenue.
Le traitement par le tétroxyde d'osmium de l'éther 16 (étape 4) fournit un
mélange de
diastéréoisomères 17. Ce mélange traité par l'acide p-toluène sulfonique (étape
5), conduit à un
mélange de deux isomères de formule brute C15H1603 présentant quatre bandes
infrarouge
principales à environ 3590 cm", 1740 cm], 1654 cm"1 et 1617 cm'1.
16 _» 17 ___--> C15H1603
étape 4 étape 5
Schéma 8
20- Représenter la formule semi--développée du composé 17 .
21- Représenter les isomères formés dans l'étape 5. Quelles relations
d'isomérie existent entre
eux ? Attribuer les bandes infrarouge aux vibrations correspondantes.
22- Ces isomères sont-ils séparables ? Justifier. Proposer une méthode de
séparation.
Fin de l'én0ncé