CCINP Chimie 2 PC 2007
| Thème de l'épreuve | Étude de quelques aspects de la chimie de l'uranium et de ses composés. Synthèse totale du (-)-dactylolide. |
| Principaux outils utilisés | atomistique, diagrammes d'Ellingham, cristallographie, solutions aqueuses, diagramme E-pH, chimie organique |
| Mots clefs | Uranium; dactylolide |
Corrigé
:👈 gratuite pour tous les corrigés si tu crées un compte
👈 l'accès aux indications de tous les corrigés ne coûte que 1 € ⬅ clique ici
👈 gratuite pour tous les corrigés si tu crées un compte
- - - - - - - - - - - - - - - - - - - - - - - - -
👈 gratuite pour ce corrigé si tu crées un compte
- - - - - - - - - - - - - - - - -
Énoncé complet
(télécharger le PDF)






Rapport du jury
(télécharger le PDF)






Énoncé obtenu par reconnaissance optique des caractères
me.--52-- ? " mm.--SQ
N m--ËEOEO
o...... BEBE - mmoËomä mËËÈ
"mao--:=Vu--Ï-Ooe mz=Slou ...::ouzav
'
SESSION 2007 PCCH209
A
CONCOURS COMMUN!» POlYÏECHNIOUES
EPREUVE SPECIFIQUE - FILIERE PC
CHIMIE 2
Durée : 4 heures
Les calculatrices sont autorisées
N.B. : Le candidat attachera la plus grande importance à la clarté, & la
précision et à la concision
de la rédaction. Si un candidat est amené à repérer ce qui peut lui sembler
être une erreur
d 'énoncé, il le signalera sur sa copie et devra poursuivre sa composition en
expliquant les raisons
des initiatives qu 'il a été amené à prendre.
Les parties A et B sont indépendantes et dans chacune d 'elles, un certain
nombre de questions
peuvent être traitées séparément. Toutes les données nécessaires sont en fin de
chaque partie.
Une feuille de papier millimètré doit être rendue avec la copie.
Partie A : Etude de quelques aspects de la chimie de l'uranium et de ses
composés
L'uranium, élément radioactif naturel qui tire son nom de la planète Uranus,
fut découvert en
Allemagne par Martin Heinrich Klaproth en 1789. Cet élément, assez répandu, est
notamment
présent dans 5 % des minéraux connus et il représente quelques parties par
million de la
composition de la croûte terrestre. Il est utilisé depuis longtemps par l'homme
: il. a pu par exemple
être employé pendant des siècles comme pigment dans les verres. Cependant,
c'est surtout depuis la
découverte de la radioactivité à la fin du XIX"me siècle puis la maitrise par
l'homme des réactions
nucléaires au cours de la première moitié du XX'""" siècle que l'uranium est
devenu un élément
stratégique, tant du point de vue économique, politique qu'écologique. Ainsi,
aujourd'hui, la
réaction nucléaire de fission de l'uranium fournit près de 20 % de la
production d'électricité dans le
monde. Avec plus de 80 % de son électricité produite par voie nucléaire, la
France se situe au
premier rang mondial. Cette situation résulte de choix économiques faits dans
les années 1970 et a
contribué à faire de la France l'un des pays phares dans le domaine de la
recherche nucléaire.
Le problème qui sait se propose d'explorer certains aspects de la chimie de
l'uranium qui se révèle
être l'une des plus riches connues.
1/11
I-- Les principaux minerais d'uranium
L'uranium fait partie des actinides qui constituent le groupe IllB de la
classification périodique. Il
est présent à l'état naturel sous deux formes isotopiques, 2äâU et 2äÊU, dont
les abondances sont
respectivement 0,72 % et 99,28 %.
L'amont du cycle électronucléaire fait intervenir de nombreuses étapes depuis
l'extraction de
minerais riches en uranium comme la pechblende U308(5), le raffinage de
l'uranium, son
enrichissement en isotope fissile 2Ëâ U et sa conversion en combustible
uraninite U02....
I-1 Préciser ce qui distingue les deux isotopes naturels de l'uranium.
Peut--on les différencier de part leurs propriétés chimiques ?
I--2 Donner la configuration électronique de l'uranium prévue d'après la règle
empirique de
Klechkowski.
En déduire le nombre d'électrons de valence et le nombre d'oxydation maximal de
l'uranium.
Justifier pourquoi l'uranium est fréquemment rencontré au nombre d'oxydation
+VI.
I--3 Les oxydes d'uranium considérés par la suite sont : UOZ(S), U30g(s) et
UO3(S).
Quel est le nombre d'oxydation de l'uranium dans chacun de ces oxydes '? On
considèrera
U303(5) comme un oxyde mixte décrit à partir des deux autres, dont on précisera
les
proportions.
I--4 A partir desfidonnéesp thermodynamiques fournies, calculer les droites
d'Ellingham relatives
aux couples'UO3(S)/U3Og(s),U303(5)/U02(5) et UOg(s)/U(S) en rapportant les
bilans à une mole de
dioxygène.
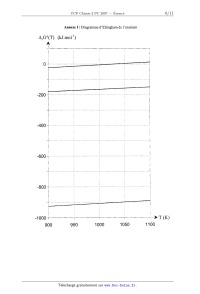
Reproduire sur la copie l'allure du diagramme fourni en annexe I en indiquant
les domaines
d'existence de chaque phase solide.
I--5 Déduire graphiquement ce qui se passe, en fonction de la température, si
on chauffe de
l'uraninite UOZ(S) sous une pression de dioxygène de 1 bar jusqu'à 1100 K.
I--6 On envisage la possibilité de réduire les oxydes d'uranium par le dihydro
gène.
Le dihydro gène peut être produit par conversion du méthane selon la réaction :
CH4(g) + H;0® = co(g) + 3 H2(g, avec A, ° = 206 -- 0,227 T (kJ.mol'l)
Partant d'un mélange équimolaire de CH4(g) et HgO(g), calculer la proportion n
de méthane
transformée à l'équilibre pour T = 1000 K sous une pression P de 1 bar.
I-7 Calculer la droite d'Ellingham relative au couple H20(g)/Hz(g). La placer
sur le diagramme
reproduit à la question 14.
En déduire la phase solide obtenue à l'équilibre quand on soumet UO3(S) à un
mélange
HzO(g)/Hg(g) tel que P(HZO) = P(H2) = 1 bar en excès à 1000 K. Pourquoi la
pression partielle
de dioxygène n'est-elle alors pas quelconque '?
I-8 Ecrire l'équation de réduction de l'uraninite UOZ(S) en uranium métal.
Donner l'expression de
l'affinité chimique et en déduire quelle doit être la pression maximale de
vapeur d'eau
contenue dans le dihydrogène à une pression partielle P(H2) = 1 bar à 1000 K
pour permettre
cette réduction. Est--ce réalisable ?
I-9 On souhaite comparer le pouvoir réducteur du dihydrogène à ceux du carbone
graphite et du
monoxyde de carbone. On rappelle :
2 q,, + ogg, = 2 mg, avec A,Gf = - 222 --- 0,179 T (kl.mol")
2 co(g) + 0%) = 2 CO2(g) avec A.G ° = -- 566 + 0,173 T (kJ.mol'1)
2/11
Justifier le signe des pentes des droites d'Ellingham correspondant aux
équilibres précédents.
Construire sur la feuille de papier millimètré fournie, le diagramme
d'Ellingham relatif aux
espèces C(S), C0(g) et C02(g) à partir des données précédentes sur le domaine
de température
[900 K; 1100 K]. Préciser les domaines de prédominance et les couples à
considérer en
fonction de la température.
I--10 Reporter sur le diagramme précédent les données relatives au couple
H20(g)/Hg(g) étudié à la
question I--7. Utiliser ce diagramme pour comparer le pouvoir réducteur du
dihydrogène à
ceux du carbone graphite et du monoxyde de carbone.
Est-ce que le carbone graphite ou le monoxyde de carbone présenterait un intérêt
supplémentaire au dihydrogène quant aux possibilités de réduction des oxydes
d'uranium '?
Leur voyez--vous un inconvénient ?
II- Cristallochimie de l'uraninite U02
L'uraninite U02 est l'oxyde d'uranium cristallin qui sert de combustible de
base à la plupart des
centrales électronucléaires actuelles. Les rayons ioniques de l'ion uranium et
de l'ion oxygène sont
respectivement de 100 pm et 140 pm pour ce solide.
II--1
II--2
II-3
II-4
II-S
Dans l'uraninite, les cations forment un réseau cubique faces centrées de
paramètre de maille
et où les anions occupent l'ensemble des sites interstitiels tétraédriques.
Représente'r la maille de l'uraninite.
Donner le nombre de motifs par maille, le type structural de l'uraninite et les
coordinences
cation/anim et anion/cation.
Calculer la distance entre deux ions de signes opposés plus proches voisins en
fonction du
paramètre de maille a, dans le cadre d'un modèle ionique.
En déduire la valeur du paramètre de maille, la compacité de la structure et la
masse
volumique de l'uraninite U02.
Déterminer l'inégalité générale que doit a priori satisfaire le rapport r+/r_
des rayons ioniques
respectifs du cation et de l'anion pour assurer la stabilité du type de
structure ad0ptée par
l'uraninite.
Conclure si la stabilité d'une telle structure était prévisible pour
l'uraninite.
L'uraninite est en réalité un composé non stoechiométrique, c'est-à--dire que
sa composition
s'écarte de celle idéale de l'uraninite U02. Cet écart à la stoechiométrie peut
a priori
s'interpréter selon deux mécanismes :
- Mécanisme I : présence de lacunes d'uranium dans leur disposition cubique
faces
centrées ayant pour conséquence un défaut d'uranium alors que le sous-réseau
des ions
oxygène reste intact. Ce mécanisme conduit à une formule chimique du type
U...Og.
-- Mécanisme Il : insertion supplémentaire d'ions oxygène occupant les sites
interstitiels
disponibles laissés par les ions uranium dont la disposition reste inchangée
par rapport
à la structure idéale U02 étudiée précédemment. Ce mécanisme conduit à une
formule
chimique du type U02+y.
Dans le cas du mécanisme Il, quelle est la localisation, le nombre par maille
et la coordinence
des sites interstitiels susceptibles d'être occupés par les ions oxygène
excédentaires ?
On considère en première approximation que le paramètre de maille de
l'uraninite non
stoechiométrique ne varie pas.
Quel est le mécanisme de non stoechiométrie effectivement adopté par un tel
compose
sachant que sa densité est égale à 11,0 ? Justifier.
3/11
En déduire la formule correspondante de cet oxyde.
II-6 D'après le résultat précédent, quel est le sens d'évolution éventuelle du
paramètre de maille a
naturellement attendu ? Justifier.
En fait, il se produit une diminution du paramètre de maille de l'uraninite
quand son écart à la
stoechiométrie augmente.
Justifier en quoi cette variation résulte finalement de la nécessité de devoir
conserver
l'électroneutralité de la structure.
III-- L'uranium en solution aqueuse diluée
L'évaluation de la radiotoxicité potentielle de l'uranium nécessite de
connaître très précisément le
comportement de cet élément en solution. En effet, la migration et la mobilité
de l'uranium dans la
biosphère sont conditionnées d'une part par sa propension à passer en solution,
et d'autre part par
les espèces qu'il est susceptible de former en fonction de son nombre
d'oxydation.
On se propose de décrire dans la suite le comportement en milieu aqueux de
l'uranium, en l'absence
de ligands complexants autres que les ions hydroxyde, pour une concentration
totale en uranium
dissous de co = 1,00.10'7 mol.L".
2+
L'espèce aqueuse UOz(aq) peut former par hydrolyse des complexes solubles selon
les équations de
réaction :
UOâiaq) + 2 H2O : UOz(OH)2(aq) + 2 H+ de constante d'équilibre 52 = 10"11
UOÊÎaq) + 3 H20 : UO2 (OH)3(aq) + 3 H+ de constante d'équilibre B:, = 10"9'5
De même l'espèce aqueuse UÎ,ÏÜ est sujette à la réaction d'hydrolyse suivante :
UÏaÏI) + 4 H20 = U(OH)4(,q) + 4 H+ de constante d'équilibre BL, = 10"6
et U4+ peuvent également conduire à des précipités selon les réactions :
- 2+
Les ions UO (aq)
2(aq)
uoâgaq) + 2 HO" = vo,(on),(s)
Uf,';,, + 4 HO" = U(on)4(5,
Les produits de solubilité associés à ces précipités sont : sz2 (UOZ(OH)2(S)) =
24
sz'4 (U(OH)4...> = 49
4+
(aq)
U(OH)4(aq), mais cet hydroxyde est susceptible de précipiter (formation de
U(OH)4(S)).
III-1 D'après les données précédentes, l'espèce U en solution est en équilibre
avec le complexe
Montrer que ce précipité ne peut pas se former dans le cas où la concentration
totale en U(IV )
en solution est de c0=1,00.10'7 mol.L". _ _ .
Un résultat identique est obtenu pour U(VI), concernant la préc1p1tat10n de
l'espèce UO2 (OH)2 .
III-2 On se propose d'établir le diagramme potentiel--pH de l'uranium en se
limitant au domaine de
stabilité thermodynamique de l'eau. Pour cela, on considérera une concentratmn
totale en
espèces dissoutes égale à co et, selon le pH et le potentiel, on se limitera
tOU_]OUI'S a deux
formes présentes uniquement.
La frontière délimitant les domaines de predomrnance correspond a
lequrpartrtron de
l'élément entre les deux espèces solubles.
4/11
En se basant sur les résultats de la question III--1 et en utilisant les
données fournies en fin de
partie, donner les espèces à prendre en compte pour une concentration co =
1,00.10'7 mol.L".
Quels sont les nombres d'oxydation qui interviennent pour ces différentes
espèces ?
Etablir le tableau de prédominance des différentes espèces en solution
intervenant pour
chaque nombre d'oxydation de l'uranium en fonction du pH. Préciser les valeurs
des pH aux
frontières verticales.
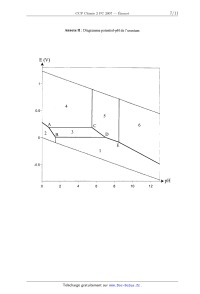
III-3 Attribuer à chaque domaine du diagramme potentiel--pH fourni en annexe II
l'espèce
prédominante correspondante.
Calculer, en fonction du pH, les équations des segments de droite correspondant
aux
frontières [AB] et [CD].
III--4 Ecrire l'équilibre de dismutation de l'espèce UOË(3q) qui a lieu à pH
très acide. Calculer sa
constante d'équilibre.
Le diagramme potentiel--pH étudié précédemment permet notamment de déterminer
le domaine de
stabilité de l'espèce uraner UOÊE",... pour des concentrations proches de
celles qui pourraient être
rencontrées dans des eaux souterraines ayant été en contact avec des colis de
déchets radioactifs. En
effet, l'espèce uraner peut facilement se trouver stabilisée sous la forme de
complexes, ce qui a
pour conséquence d'accroître sa solubilité et de faciliter sa migration jusqu'à
une assimilation
biologique par des organismes vivants.
DONNEES
Masses molaires atomiques (g.mol'l) : 0 U
16,0 238,0
Masse volumique de l'eau à 298 K : 1,00 kg.dm'3
Constante des gaz parfaits : R = 8,314 J.mol'1 K"1
Nombre d'Avogadro : N = 6,022.1023 mol"1
Enthalpies molaires standard de formation AfH° en kJ.mol'1 et entropies
molaires standard S...° en
J.K".mol'l à 298 K :
...un...
...
Potentiels redox standard à 298 K :
U0â"f"/U4+ UOÊ'/UOË U03/U'4+ 02/H20 H,0/H2
E°(V) ___--__
]
Constante à 298 x : RTË' 0 = 0,06 v
Autoprotolyse de l'eau à 298 K : 2 H20 = H30+ + HO_ pKEUR = 14
5/11
Annexe I : Diagramme d'Ellingham de l'uranium
ArG°(T) (kJ.mol'l)
.......................................................................................................
......................................................................................................
.......................................................................................................
4000 T (K)
900 950 1000 1050 1100
6/11
Annexe II : Diagramme potentiel-pH de l'uranium
E (V)
A
1_ ...................
4 ...................
0.5" ............
5
.\A C 6
2 \B 3 D
O_ .....
......... L
.............. E
uuuuuuuuuuuuuuuu 1
"0.54 ...................
0 2 4 6 8 10 12
7/11
Partie B : Synthèse totale du (-)--dactylolide
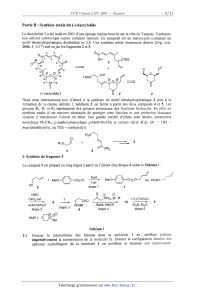
Le dactylolide 1 a été isolé en 2001 d'une éponge marine trouvée sur la côte du
Vanuatu. Il présente
une activité cytotoxique contre certaines tumeurs. Ce composé est un macrocycle
contenant un
motif tétrahydr0pyranique disubstitué en 2,6. Une synthèse totale récemment
décrite (Org. Lett.
2006, 8, 1117) met en jeu les fragments 2 et 3.
O
(-)-dacty|olide 1
Nous nous intéresserons tout d' abordà la synthèse du motif tétrahydropyranique
2 puis à la
formation de la chaîne latérale. L' aldéhyde2 est formé à partir des deux
composés 4 et S. Les
groupes R1, R2 et R3 représentent des groupes protecteurs des fonctions
hydroxyle. En effet en
synthèse totale, il est souvent nécessaire de protéger cette fonction et une
protection classique
consiste à transformer l'alcool en éther. Une grande variété d'éthers sont
décrits, notamment
benzylique Ph-CH2, p--méthoxybenzylique p-Me0-Ph-CH; et surtout silylé RèSi (R'
= TBS =
tbutyldiméthylsilyl, ou TES = triéthylsilyl).
R30
0 \
__;--
R1O\)l + ________ 2
OR2
4 5
1- Synthèse du fragment 5
Le composé 5 est préparé en cinq étapes à partir de l'alcool éthylénique 6
selon le Schéma 1.
NaH oJ_/ _/_//
HO{:/ + MeO--O--CHz-CIT Mao--®:CHe-O =----: PMBO
étapHe 1
NMO ' 0 @ ©
0504 cat. ? )K/PPhsi Br P CF3COOSiEt3
___, & ___-___ {\CHo ... 5
acétone/HZO 't 3 OPMB Base MeCN Et3N, Et20
étape 2 e ape 9 étape 4 étape 5
NMO= O/--\®: 09
\__/ Me
Schéma 1
I--1 Préciser la stéréochimie des liaisons dans la molécule 1 en justifiant
(utiliser
impérativement la numérotation de la molécule ]) Donner la configuration
absolue des
carbones asymétriques de la molécule 1 en justifiant et dessiner son
énantiom'ere.
8/11
I--2 Comment déterminer l'activité optique d'une molécule ?
La première étape de la synthèse est la protection de la fonction alcool du
but-3-èn-l--ol 6 par le
groupe p--méthoxybenzyle noté PME.
I--3 Quels sont les effets électroniques des groupements ---OMe et ----CH2C1
dans la molécule de
chlorure de p--méthoxybenzyle. En déduire où se positionnerait un groupe
électrophile lors
d'une nouvelle substitution sur le cycle ? Justifier clairement la réponse.
I--4 A quel type de réaction appartient l'étape 1 de la synthèse ? Représenter
le mécanisme de la
réaction en justifiant.
Pour accélérer la première étape de la synthèse, un sel, l'iodure de
tétrabutylammonium est
additionné en quantité catalytique au milieu réactionnel.
I--5 Prévoir à l'aide de la méthode VSEPR la géométrie du cation
tétrabutylammonium.
I-6 Quel est le produit formé intamédiairement ? Pourquoi observe-t--on une
accélération de la
réaction ? Justifier le rôle de catalyseur de Bu4W Î .
I--7 Pourquoi est--il nécessaire de protéger la fonction alcool dans le composé
6 ? Illustrer cette
notion de groupe protecteur avec une fonction différente de la fonction alcool
et préciser dans
quelles conditions cette protection peut être employée. Ecrire l'équation de
réaction sur un
exemple.
L'alcool protégé 7 est soumis à l'action du tétraoxyde d'osmium dans un milieu
acétone-eau. Le
tétraoxyde d'osmium étant un composé très toxique, il est utilisé en quantité
catalytique en présence
d'un co--oxydant tel que le N--oxyde de N--méthylmorpholine (NMO). La réaction
conduit au
composé 8 qui, par un traitement convenable, fournit l'aldéhyde 9.
I-8 Proposer une structure de Lewis pour Os04. Quel est le nombre d'oxydation
de l'osmium
dans cet oxyde ?
I--9 Donner la structure du composé 8. Pourquoi est--il nécessaire d'utiliser
un mélange de solvant
dans cette étape ?
I-10 Proposer un réactif permettant d'obtenir l'aldéhyde 9.
L'aldéhyde 9 est transformé en composé 10 par action d'un sel de phosphonium P.
H] Ecrire la formule de l'intermédiaire P' formé par action d'une base sur le
réactif P. Citer une
base pouvant être utilisée. Ecrire l'équation de réaction de l'aldéhyde 9 avec
l'intermédiaire
P'. Quel est le nom de cette réaction ?
I--12 Représenter les stéréoisomères du produit 10. Quel est le stéréoisomère
le plus stable ? A
quelle famille chimique appartient--il ?
I--13 Ecrire l'équilibre céto-énolique du composé 10.
L'action du trifluoroacétate de triéthylsilyle CF 3COOSiEü, sur l'énol de 10
permet la protection du
groupe hydroxy1e et l'obtention du fragment 5.
LM Représenter la formule semi--développée de CF3COOSiEt3. Ecrire le
déplacement des
électrons dans la liaison Si-O. Proposer un mécanisme pour la réaction de
l'énol avec
CF3COOSiEt3 en supposant que le silicium possède une réactivité analogue au
carbone.
Ecrire la formule du composé 5.
9/11
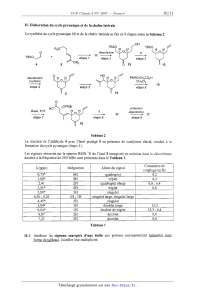
II-- Elaboration du cycle pyranique et de la chaîne latérale
La synthèse du cycle pyranique 12 et de la chaîne latérale se fait en 9 étapes
selon le Schéma 2.
R30
0 \
TBSO\/H +
4
déprotecfion PMBOCH2COZH
oxydation CHZCl2
___--___... -----------l-- ""'--_" "" 1 5
étape 4 étape 6
protection
Base, THF ? 17 déprotecfion _
étape 7 étape 8 étape 9
Schéma 2
La réaction de l'aldéhyde 4 avec l'énol protégé 5 en présence de catalyseur
chiral, conduit à la
formation du cycle pyranique (étape 1).
Les signaux observés sur le spectre RMN 1H de l'énol 5 enregistré en solution
dans le chloroforme
deutéré àla fréquence de 250 MHz sont présentés dans le Tableau 1.
, . . Constantes de
___--_
__--
___--_
__-_
___--_
Tableau 1
II--1 Attribuer les signaux marqués d'une étoile aux protons correspondants
(présenter sous
forme de tableau). Justifier leur multiplicité.
10/11
II-2 Par analogie avec la réaction de Diels et Alder, identifier le diène et le
diénophile. Donner la
structure du composé 11. Représenter l'approche des réactifs et justifier la
stéréochimie
obtenue.
L'étape 2 est une étape de coupure sélective des éthers p--méthoxybenzyle et
triéthylsilyle (ou
déprotection des fonctions hydroxyle).
II--3 Quel produit est obtenu après déprotection ? Expliquer la formation du
composé 12.
II-4 Par analogie avec le cyclohexane, représenter la conformation privilégiée
du composé 12 en
indiquant clairement la position des groupes substituants. Justifier la réponse.
II--5 Proposer une synthèse (en une ou plusieurs étapes) du diène 13 à partir
de l'alcool 12.
Préciser les réactifs nécessaires à chaque étape.
Après déprotection de la dernière fonction alcool par le fluorure de
tétrabutylammonium, l'alcool
obtenu est oxydé en aidéhyde 2 (étape 4).
II--6 Ecrire la structure du réactif permettant de transformer 2 en alcool 14.
Rappeler les conditions
opératoires et le schéma mécanistique de la réaction.
II-7 Un mélange de stéréoisomères est formé. Préciser la relation qui les
relie. Proposer une
méthode physico--chimique permettant d'obtenir l'isomère ayant la bonne
stéréochimie.
II-8 Ecrire l'équation de réaction conduisant au composé 15. Quelle(s)
méthode(s) permettrai(en)t
d'augmenter le rendement ?
II--9 Quel est l'atome d'hydrogène le plus acide dans le composé 15 ?
Justifier. Proposer un
mécanisme pour la transformation du composé 15 en composé 16 dans les
conditions de la
réaction.
II-10 Rappeler le réactif et les conditions opératoires pour transformer un
ester en alcool. Dans les
mêmes conditions, l'acide 16 conduit à l'alcool 17. Donner la structure du
composé 17.
Le fragment 2' est obtenu après protection de l'alcool primaire et coupure du
groupe
p--méthoxybenzyle. L'étape finale de la synthèse du (-)--dactylolide met en jeu
le couplage des
fragments 2' et 3 avec une inversion de configuration en 019.
DONNEES
RMN 1H : gamme des déplacements chimiques et constantes de couplage
proton-proton :
---- -CHz--CHz- -CHz-CH=
___--_--
2,6--2,8 323.41 3,639 4,5-6,8 _
Constantes H H H. .H .H
Electronégativité (Echelle de Pauling): Si
1 8 30,5
Numéros atomiques : Os : Z = 76
0 : Z = 8
Fin de l'énoncé
11/11