CCINP Chimie 2 PC 2014
| Thème de l'épreuve | Quelques applications de la chimie des complexes des métaux de transition. Approche synthétique de l'andrastine C. |
| Principaux outils utilisés | atomistique, chimie organique, diagrammes E-pH, solutions aqueuses, thermochimie |
| Mots clefs | complexes, métaux de transition, fer, cobalt, hydroformylation, pH du sang, andrastine C |
Corrigé
:👈 gratuite pour tous les corrigés si tu crées un compte
👈 l'accès aux indications de tous les corrigés ne coûte que 1 € ⬅ clique ici
👈 gratuite pour tous les corrigés si tu crées un compte
- - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - -
👈 gratuite pour ce corrigé si tu crées un compte
- - - - - - - - - - - - - - - - -
Énoncé complet
(télécharger le PDF)













Rapport du jury
(télécharger le PDF)






Énoncé obtenu par reconnaissance optique des caractères
SESSION 2014 PCCH209
.::=_ CONCOURS COMMUNS
POLYTECHNIQUES
EPREUVE SPECIFIQUE - FILIERE PC
CHIMIE 2
Durée : 4 heures
N.B. : Le candidat attachera la plus grande importance à la clarté, & la
précision et à la concision de
la rédaction. Si un candidat est amené à repérer ce qui peut lui sembler être
une erreur d 'énonce', il le
signalera sur sa copie et devra poursuivre sa composition en expliquant les
raisons des initiatives
qu 'il a été amené à prendre.
Les calculatrices sont autorisées
Les parties A et B sont indépendantes et dans chacune d'elles, certaines
questions
peuvent être traitées séparément.
Toute démonstration illisible ou incompréhensible sera considérée comme fausse.
Le sujet est constitué de deux parties, elles-mêmes constituées de
sous--parties, largement
indépendantes.
La partie A traite de quelques aspects de la chimie des métaux de transition,
en particulier des
complexes de ces métaux. L'accent est mis ici sur deux métaux, le cobalt et le
fer.
La partie B traite d'une approche synthétique récente de l'andrastine C,
molécule naturelle
appartenant à une nouvelle famille d'antitumoraux potentiels. Cette approche
permet de
construire le squelette tétracyclique caractéristique de l'andrastine C en 36
étapes.
1/15
PARTIE A :
quelques applications de la chimie des complexes des métaux de transition
Nous nous intéressons ici à la chimie des complexes des métaux de transition,
en mettant
l'accent sur deux métaux, le cobalt et le fer. Quelques caractéristiques
géométriques de
complexes du cobalt sont étudiées dans une première partie (A.], questions A1.1
à A1.9). Ces
complexes sont importants dans l'industrie, puisqu'ils peuvent catalyser un
certain nombre de
réactions. L'étude d'une réaction d'hydroformylation catalysée par un complexe
de cobalt fait
l'objet des questions A1.10 à A1.14. Les complexes du fer sont connus pour la
variabilité de
leurs nombres d'oxydation (deuxième partie A.2, questions A2.1 à A2.4). Ils
sont également
d'une importance considérable en biologie. Un exemple bien connu est celui de
l'hémoglobine présente dans le sang et qui assure le transport du dioxygène.
Quelques aspects
de la chimie de l'hémoglobine font l'objet des questions A2.5 à A2.9.
Les différentes sous-parties sont largement indépendantes.
Données :
Numéros atomiques Z :
Elément C 0 Co
Numéro atomique Z 6 8 27
. . _1
Masses mola1res atom1ques (en g.mol ) :
Elément H N O S C1 C0
Masse molaire _1 130 1430 16,0 32,0 3535 59,0
atom1que (g.mol )
Constante des gaz parfaits : R 8,314 J mol ' K 1
Pression standard 190 = 1 bar.
A 298 K :R--FTlnx 0,06logx en volts.
Densité de l'acide sulfurique d = 1,83.
pKa1 (H2CO3/HCO3-) : 6,1
pKa2 (CH3CHOHCOOH/CH3CHOHCOO') = 3,9.
Al. Etude de quelques complexes du cobalt
.<> Géométrie, stéréochimie et chimie en solution aqueuse de quelques complexes
du cobalt
Le cobalt (Il) peut former des complexes avec différents ligands, par exemple
Co (H,O)Ê et
C0 (Cl)î avec les ligands eau et chlorure. Ces deux complexes sont colorés. Le
maximum de
l'absorbance du premier complexe se situe à 540 nm ; le maximum du second à 670
nm.
2/15
A1.1 Qu'est-ce qu'un élément de transition '?
A1.2 Ecrire la configuration électronique du cobalt Co, ainsi que des ions Co2+
et Co3+, dans
leur état fondamental. Combien d'électrons de valence chacune de ces trois
espèces possède-t-
elle '?
A1.3 Quelle est la couleur de chaque complexe '? Justifier.
On rappelle que le spectre visible correspond à des longueurs d'onde allant de
390 nm (violet)
à 780 nm (rouge).
On s'intéresse maintenant àla géométrie et àla stéréochimie de complexes du
cobalt (II) et du
cobalt (III).
A1.4 Représenter, sur la copie, le complexe Co (HZO)Ê en montrant sa structure
tri-
dimensionnelle et le nommer.
A1.5 Des réactions de substitutions successives du ligand H2O par le ligand NH3
peuvent
avoir lieu et mener àla formation de six complexes de type :
Co (NH3 )n (HZO)Ê n avec n entier, n = 1....6.
Pour n = 1, 2 et 3, dénombrer et dessiner tous les stéréoisomères possibles.
Préciser, en
justifiant, si ces complexes sont chiraux.
A1.6 On s'intéresse maintenant au ligand éthylènediamine, noté en, de formule
semi-
développée NH,CH,CH,NH2 .
Al.6a Quelle différence y-a-t-il entre le ligand éthylènediamine et le ligand
ammoniac '?
Al.6b On considère maintenant les deux complexes suivants: Co(en)(NH3 )î et
Co(en)î .
Dessiner les stéréoisomères possibles de chacun de ces complexes. Y a-t-il un
(des)
complexe(s) chiral (chiraux) '? Justifier.
Dans ce qui suit, on étudie le complexe{Co (Cl)(NH3 )5]Cl2 . Ce complexe est
synthétisé au
préalable sous forme d'un sel solide et on cherche à le caractériser en
déterminant, par
exemple, sa masse molaire. Pour cela, une masse m = 0,10 g du solide est
dissoute dans l'eau
et la solution obtenue est mise en contact avec une résine échangeuse de
cations. Cette résine
a été au préalable plongée dans une solution d'acide chlorhydrique, ce qui
permet à des ions
H+ de se fixer sur la résine. Quand la solution de complexe est introduite, un
échange de
cations se produit et les ions Co (Cl)(NH3 )î se fixent alors sur la résine.
A1.7 Ecrire l'équation de la réaction d'échange des ions sur la résine.
A \ . . , . , _ + , ,
Par entrainement a l'eau distillée, on recueille ensuite tous les ions H
echanges dans un
3 ' \ .
volume total de 100 cm . On preleve alors un quart de cette solution que l'on
dose avec une
3/15
solution de soude de concentration molaire 0,020 mol.L". L'équivalence du
dosage est
repérée à l'aide de la phénolphtaléine et correspond à un volume de soude versé
de 10 cm3 .
A1.8 Déduire de ce protocole la quantité d'ions Co (Cl)(NH3 )î présents
initialement dans
la solution.
A1.9 En déduire la masse molaire du complexe{Co (Cl)(NH3)S]ClZ. Est-ce le
résultat
attendu '?
<> Un complexe de cobalt comme catalyseur de la réaction d'hydroformylation
Dans tout ce qui suit, les gaz sont considérés comme parfaits.
A1.10 Les complexes des métaux de transition sont souvent utilisés comme
catalyseurs, que
ce soit en catalyse homogène ou hétérogène. Un exemple est celui de la réaction
d'hydroformylation qui consiste à faire réagir un alcène avec un mélange de
monoxyde de
carbone et de dihydrogène sous pression pour former un aldéhyde. Cette réaction
doit en
partie son nom au formaldéhyde, car tout se passe comme s'il y avait addition
de méthanal,
appelé aussi formaldéhyde, sur la double liaison.
Un exemple de ce type de transformation est donné dans le cas du propène selon
l'équation de
réaction ci-dessous :
CH3-CH=CH2(g) + CO(g) + H2(g) = C4HgOoe).
Le produit C4HgO est en réalité le mélange d'un aldéhyde linéaire (le butanal)
et d'un
aldéhyde ramifié (le 2-méthylpropanal).
. ... . ... ......Æ°=-150kJ.mol".
Cette réaction est importante industriellement et le but de cette partie est
d'analyser les
différents paramètres utilisés pour optimiser la formation des aldéhydes par
hydroformylation.
A1.10a Industriellement, la réaction a lieu à température élevée. Pourquoi '?
A1.10b A température et composition fixées, quel est l'effet d'une augmentation
de la
pression totale sur l'état d'équilibre '? Quel est l'effet d'une augmentation,
à température et
volume constants, de la quantité initiale d'alcène '? On justifiera les
réponses en raisonnant
avec l'affinité chimique.
On part d'un mélange initial contenant 300 moles de propène, 100 moles de
monoxyde de
carbone et 100 moles de dihydrogène dans une enceinte indéformable. A l'état
d'équilibre, 60
moles de propène ont été transformées en aldéhyde. La température est fixée à
550 K. La
pression totale est de 30 bar.
A1.11 Donner le schéma de Lewis du monoxyde de carbone CO. Commenter.
A1.12 Calculer la valeur de la constante d'équilibre de la réaction à 550 K et
la valeur de
l'enthalpie libre standard de la réaction à 5 5 0 K.
4/15
A1.13 On se place dans l'approximation d'Ellingham.
A1.13a Rappeler les hypothèses de cette approximation.
A1.13b Déterminer la valeur de l'entropie standard de la réaction à 550 K.
Commenter son
signe.
A1.14 Le procédé industriel classique utilise un catalyseur à base de cobalt,
l'hydrure de
cobalt tétracarbonyle HCo(CO)4.
A1.14a Qu'est-ce qu'un catalyseur '?
A1.14b Tracer le diagramme d'énergie potentielle correspondant à une réaction
que l'on
supposera endothermique. Montrer comment ce diagramme est modifié en présence
d'un
catalyseur. Faire apparaitre un (des) intermédiaire(s) réactionnel(s) et un (ou
des) état(s) de
transition.
A1.14c L'utilisation du catalyseur au cobalt dans la réaction
d'hydroformylation correspond à
une catalyse homogène. Quelle est, industriellement, la difficulté principale
liée à une catalyse
homogène '?
A2. Etude de complexes du fer
.<> Tracé d'une partie du diagramme potentiel-pH du fer
Dans cette partie, on utilisera les constantes de formation des deux complexes
solubles
[Fe(SO4)+] et [FeSO4] qui valent respectivement KB = 104"1 et Kg = 102'6. On
rappelle que le
complexe [Fe(SO4)+] est formé à partir de l'ion fer(lll) tandis que le complexe
[FeSO4] dérive
de l'ion fer(ll).
Il est possible de mesurer expérimentalement les variations du potentiel
d'oxydoréduction de
certains couples en fonction du pH. On enregistre pour cela la valeur du pH de
la solution et la
différence de potentiel entre une électrode indicatrice et une électrode de
référence
On travaille ici à 298 K avec une solution de volume V = 1 L contenant 1,0x10'2
mole de
sulfate ferreux (FeSO4), 1,0x10'2 mole de sulfate ferrique (Fe2(SO4)3) et 5 cm3
d'acide
sulfurique concentré Un volume V0 = 100 cm3 de cette solution est ensuite versé
dans un
bécher. Trois électrodes (électrode de verre; électrode de platine; électrode
au calomel
saturée) sont alors immergées dans ce bécher.
L'acide sulfurique est considéré comme un diacide fort.
A2.] Préciser le rôle de chaque électrode.
A2.2 Quelle est la concentration molaire des ions sulfate SO42' dans la
solution initiale ?
A2.3 Montrer qu'à l'état initial, la quasi-totalité des ions fer(lll) sont
présents sous la forme
du complexe FeSO4+ et que plus de 95 % du fer(ll) est complexé par les ions
sulfate. On
donnera la concentration à l'équilibre de toutes les espèces solubles du fer.
5/15
A2.4 Le potentiel mesuré dans la solution initiale est de 0,67 V/ENH. En
déduire la valeur
du potentiel standard du couple Fe(aq)3+/Fe(aq)2+.
Une solution de soude très concentrée (environ 10 mol.L") est ajoutée dans le
bécher. Après
chaque addition de soude, le pH de la solution et son potentiel sont mesurés.
La soude étant
concentrée, on néglige la dilution dans la question suivante.
L'apparition d'un précipité est observée pour un pH égal à 3,5. L'expérience
est poursuivie
jusqu'à une valeur de pH environ égale à 7.
A2.5 Le potentiel mesuré est constant jusqu'à une valeur de pH égale à 3,5 puis
il décroît
linéairement. La partie décroissante de la courbe est due à l'accumulation d'un
précipité
d'hydroxyde de fer(lll), Fe(OH)3(S).
Quelle est la valeur de la pente '? Justifier. Calculer le produit de
solubilité de l'hydroxyde de
fer(lll). On raisonnera avec les ions Fe(aq)2+ et Fe(aq)3+.
Dans la suite du problème, on s'intéresse à l'hémoglobine, symbolisée par << Hb >>.
L'hémoglobine est une protéine, dont la principale fonction est le transport du
dioxygène dans
l'organisme humain et chez les autres vertébrés. L'hémoglobine se trouve
essentiellement à
l'intérieur des globules rouges du sang.
Dans l'hémoglobine, on trouve, entre autres, l'héme qui est constitué d'un ion
fer au degré
d'oxydation Il, complexé par une porphyrine (voir schéma 1 ci-dessous). L'ion
fer est fixé au
centre de la porphyrine grâce à l'interaction avec les atomes d'azote. C'est à
cet ion que se
fixe le dioxygène lors de l'oxygénation du sang.
CH
/2
CH2
/
H3C
H3C
0 OH 0
Schéma 1 : structure de l'héme de l'hémoglobine
.<> Régulation du pH sanguin
Dans ce qui suit, on assimile le sang à une solution aqueuse ionique dont le
pH, d'une valeur
voisine de 7,4, est quasiment constant et ne peut subir que de très faibles
variations. La
régulation de ce pH provient essentiellement du couple H,CO3 /HCO3 dont les
deux espèces
sont présentes dans le sang.
A2.6 Quelle est la valeur du rapport [HCO3 ]/[H,COJ dans le sang '?
A2.7 Qu'est-ce qu'une solution tampon? Proposer trois méthodes de fabrication
d'une
solution tampon.
6/15
Dans certains cas, après des efforts physiques intenses, des crampes
apparaissent. Il se forme
alors dans les muscles de l'acide lactique (CHgCHOHCOOH) qui est transféré dans
le sang et
qui réagit avec les ions hydrogénocarbonate.
A2.8 Ecrire l'équation de la réaction correspondante et déterminer la valeur de
sa constante
d'équilibre.
A2.9 Dans le sang, avant l'effort musculaire, les concentrations des
différentes espèces sont
les suivantes : {HCG3 ] = 2,7 x 10 2mol.L 1 et [H,COJ : 1,4 x 10 3mol.L 1. Dans
un volume
de 100 mL de sang apparaît alors après l'effort 3,0.10'4 mole d'acide lactique.
Faire le bilan
de matière des différentes espèces présentes dans le sang après l'effort et en
déduire alors la
valeur du pH local du sang. Conclure.
A2.10 Afin d'éviter cette variation du pH sanguin, l'hémoglobine (notée Hb),
ainsi que le
phénomène de respiration, interviennent pour éliminer l'excès de dioxyde de
carbone dissous
(on rappelle que le dihydrogénocarbonate correspond à du dioxyde de carbone
dissous dans
l'eau). Les échanges entre les gaz dissous dans le sang peuvent être modélisés
par la réaction
d'équation :
Hb02 (aq) + CO2 (aq) = HbCO2 (aq) + 02 (aq)-
Expliquer comment la respiration permet de maintenir constante la valeur du pH
sanguin.
7/15
PARTIE B : approche synthétique de l'andrastine C
Pour l'écriture des mécanismes, a chaque fois qu'il le juge nécessaire, le
candidat pourra
utiliser des notations simplifiées des molécules lui permettant de ne se
concentrer que sur les
groupes caractéristiques concernés. Les données spectrales sont mentionnées en
fin de sujet.
Les andrastines A--D sont des molécules naturelles de structure tétracyclique
(figure 1),
inhibitrices de l'enzyme famésyl transférase. Depuis leur découverte en 1996
dans des
cultures de Penicillium sp. FO-3929, ces molécules ont montré leur capacité
d'inhibition de la
famésylation d'un certain nombre de protéines intracellulaires. Des résultats
précliniques ont
ainsi révélé leur efficacité dans l'inhibition de la prolifération cellulaire
tumorale, in vitro
comme in vivo, ce qui en fait de bons candidats pour le traitement de divers
cancers.
Ri.--
andrastine A : R1 = OAc, R2 = H, R3 = CHO
andrastine B : R1 = OAc, R2 = H, R3 = CH20H
andrastine C : R1 = OAc, R2 = H, R3 = Me
andrastine D : R1 = R2 = O, R3 = CHO
Figure 1
Du fait de leurs propriétés biologiques, ces molécules constituent des cibles
de choix pour les
chimistes organiciens. Dans ce contexte, en 2013, deux équipes de chercheurs
japonais ont
décrit une approche synthétique de l'andrastine C (The Journal of Organic
Chemistry 2013,
78, 93--103) en préparant le composé 28 a partir de la
2-méthylcyclohexane-l,3-dione 1 via
les intermédiaires 7, 15 et 23 (schéma 1) :
Schéma 1
8/15
BI. Synthèse de l'intermédiaire 7
La 2-méthylcyclohexane-l,3-dione 1 réagit avec une solution d'éthanolate de
sodium
(EtONa) dans l'éthanol (EtOH) pour donner un anion 2 (schéma 2) :
EtONa
_) 2
O O EtOH, A
1
Schéma 2
B1.1 Représenter l'anion 2. Expliquer pourquoi il est formé sélectivement.
Le composé bicyclique 5 peut être obtenu sous la forme d'un mélange racémique à
partir de
l'anion 2 en suivant la séquence réactionnelle ci-dessous (schéma 3) :
0 EtOH EtONa
2 + \
3 EtOH, A
4(racémique) 5 (racémique)
Schéma 3
B1.2 Proposer un mécanisme réactionnel rendant compte de la formation du
composé 4 à
partir de l'anion 2 et de la méthylvinylcétone 3.
B1.3 Le produit bicyclique 5 est obtenu sous la forme d'un mélange racémique.
Représenter
tous les composés du mélange obtenu en convention spatiale de Gram et indiquer
leurs
proportions relatives.
B1.4 Proposer un mécanisme réactionnel rendant compte de la formation du produit
bicyclique 5. Quels noms portent les réactions impliquées dans cette
transformation '?
Le composé 5 peut également être préparé en utilisant la L-proline 6 à la place
de l'éthanolate
de sodium. L'intermédiaire 7 est ainsi obtenu sous la forme d'un unique isomère
(schéma 4) :
0 QCOzH 6 . ° O
H 0 __.
+ VK > ' _, 9 DJ
0 o
1 0 5 O 7
3
Schéma 4
B1.5 Pour l'intermédiaire 7 obtenu, on trouve dans la littérature [. ]D22 = --
35 deg.dm_l. g_1.cm3
dans le chloroforme (CHCl3). Quel nom porte le symbole [. ]D22'? Que signifie
le signe
<< moins >> devant le nombre 35 '?
9/15
B2. Synthèse de l'intermédiaire 15
Les auteurs préparent tout d'abord le composé bicyclique 9 à partir du composé
7 en deux
étapes décrites ci-dessous (schéma 5) :
/o
OEO MQ
° o cogH ° 0
2
V _»
" OJ MeOH, Hgo 0 "' MeOH
O 7 8
r
o
&
z
%
oz:
Schéma 5
B2.1 Quelle fonction organique est créée lors de la formation du produit 8 '?
B2.2 Proposer un mécanisme réactionnel rendant compte de la formation du
produit 9.
La déshydratation de l'alcool 9 à l'aide du trichlorure de phosphoryle (POCl3)
conduit ensuite
à l'alcène 10 en mélange avec un composé 10bis de même formule brute (schéma 6)
:
\) + 10bis + HOPOCI2 + HC!
10
C02M9
Schéma 6
B2.3 Dans la molécule de trichlorure de phosphoryle (POCl3), l'atome de
phosphore est lié
aux trois atomes de chlore et à l'atome d'oxygène. Donner son schéma de Lewis.
Quelle
géométrie peut être déduite de la méthode VSEPR pour cette molécule '? Indiquer
la valeur
théorique des angles de liaison.
B2.4 Représenter le produit 10bis.
10/15
Les auteurs obtiennent ensuite l'intermédiaire 15 a partir de l'alcène 10 selon
la séquence
réactionnelle suivante (schéma 7) :
tugâoscÊllé
OJ toluène 14
+>-- "
Schéma 7
B2.5 Proposer une séquence de réactions permettant d'obtenir l'aldéhyde 11 a
partir du
composé 10.
B2.6 Les auteurs décrivent le spectre de résonance magnétique nucléaire du
proton
(RMN 1H) du produit 11 obtenu à 400 MHZ dans le chloroforme deutéré (CDCh). Ce
spectre
présente, entre autres, deux signaux caractéristiques dont les déplacements
chimiques
, (exprimés en ppm, partie par million), les multiplicités, les constantes de
couplage et le
nombre d'hydrogènes correspondants sont donnés ci-dessous :
1,75 (singulet large, 3 H)
9,70 ppm (t, 3J= 2 Hz, 1 H).
Attribuer chacun des signaux à un ou des atomes d'hydrogène caractéristiques du
composé 11
en RMN 1H. Justifier la multiplicité du signal à 9,70 ppm.
B2.7 Proposer un réactif permettant d'obtenir le produit 12 a partir de
l'aldéhyde 11.
B2.8 Le composé 12 conduit rapidement au triène 13 qui, chauffé à 230 °C en
tube scellé,
donne un produit tétracyclique 14 de même formule brute que le triène 13.
Représenter le
produit 14 (on ne s'intéressera pas àla stéréosélectivité de la réaction).
11/15
B.3. Synthèse de l'intermédiaire 23
Tout d'abord, le composé tricyclique 20 est synthétisé à partir de
l'intermédiaire 15, selon la
suite de réactions ci-dessous (schéma 8) :
& CH3COZH
_)
0 H20
1. CSHSCHZOCH2Li 18
tétrahydrofuranne
-- 78 °C
> 19 _'_>
2' H20 C33*"54©3Si
C6H5
Schéma 8
B3.1 Dans la première étape, l'hydrolyse de la fonction acétal de 15 conduit au
produit 16.
Expliquer que] a été le rôle de cette fonction dans la synthèse du composé 15.
B3.2 Proposer une séquence réactionnelle permettant d'obtenir le composé 17 à
partir de la
cétone 16.
B3.3 Un organolithien présente une réactivité comparable à celle d'un
organomagnésien
vis-à-vis d'une cétone. L'organolithien 18 réagit ainsi avec la cétone 17 pour
donner le
produit 19 de formule brute C33H54038i après hydrolyse. Représenter le composé
19 (on ne
s'intéressera pas à la stéréosélectivité de la réaction).
Le composé tricyclique 20 permet ensuite d'accéder en trois étapes à
l'intermédiaire 23 selon
la séquence suivante (schéma 9) :
\
......
/
(1 équivalent)
V
NH (imidazole)
Schéma 9
12/15
B3.4 Proposer une séquence réactionnelle rendant compte de la transformation du
composé
20 en produit 21. Combien de stéréoisomères peuvent être formés lors de cette
transformation '? Justifier la réponse Représenter tous les stéréoisomères
formés en
convention spatiale de Gram. Quelle relation d'isomérie les lie '?
B3.5 L'imidazole utilisé dans la formation du produit 22 (schéma 9) est-il un
composé
aromatique '? Préciser lequel des deux atomes d'azote de l'imidazole possède le
caractère le
plus basique. Justifier les réponses.
B3.6 Le silicium se trouve en dessous du carbone dans la classification
périodique et
possède de ce fait une réactivité similaire. En considérant la réactivité du
silicium identique a
celle du carbone, proposer un mécanisme réactionnel rendant compte de la
formation du
produit 22 en précisant bien le rôle de l'imidazole. Justifier pourquoi seul un
groupe
hydroxyle de la molécule 21 réagit.
B3.7 Le spectre de l'intermédiaire 23 obtenu par spectroscopie infrarouge (IR)
présente,
entre autres, une bande d'absorption intense au nombre d'onde de 1 705 cm_l.
Proposer une
attribution de cette bande d'absorption a un (ou des) groupe(s)
caractéristique(s) présent(s)
dans l'intermédiaire 23.
B4. Accès à l'intermédiaire 28
La fin de la synthèse de l'intermédiaire 28 est effectuée en quelques étapes à
partir du
composé 23 (schéma 10) :
190 °C
Et3N
Schéma 10
13/15
B4.1 Proposer une séquence réactionnelle pour former l'alcène 24 à partir de la
cétone 23.
B4.2 Sachant que dans la molécule 25 la double liaison extracyclique est plus
réactive que
la double liaison intracyclique, proposer une méthode permettant d'obtenir
l'aldéhyde 26.
B4.3 A 190 °C et en présence de triéthylamine (Et3N), le composé tricyclique 26
conduit à
la formation du produit tétracyclique 27 via l'intermédiaire A (figure 2) :
Figure 2
B4.3a Donner une forme mésomère limite de la partie anionique de
l'intermédiaire A.
B4.3b Proposer un mécanisme réactionnel rendant compte de la formation du
produit 27 à
partir de l'intermédiaire A (on ne s'intéressera pas àla stéréosélectivité de
la réaction).
14/15
Données spectrales :
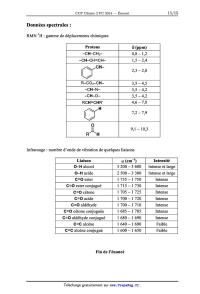
RMN 1H : gamme de déplacements chimiques
Protons @ (ppm)
--CH--CH2-- 0,8 -- 1,2
--CH--CH=CH-- 1,5 -- 2,4
CH--
2,3 -- 2,8
R--COZ--CH-- 3,5 -- 4,5
--CH--N-- 3,5 -- 4,2
--CH--O-- 3,5 -- 4,2
RCH=CHR' 4,6 -- 7,0
H
© 7,2 -- 7,9
0
JJ\ 9,1 -- 10,3
R H
Infrarouge : nombre d'onde de vibration de quelques liaisons
Liaison o (cm--l) Intensité
O--H alcool 3 200 -- 3 600 Intense et large
O--H acide 2 500 -- 3 300 Intense et large
C=C ester 1 735 -- 1 750 Intense
C=C ester conjugué 1 715 -- 1 730 Intense
C=C cétone 1 705 -- 1 725 Intense
C=C acide 1 700 -- 1 720 Intense
C=C aldéhyde 1 700 -- 1 710 Intense
C=C cétone conjuguée 1 685 -- 1 705 Intense
C=C aldéhyde conjugué 1 680 -- 1 690 Intense
C=C alcène 1 640 -- 1 690 Faible
C=C alcène conjugué 1 600 -- 1 650 Faible
Fin de l'énoncé
15/15