Centrale Chimie PC 2000
| Thème de l'épreuve | Étude des éther-couronnes et application à la chromatographie ; chimie du Nickel ; synthèse de la Sirénine |
| Principaux outils utilisés | atomistique, chimie organique, diagrammes E-pH, courbes intensité-potentiel, diagrammes binaires |
Corrigé
:👈 gratuite pour tous les corrigés si tu crées un compte
👈 l'accès aux indications de tous les corrigés ne coûte que 1 € ⬅ clique ici
👈 gratuite pour tous les corrigés si tu crées un compte
- - - - - - -
👈 gratuite pour ce corrigé si tu crées un compte
- - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - -
Énoncé complet
(télécharger le PDF)








Rapport du jury
(télécharger le PDF)

Énoncé obtenu par reconnaissance optique des caractères
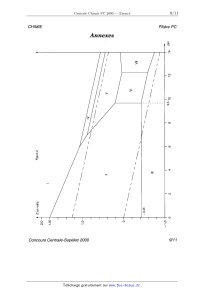
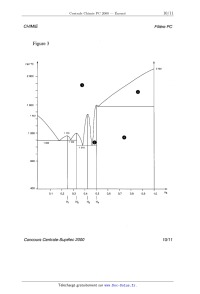
CHIMIE Filière PC CHIMIE Partie I - Les (ether-couronnes : recherche de ligands sélectifs pour les cations En 1987, le prix Nobel de chimie a été décerné, pour leur travail sur les éther- couronnes, à trois chercheurs : D.J. Gram, J.M. Lehn et C.J. Pedersen. Un des objectifs de leurs travaux était de mettre au point des ligands macrocycliques sélectifs pour différents ions. I.A - Étude de la sélectivité de l'êther--couronne 18C6 l/\0/\\ Un des ligands macrocycliques initialement préparé est l'éther-- [O 0) couronne 18C6 noté A : A forme des complexes avec les cations o @ alcalins ( Na+ , K+, Rb+ et Cs+) et alcalino-terreux (Ca2+ , Sr2+ et '\,O\) Ba2+ ) notés M '" selon l'équation-bilan : A A+Mn+ '...)5 (AM)"+ On note 0 la constante de formation 4 _ 0 de ces complexes. La figure 1 pré- sente, pour les deux familles de cations, la variation de lg 5 en fonc- tion du rapport rayon du cation 3 . () rayon de la cavité du macrocycle I.A.l) Donner la configuration électronique des atomes de calcium (Z = 20) et potassium (Z = 19) ainsi que celle des cations correspon-- 2 ' 0 dants. Comparer le rayon des deux cations et justifier le résultat. 1 . 5 Sélectivité de 18EUR 6 : valeurs de lg B dans l'eau à 25°C en fonction du rapport rayon du cation métallique sur rayon de la cavité. éÎ°Ë Rb K/o\) I.A.2) Décrire l'interaction qui peut exister entre le macrocycle A et 1 _ 0 un cation métallique. I.A.3) Commenter l'évolution de 0_ 5 lg ,B dans la série des alcalins. Pour quel cation l'éther--couronne 1806 est-il le plus sélectif dans la série des Figure 1 alcalins ? Concours Centrale-Supélec 2000 1/1 1 CHIMIE Filière PC Fil'ère PC I.B - Synthèse de deux éther-couronnes Le macrocycle B est pré- o paré par action d'un équi- o(\ /\ H2 100°C valent de catéchol (1, 2 - @ C(CZOH3606) dihydroxybenzène) et B @ RUO2 catalyseur d'un équivalent de 1, 5 - dichloro-3-oxapentane à reflux dans le butanol, en présence de deux équivalents d'hydroxyde de sodium pendant 24 heures. Cl \/\ /\/Cl 1,5-dichloro-3-oxapentane O I.B.l) Écrire l'équation-bilan de la synthèse de B . I.B.2) Quel est le rôle de l'hydroxyde de sodium ? Le mécanisme de formation de B fait intervenir plusieurs fois les mêmes types de transformation. Écrire ces transformations une seule fois en partant des réactifs ; on justifiera le mécanisme. I.B.3) Proposer une structure pour C , obtenu à partir de B (voir schéma ci- dessus). I.C - Application des éther-couronnes en chromatographie I.C.1) Rappeler brièvement le principe des techniques chromatographiques en utilisant un exemple de votre choix. Des éther--couronnes fixés sur une phase solide ont été utilisés pour réaliser des séparations de cations métalliques. De tels procédés peuvent être par exemple utilisés pour retraiter les produits d'oxydation d'un catalyseur de pot catalyti- que. La solution obtenue à partir de ces produits d'oxydation contient des ions Rh(IH) , Pt(IV) , Pd(II) , Cu(II) et Fe(III) dans une solution acide. L'éther-cou- ronne utilisé est sélectif pour le rhodium III, les autres cations n'étant quasi- ment pas complexés. Cet éther--couronne est lié de manière covalente à la silice, qui est utilisée pour préparer la colonne de chromatographie. 1.0.2) Première phase de la séparation du rhodium III : on place au-dessus de la colonne ainsi préparée la solution à purifier et on laisse s'écouler le liquide, que l'on récupère dans un erlenmeyer situé sous la colonne. La colonne est ensuite éluée par une solution acide, jusqu'au moment où plus aucun ion Concours Centrale--Supélec 2000 2/11 CHIMIE Filière PC n'arrive au bas de la colonne. Indiquer alors, en justifiant, où se trouvent les dif- férents ions initialement présents dans la solution à purifier. I.C.3) Deuxième phase de la séparation du rhodium III : la colonne est éluée par une solution contenant un ligand très puissant (thio-urée ou bromure). Sachant que les ions rhodium III sont alors récupérés en bas de colonne, en déduire le principe de cette élution. Partie II - Quelques propriétés du nickel et de ses composés Données : On prendra : %£lnx : 0,0610g... x = O, 06 lg x à 25° C et T(K) : t(°C)+273 Les potentiels standard sont indiqués à 25° C . E°(Zn2+/Zn) = --0,76 V E°(Cu2+/Cu) = +0,34 V E°(H*/H,) = 0 V E°(02/H20) = 1,23 V E°(Mg2+/Mg) = --2,37 V autoprotolyse de l'eau pKe : 14 R = 8, 31 J - mol_1 - K--1 Rayons atomiques : Ni :125 pm Cu : 128 pm Temperatures de fus1on sous Ni :14530 C Cu : 1083° (: P : 1bar Enthalpies standard de fusion (les valeurs sont données àla température de fusion sous P =1bar) Cu et Ni sont totalement miscibles à l'état liquide. II.A - Diagramme E -- pH du nickel La figure 2 (en annexe) donne le diagramme E -- pH du nickel, tracé en traits pleins. Ce diagramme a été établi à 25° C , en prenant en compte uniquement les espèces suivantes : Ni, Ni(OH)2, Ni304, Ni203, mo,, Ni2+, HNi05 . À l'exception des ions, toutes ces espèces sont solides. Convention adoptée pour le tracé des frontières : la concentration globale des espèces dissoutes est prise égale à C() = 10--6 mol -- L*1 . Sur la même figure sont portées, en traits pointillés, les droites correspondant aux couples de l'eau : 02/H20 et H +/ H 2. Ni :17, 48 kJ - mol--1 Cu :13, 26 kJ - mol'1 Concours Centrale-Supélec 2000 3/11 CHIMIE Filière PC II.A.1) Les différents domaines du diagramme sont numérotés de I à VII. Attribuer à chaque espèce son domaine de stabilité, en justifiant votre réponse. II.A.2) Déduire du diagramme la valeur du potentiel standard du couple N i2+/ N i , ainsi que la valeur du produit de solubilité de N i(OH )2 . II.A.3) On ne considère, dans cette question, que la partie du diagramme pour pH < 10 . a) Quelles sont les frontières dont l'équation est indépendante du choix fait pour la valeur de Co ? b) Comment est modifiée la frontière entre NiO2 et Ni2+ quand on passe de C0-- _ 10 6-mol L 1 à CO-- _ 1 mol- L 1 .Même question pour la frontière entre Ni2+ et Ni. c) Déduire des résultats précédents, en une phrase, l'influence de la valeur de C() sur le domaine de stabilité de N i2+ II. A. 4) On part d'oxyde nickélo- nickélique N 130 4 , on ajoute progressivement de l'acide. Qu' observe- t- -on. ? Écrire l'équation-bilan et calculer le potentiel à pH= 5 si on est parti de 0,02 mole de N 130 en suspension dans un litre d'eau. II.A.5) Que dire de la stabilité du nickel métal Ni vis à vis de l'eau, selon la valeur du pH ? Ecrire les bilans des réactions éventuelles du nickel, selon la valeur du pH . II.A.6) a) Qu'appelle-t-on domaine de corrosion, d'immunité et de passivation du métal '? Indiquer pour le nickel quels sont les domaines (numérotés de I à VII) qui correspondent respectivement àla corrosion, l'immunité et la passivation du nickel. b) Parmi les métaux suivants, Magnésium, Cuivre, Zinc, lequel doit-on choisir pour réaliser la protection cathodique du nickel en milieu acide (sans utiliser un générateur de courant) ? On justifiera l'expression de « protection cathodique ». II.A.7) Le nickel ne se corrode pratiquement pas en solution acide ne conte- nant pas d'autres oxydants que l'ion H + . Les prévisions précédentes sur la cor-- rosion du nickel sont--elles conformes à ce résultat expérimental ? Proposer une interprétation à cette observation à l'aide de courbes intensité-potentiel. II.B - Déposition électrolytique du métal La déposition électrolytique du nickel est une opération couramment employée dans l'électrométallurgie de ce métal. Dans la cellule d'électrolyse étudiée ici, la cathode est constituée de nickel électrolytique et le bain électrolytique d'une solution de sulfate de nickel (N LS 0 4) . On étudie le compartiment cathodique. II.B.1) Quelles sont les réactions susceptibles de se produire à la cathode ? Concours Centrale-Supé/ec 2000 4/1 1 CHIMIE Filière PC II.B.2) Pour établir les conditions de travail optimales pour le dépôt de nickel, on se réfère dans un premier temps au diagramme E--pH . Plusieurs réactions sont en compétition. Pour obtenir un meilleur rendement pour la production de nickel, doit-on se placer à pH : 0 ou pH : 5 dans le com- partiment cathodique ? II.B.8) Pour compléter l'étude on souhaite prendre en compte les facteurs cinétiques. On considère un bain électrolytique ayant une concentration en ions .2+ _1 NL de 0,7 mol-L . a) Calculer les valeurs du potentiel de la cathode pour lesquelles se produisent effectivement les réactions proposées à la question II.B.1. Dans les deux cas suivants : pH : 0 et pH : 5 . Représenter, pour chaque valeur du pH , 0 et 5 , l'allure des courbes intensité potentiel pour les réactions envisagées. b) En déduire, respectivement à pH : 0 et pH : 5 , la réaction cathodique qui se produira pour la valeur de la tension d'électrolyse la plus faible. Les conclu- sions de la question II.B.2) sur le choix du pH sont--elles modifiées ? Surtension sur électrode de nickel électrolytique : ° de dégagement de H2 : lnl : 0,2 V, ° de dépôt de nickel à partir de N i2+ : pratiquement nulle, ° de formation de N i2+ : pratiquement nulle. S O? : électro--inactif. II.C - Composés du nickel et du bore. Les alliages nickel-bore sont utilisés pour le brasage des aciers inoxydables. La figure 3 (en annexe) donne l'allure du diagramme binaire Ni -- B (xB est la frac-- tion molaire en bore). II.C.1) Comment nomme-t--on les composés tels que H 1 , H 2, H 3 , et H 4 ? II.C.2) Expliciter la formule des composés H 2 et H 4. II.C.3) Préciser la nature des phases en équilibre, dans les parties du dia- gramme, numérotées de " à @. II.C.4) On part du composé H 2 solide. On élève progressivement la tempéra- ture. Décrire les phénomènes observés. II.C.5) Un mélange liquide de nickel et de bore a un pourcentage massique en bore de 45% . On refroidit progressivement 100 g de ce mélange. Décrire les phé- nomènes observés. On précisera les températures particulières. Représenter le diagramme d'analyse thermique au cours de ce refroidissement. On supposera que l'on enlève toujours la même quantité de chaleur par unité de temps. II.C.6) Au cours du refroidissement étudié à la question II.C.5, donner à 800° C la nature et la composition des phases en présence. La composition sera Concours Centrale--Supélec 2000 5/1 1 CHIMIE Filière PC exprimée en nombre de moles de chaque constituant présent dans chaque phase. II.D - On s'intéresse maintenant aux alliages Cu -- Ni , du cuivre avec le nickel CFC . II.D.1) L'alliage Cu -- Ni est-il un composé d'insertion du cuivre ou de substi- tution du nickel par le cuivre ? II.D.2) Proposer une allure pour le diagramme liquide solide du binaire cui- vre-nickel. On précisera les phases présentes dans les différentes parties du dia- gramme. II.D.3) Parmi les plus couramment utilisés des alliages cupro-nickels se trouve le constantan (40% Ni, 60% Cu en nombre de moles). On porte 2g de cet alliage à 1200°C , on a alors deux phases en équilibre, une phase liquide et une phase solide. Déterminer la fraction molaire de nickel pour chacune des deux phases. On supposera pour cette question le mélange cuivre-nickel idéal. Partie III - Synthèse de la Sirênine La sirénine 1 est une phéromone sexuelle. La structure de OH cette molécule est : | 1 OH III.A - La synthèse totale de cette molécule a été réalisée par E.J. Corey et Coll. en 1969. Le réactif de départ de cette \ /0 synthèse est l'ester 2 obtenu par réaction d'un alcool % et o_< 4 | _ 0 de l'acide éthanoïqué. L'ozonolyse réductrice à --78° C de % fournit la propanone et le produit c_1 . III.A.1) Donner la structure du produit 2 . III.A.2) Si l'ozonolyse réductrice n'est pas réalisée à --78° C , trois produits sont obtenus. Donner leur structure. En déduire quel est le groupement de g le plus réactif vis-à-vis de l'ozonolyse ? III.A.8) Donner la structure de l'alcool @ . Indiquer le mécanisme de formation d'un ester à partir d'un alcool et d'un acide carboxylique en milieu acide. Est-ce la meilleure méthode pour synthétiser un ester. Sinon laquelle proposez--vous ? Concours Centrale-Supélec 2000 6/11 CHIMIE Filière PC III.B - 4_1 est transformé selon le schéma suivant où Ph est le groupe C6H5 Ph (--B ' Ph?P Ï 1) K2CO3, EtOH \ OO 00201120H3 2) DHP, APTS, Et20 0 4 5 - NaH , 0° c - 3) LiAlH4, Et20, 0° c | 6 (réduction d'ester en alcool) OH _ L'APTS est l'acide paratoluène 1sulfonique, acide donneur de protons en milieu organique. Le spectre de RMN H du DHP a été enregistré dans CDCI3 à une fréquence de 400 MHz. Les déplaÎements chimiques sont donnés par rapport au tétramétbylsilane (TMS). Ce spectre est donné à la figure 4 (en annexe). III.B.1) a) Le DHP (dihydropyrane) a pour formule brute CSI--ISO. Attribuer aux trois massifs du spectre de RMN ayant le DHP O déplacement chimique le plus élevé le ou les protons corres- pondants du DHP. b) Indiquer alors les intégrations correspondants à chaque massif. III.B.2) a) Quel est le rôle de l'hydrure de sodium NaH dans la première étape ? Justi- fier la stabilité de l'entité formée. b) Donner la structure de 5 . III.B.3) En présence d' APTS , le DHP permet de protéger une fonction alcool. a) Connaissant la structure de @, indiquer la fonction ester de 5 qui est sapo- nifiée lors de l'action du carbonate de potassium. Ecrire la structure du produit obtenu lors de cette saponification. b) Proposer une structure pour le produit obtenu après protection et un mécanisme pour sa formation. III.C - Le groupe hydroxyle libre de la structure @ est alors protégé par un groupe protecteur noté P. Z est ainsi obtenu. P sera ôté à la fin de la synthèse par action de LiAlH4. Après cette étape de protection l'acétal est éliminé par Concours Centrale-Supélec 2000 7/1 1 CHIMIE Filière PC action du méthanol en milieu acide. Le schéma ci-dessous résume ces étapes ainsi que les suivantes : \ \\ O--Ô APTS PBr3 x 0 7 8 9 _ | ' MeOH, 0° C " Et20, 0° C ' Et20 10 OP Puis 10 est transformé en 11 par action de l'APTS dans le méthanol à 0° C. 11 est--alors soumis à l'actiorÎ du dihydrogène sur un catalyseur au nickel dans lÎâthanol aqueux pour fournir 1_2 . Ce catalyseur est désactivé de manière à ren-- dre les doubles liaisons tri-substituées très peu réactives. Q est obtenu par action du réactif de Jones (CrO3 , HZSO4, H20) sur Q . III.C.1) Donner la structure de ä_3 . Quel est l'intérêt de l'étape de protection 2 lors du passage de g à @ ? III.C.2) Donner la structure de 9 . Pourquoi n'a-t-on pas utilisé HBr ? III.C.3) Donner une structure possible pour 9_c. Proposer une synthèse de ag à partir de prop -- 2 -- yn -- 1 -- ol , d'APTS , de tout réactif minéral désiré et de DHP (voir question III.B.1)a). III.C.4) Donner les structures de _1_1, 1_2 et Q. III.D - En trois étapes, on obtient à partir de 2 le composé 1_4_1: Le composé 1_4 traité par NaH réagit avec le carbo- nate de diéthy1e (EtO)2CO pour donner un [3- c--étoester | 15.15 traité par NaBH4 (non réactif vis-à-vis des | 0 _ esters) dans l'éthanol à --20° C donne 16 qui est dés- hydraté en 1_7. III.D.1) Montrer que (EtO)ZCO est un électrophile. Donner la structure de 15 et proposer un mécanisme de formation sachant que deux produits sont envisa- geables mais que le moins encombré est obtenu. OP III. D. 2) Donner les structures de 16 et 1_7. Justifier la sélectivité de la réaction de déshydratation. LiAlH4 permet de passer en une étape de 1_7 à 1. (les figures 2,3 et 4 sont en annexe page suivante) Concours Centrale-Supélec 2000 8/1 1 CHIMIE Filière PC Annexes pH II 14 VII \ V VI \ 9510 Figure 2 \ \ 9 9 / | ... $ / / Ë, LU / / I = | | | | | | | | | | | | | | 0 o 8 o o 0 N !: 1-- 1-- | Concours Centrale-Supélec 2000 9/11 CHIMIE Filière PC Figure 3 ten °C 2100 2000 -- 1600 -- 1 200 "' 1 170 \/ o 1 095 1 100 _ 1018 800 -- 400 Concours Centrale-Supélec 2000 10/11 CHIMIE Filière PC Figure 4 2.0 ppm1.9 ] 2.1 ü ...__,JL_ : 4.0 | 4.1 4.3 ppm4.2 ! 4.4 | 4.5 | 4.6 | 4.7 ppm I 6.3 Concours Centrale-Supélec 2000 11/11