Centrale Chimie PC 2011
| Thème de l'épreuve | Quelques propriétés de l'iode. Synthèse de la (+/-)-dihydrocallitrisine. |
| Principaux outils utilisés | électrochimie, diagrammes potentiel-pH, dosage, thermochimie, mélanges binaires, stéréochimie, RMN, synthèse organique |
| Mots clefs | iode, triiodure, iodure, hydrogénosulfite, vin, diagramme de phase, dihydrocallitrisine |
Corrigé
:👈 gratuite pour tous les corrigés si tu crées un compte
👈 l'accès aux indications de tous les corrigés ne coûte que 1 € ⬅ clique ici
👈 gratuite pour tous les corrigés si tu crées un compte
- - - - - - - - - - - - - - - - - - - - -
👈 gratuite pour ce corrigé si tu crées un compte
- - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - -
Énoncé complet
(télécharger le PDF)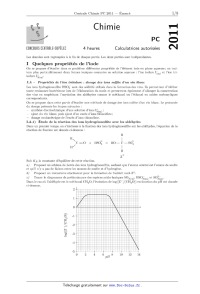






Rapport du jury
(télécharger le PDF)



Énoncé obtenu par reconnaissance optique des caractères
Ü» Chimie '3« _/ PC EÜNE[IHHS EENTHHLE'SHFËLEE 4 heures Calculatrices autorisées 2011 Les données sont regroupées a la fin de chaque partie. Les deux parties sont indépendantes. I Quelques propriétés de l'iode On se propose d'étudier dans ce problème différentes propriétés de l'élément iode en phase aqueuse; on trai-- tera plus particulièrement deux formes ioniques courantes en solution aqueuse : l'ion iodure l(aq) et l'ion tri-- i r l_ . odu e 3(3q) I.A -- Propriétés de l'ion triiodure : dosage des ions sulflte d'un vin blanc Les ions hydrogénosulfite HSOg sont des additifs utilisés dans la formation des vins. Ils permettent d'inhiber toute croissance bactérienne lors de l'élaboration du moût et permettent également d'allonger la conservation des vins en empêchant l'oxydation des aldéhydes comme le méthanal ou l'éthanal en acides carboxyliques correspondants. On se propose dans cette partie d'étudier une méthode de dosage des ions sulfite d'un vin blanc. Le protocole du dosage présente les étapes suivantes : -- synthèse électrochimique d'une solution d'ions I?Î(aq) ; -- ajout du vin blanc, puis ajout d'un excès d'ions thiosulfate; -- dosage coulométrique de l'excès d'ions thiosulfate. I.A.1) Étude de la réaction des ions hydrogénosulfite avec les aldéhydes Dans un premier temps, on s'intéresse à la fixation des ions hydrogénosulfite sur les aldéhydes, l'équation de la réaction de fixation est donnée ci--dessous : R R | \ e @ o=o + Hso3 = HO--C--SO3 / H | H ZG Soit K R la constante d'équilibre de cette réaction. a) Proposer un schéma de Lewis des ions hydrogénosulfite, sachant que l'atome central est l'atome de soufre et qu'il n'y a pas de liaison entre les atomes de soufre et d'hydrogène. b ) Proposer un mécanisme réactionnel pour la formation de l'adduit noté Z9. 6) Tracer le diagramme de prédominance des espèces acido--basiques SO2(aq), HSOg(aq) et SOâëq). Dans le cas où l'aldéhyde est le méthanal CH20, l'évolution de log([Z'] / [CHZO]) en fonction du pH est donnée ci--dessous. log(iZ"l/iCH20l) d) Justifier qualitativement l'influence du pH sur le rapport [Zel/[CH2O]. EUR) Dans le cas du méthanal, déterminer l'intervalle de pH pour lequel moins de 5% de l'aldéhyde est libre. Sachant que le pH de la plupart des vins est voisin de 3,5, discuter de l'efficacité des ions hydrogénosulfite pour prévenir l'oxydation du méthanal du vin. f) La valeur de la constante K R dépend de la nature du groupement R de l'aldéhyde. On observe que la valeur de K R est plus faible pour l'éthanal que pour le méthanal. Proposer une explication. Quelle conséquence cela peut-il avoir sur la conservation du vin ? I.A.2) Synthèse électrochimique des ions triiodure [£a--(aq) Ces ions sont obtenus par voie électrochimique a partir des ions iodure I(_aq) en solution aqueuse. Pour cela, on plonge dans une solution d'iodure de potassium deux électrodes de platine entre lesquelles on fait circuler un courant d'intensité constante. Le pH de la solution est maintenu constant et égal à 4,8. a) A quelle électrode la transformation des ions iodure I(aq) en ions triiodure I3(aq) se produit--elle ? Justifier. b ) Quelle réaction est susceptible de se produire à l'autre électrode ? c) On maintient pendant 4 minutes un courant de 10 mA dans 30 mL d'une solution d'iodure de potassium de concentration molaire 0,1 mol -- L'1 sous agitation. Une coloration jaune apparaît. Déterminer la concentration molaire d'ions triiodure 13(aq) formés dans la solution A ainsi obtenue. I.A.3) Étude des diagrammes E -- pH simplifiés de l'iode et du soufre Le diagramme ci-dessous représente le diagramme E -- pH simplifié de l'iode. Les espèces iodées prises en compte sont les 10ns I(aq), IO3(aq) et I3(aq). Ce d1agramme correspond a une concentration molaire de trace (: = 10"2 mol-L'1 ; on supposera qu'à la frontière entre deux espèces dissoutes, chaque espèce a une concentration molaire égale à. c. A 1.5 1 B O 9 0.5 V A EQ 0 ' 1 12 1 --0.5 -1 ---- pH a) Attribuer chacun des domaines du diagramme à l'une des espèces iodées en justifiant votre choix. b ) À l'aide des données, déterminer les équations des frontières du diagramme E -- pH simplifié du couple S(+VI)/S(+IV) avec une concentration de tracé égale à 10"3 mol -- L'1 et selon la même convention de frontière que pour l'iode. c) Superposer le diagramme du couple S(+VI)/S(+IV) à celui de l'iode. d ) Dans quel domaine de pH l'oxydation du soufre (+IV) par les ions triiodure I?Î(aq) est-elle possible ? Écrire l'équation de cette réaction, selon le pH de travail, et calculer la constante d'équilibre correspondante. @) Déterminer l'équation de la frontière du couple O2(aq) /H2O et la superposer aux diagrammes précédents. On prendra comme concentration en dioxygène dissous sur la frontière c = 10"5 mol - L_1. Quelle influence sur le résultat du dosage peut avoir le dioxygène dissous dans l'eau? f) Avant d'introduire le vin blanc, on fait buller du diazote dans la solution A. Quel en est l'intérêt ? I.A.4) Dosage total des ions hydrogénosulfite d'un vin blanc Dans un vin, une partie des ions hydrogénosulfite est libre, tandis que l'autre est fixée sur des aldéhydes conformément à. l'étude précédente. Pour déterminer la teneur totale du vin en hydrogénosulfite, on réalise un traitement préalable du vin en milieu basique par ajout, sans variation de volume, de soude solide pour atteindre un pH : 12. a ) Ecrire les équations des réactions se produisant lors de cet ajout de soude. b ) On verse 1,0 mL du vin ainsi traité dans la cellule électrochimique contenant la solution A de la partie I.A.2. Dans le mélange, toujours sous agitation, on introduit 0,1 mL d'une solution de thiosulfate de sodium (2Na+, SZOË_) de concentration molaire 0,1 mol - L"', ce qui provoque une décoloration totale de la solution initiale. On introduit alors quelques gouttes d'empois d'amidon et on impose un courant de 10 mA a la solution. Une teinte bleue apparaît au bout de 23,2 s. Déterminer la concentration totale en ions hydrogénosulfite dans le vin blanc. 6 ) Le dioxyde de soufre présente une certaine toxicité pour l'homme. La dose journalière admissible fixée par l'Organisation Mondiale de la Santé (OMS) est de 56 mg de dioxyde de soufre pour un homme de 80 kg. Déterminer a partir de quel volume de ce vin cette dose est ingérée. I.B -- Étude de quelques propriétés de l'ion iodure I.B.1) Solubilité de l'iodure de potassium Le tableau ci-dessous donne la masse maximale de KI que l'on peut totalement dissoudre dans 100 mL d'eau en fonction de la température. Température t (°C) --10 0 20 40 60 80 100 110 Masse d'iodure de potassium KI (g) 115,1 127,5 144,0 160,0 176,0 192,0 208,0 215,0 a ) Calculer a:, la fraction molaire maximale en iodure de potassium dissout dans le mélange aux différentes températures. b) On considère comme système thermodynamique une solution aqueuse d'ions Këq> et la... en contact avec de l'iodure de potassium solide KI(S), à la température T et a la pression P. Exprimer pour ce système la différentielle dG de l'enthalpie libre en fonction des variables décrivant le système. (3) On considère comme transformation élémentaire la dissolution spontanée d'une quantité de matière dn de KI(S) dans la phase aqueuse à température T et pression P constantes. Comment se simplifie l'expression de dG précédemment donnée ? d) À quelle condition sur les potentiels chimiques cette transformation est--elle possible? 6) Dans le cas où le système est à l'équilibre, que peut-on dire sur G, la fonction enthalpie libre du système ? En déduire une relation entre les potentiels chimiques standard de I(_aq), KÊ...)» KI(S), la température T et la fraction molaire oe. Par la suite, on supposera les mélanges idéaux et on négligera l'influence de la pression sur les phases condensées. f) En déduire l'équation reliant sc, la fraction molaire maximale de l'iodure de potassium dissout, la tem- pérature T et AdÎSSHO(KI(S)), l'enthalpie molaire standard de dissolution de l'iodure de potassium, que l'on considérera constante sur l'intervalle de température considéré. g ) À partir des valeurs numériques précédemment calculées, déterminer la valeur de AdissH°(Kl(s)). I.B.2) Étude du diagramme de phase eau-iodure de potassium Les données précédentes peuvent être utilisées pour prendre en compte, dans les diagrammes binaires usuels, la saturation de la solution aqueuse en sel. On obtient alors des diagrammes de phases. Ceux--ci, de manière analogue aux diagrammes binaires, rendent compte de l'état physique de systèmes composés d'eau et de sels ioniques solubles dans l'eau, en fonction de la température et de la pression du système. Le diagramme page suivante représente le diagramme de phases du système eaufiodure de potassium sous pression atmosphérique; en abscisse est portée la fraction massique en iodure de potassium du mélange considéré, et en ordonnée, la température du système en degrés Celsius. a ) Rappeler l'allure générale du diagramme binaire isobare solide--liquide de deux constituants A et B non miscibles à l'état solide et totalement miscibles en phase liquide. b) Indiquer, dans chaque domaine de ce diagramme, les constituants présents ainsi que les phases sous lesquelles ils sont présents. c) On considère, à 9 = 20°C, un récipient contenant un litre d'eau pure. On rajoute progressivement dans ce récipient des petites quantités de sel d'iodure de potassium KI(S) sans variation de volume. Décrire qualitativement ce qui se produit au fur et à mesure des ajouts de sel solide dans l'eau. d) Déduire des questions b et c les différentes phases présentes dans les domaines numérotés de I à IV dans le diagramme de phases fourni. 6) Tracer l'allure de la courbe d'analyse thermique relative au chauffage, entre 9 = --30°C et 9 = 130°C et sous pression atmosphérique fixée, d'un mélange eau--iodure de potassium de fraction massique W, = 30%. On justifiera le tracé par des calculs de variance du système. Commenter chacun des points particuliers de la courbe. f) On considère un mélange initialement constitué uniquement de 40 g d'eau liquide et de 60 g de glace, sous pression atmosphérique. Quelle masse d'iodure de potassium solide faut--il rajouter au système, de manière isobare, afin d'amener le mélange à une température de --10°C ? 140 Données à 25°C HQOE ---- KIÇSJ 120 100 80 8 & 60 93 ;; (III) (IV) «'a? CL & 40 8 20 0 HE -20 69 -40 0.0 0.2 0.4 0.6 0.8 1 fraction massique en KI pKa1(SO2(a q)/HSO3(a q))-- -- 1,8 pK,,2(HSOäa q)/SO3(_aq))-- -- 7,2 E°(Iîäq> /I(_aq)) = 0,54 V E°(IO"...Ü /13_(aq) ) = 1,17 V 2-- 2-- E°(SO4(aq)/S02(aq)) = 0,17 V E°(SO4(aq)/HSOg(aq))-- -- 0,12 V EO(SOÏ@q,/SQË@q,) = --0,10 V E°(S 02--01 )2/8 02(--a q)--) _ 0,09 V Eo(0 2(aq)/H20(1)) = 1,23 V E°(H+ (aq) )/H2(g)) = 0300 v M(H)=1g-mol'1 M(S) = 32,1 g - mol"1 F = 96500 C - mol"1 %1n 10 = 0,06 V M(O) = 16 g-mol_1 M(KI) = 166,0 g - mol"1 R = 8,314 J-mol_1-K_1 On considérera que l'acide sulfurique HZSO4 est un diacide fort dans l'eau. II Synthèse de la (i)-dihydrocallitrisine Pour alléger l'écriture des mécanismes, les candidats pourront ne faire figurer, dans la représentation des molé- cules, que la partie « utile » qui intervient dans la réaction considérée et nommer R1, R2, . . ., les autres groupes de la molécule. Les données utiles pour cette partie sont regroupées en fin d'énoncé. Les eudesmanolides oxygénés forment une famille de sesquiterpènes naturels comportant trois cycles accolés dont une fonction lactone (fonction ester cyclique). Isolés des plantes, ils présentent diverses activités intéres- santes (antibiotique, antitumorale, . . .) qui ont largement contribué au développement de voies de synthèse. La numérotation des cycles (I), (II) et (III) ainsi que celle des atomes de carbones cycliques (1 à 12) seront celles utilisées tout au long du problème. Ce problème traite d'une synthèse d'un eudesmanolide, la (::)--dihydrocallitrisine isolée de conifères de la famille des Cupressaceae. II.A -- Étude stéréochimique II.A.1) Quelle est la signification du symbole dans ( )--dihydrocallitrisine? La structure de l'un des énantiomères noté A de la dihydrocallitrisine est représentée figure 1. Figure 1 Composé A II.A.2) Combien d'atomes de carbone asymétriques la molécule A comporte-t-elle'? En déduire le nombre de stéréoisomères de configuration de la molécule A. II.A.3) Donner, en les justifiant, les configurations absolues des atomes de carbone 5, 7 et 8 correspondant à la numérotation utilisée. II.B -- Formation du cycle (III) On se propose, dans un premier temps, d'étudier la fin de la synthèse réalisée à partir du mélange racémique du composé N représenté figure 2 et de son énantiomère. 0 0 |_. co,cn3 Figure 2 Composé N N est traité par du tétraborohydrure de sodium dans le méthanol à température ambiante. Cette action fournit un composé intermédiaire non isolé 0 qui évolue spontanément vers la lactone P représentée figure 3. H 00 \_l Figure 3 Composé P II.B.1) Proposer une structure pour l'intermédiaire O. Justifier la stéréochimie de l'atome de carbone 8. II.B.2) Écrire l'équation de la réaction (a) expliquant la formation de P à partir de O. II.B.3) À partir des données thermodynamiques, estimer l'enthalpie standard de la réaction (a) a 298 K en précisant les approximations éventuellement utilisées. II.B.4) Prévoir le signe de l'entropie standard de la réaction (a). Justifier dans ces conditions pourquoi la formation de P est favorisée, sachant que la réaction se déroule sous contrôle thermodynamique. P est déprotégé pour donner Q représenté figure 4. __...m\\ 0 HH 0 Figure 4 Composé Q II.B.5) Citer les conditions usuelles de déprotection et donner, dans ces conditions, le mécanisme de formation de Q a partir de P. II.B.6) En réalité, ces conditions ne conviennent pas pour la synthèse envisagée. Proposer une explication. Les conditions réelles employées sont les suivantes : P (70 mg) est dissous dans 20 mL de propanone en présence de 40 mg d'acide paratoluènesulfonique (APTS, figure 5) et l'ensemble est laissé sous agitation pendant 17 heures. so,,r1 Figure 5 APTS Afin de respecter la stéréochimie de la dihydrocallitrisine, la configuration absolue de l'atome de carbone 5 doit être changée. Pour cela, Q est traité par une solution méthanolique de potasse (KOH dans MeOH) pendant 20h à 0°C. Après ce traitement, on obtient 52 mg d'un mélange contenant 90% de Q' et 10% de Q. Q' est ensuite isolé par recristallisation. II.B.7) Donner la structure de Q' et proposer un mécanisme pour la transformation de Q en Q'. II.B.8) Calculer le rendement de synthèse du composé Q' a partir de P. II.B.9) Les composés Q et Q' sont-ils facilement séparables? Justifier. II.B.10) Rappeler le principe de la recristallisation. Quel montage utilise--t--on pour effectuer cette opération ? II.B.11) Proposer une suite de réactions pour transformer Q' en A, en précisant les réactifs nécessaires et les conditions opératoires. II.C -- Formation des cycles (I) et (II) de la dihydmcallz'trz'sz'ne Le synthon B de départ est un composé de formule brute C6H603. Le spectre RMN 1H présente les signaux suivants : un singulet d'intégrale 3 à (Sa = 2,3 ppm, un doublet d'intégrale 1 situé à 51, = 6,6 ppm, un autre doublet d'intégrale 1 situé à. 56 = 7,9 ppm et un singulet élargi a 5,71 = 11,0 ppm. La constante de couplage au niveau des signaux doublets est de 2,0 Hz. II.C.1) Déterminer la formule semi-développée du composé disubstitué du furane B en précisant le rai- sonnement utilisé et en présentant les différentes attributions des signaux de RMN sous forme de tableau. Les données utiles sont rassemblées en fin d'énoncé. II.C.2) Quelle stabilité particulière le composé B présente-t-il'.7 Justifier. OCH3 0 | / HOOC D E Figure 6 Traité par 2 équivalents de diisopropylamidure de lithium (LDA) dans le THF anhydre, B donne un dianion C. Ce dernier est opposé à la 3-méthoxycyclohex-2-ènone (composé D) en solution dans le THF anhydre. Après réaction, le milieu est hydrolysé par une solution aqueuse d'acide chlorhydrique et on isole le composé E dont la formule topologique est donnée figure 6. II.C.3) Quels sont les atomes d'hydrogène acides du composé B ? Justifier. En déduire la formule topologique du dianion C. II.C.4) Dans le cadre de la théorie de Hückel, l'a--énone D est modélisée par le composé D' représenté ci-dessus. Le groupement méthyle sera modélisé par un hétéroatome a 2 électrons. Les énergies des orbitales moléculaires (OM) 71" ainsi que leurs coefficients sont donnés dans le tableau de la figure 7. Numéro d'OM Énergie Coeficients d'orbitales _a --- 1,505 --0,58 0,29 0,15 --0,07 --0,40 0,45 0,10 --0,41 & 0,755 0,51 0,13 0,37 0,30 0,13 --0,21 --0,07 a--0,625 0,36 0,58 --0,65 0,21 0,04 , oz -- 1,645 --0,21 --0,56 --0,47 0,11 0,02 --0,09 Figure 7 a ) On admet que la réaction se déroule sous contrôle orbitalaire. Déterminer, en le justifiant, le site d'attaque d'un nucléophile sur le composé D'. b) À partir de ce résultat, proposer un mécanisme pour la formation de E à partir de C et de D. L'étape suivante est une estérification par le diazométhane CH2N2, ce qui donne le composé F. Cette réaction s'accompagne d'un dégagement gazeux. II.C.5) Proposer un schéma de Lewis du diazométhane. II.C.6) Donner la structure de F et proposer un mécanisme pour cette estérification, sachant que sa première étape est une réaction acido--basique entre l'acide carboxylique et le diazométhane. Quelle est la nature du gaz dégagé ? II.C.7) La formation du cycle (II) est ensuite réalisée comme suit : F est traité par un équivalent de diméthylcuprate de lithium dans le diéthyléther anhydre. En l'absence de toute hydrolyse du milieu, le composé G, représenté figure 8, est obtenu. 0 0 Figure 8 Composé G a) Quel anion F' obtient-on après action du diméthylcuprate de lithium sur F ? b) Proposer un mécanisme pour la formation du composé G a partir de F'. II.C.8) Le composé G est en fait constitué de deux stéréoisomères de configuration G1 et G2. G1 présente les configurations 58 et 10H. Donner les formules de G1 et, en le justifiant, de G2. Dans la suite, seules les réactions sur le stéréoisomère G1 seront étudiées. Il est toutefois précisé que les mêmes réactions ont lieu sur le stéréoisomère G2 pour la synthèse étudiée. G1 est dissous dans du benzène et mis en présence d'acide paratoluènesulfonique (APTS) et d'éthane--1,2--diol. Le produit H est ainsi obtenu. H est ensuite traité par du tétraborohydrure de sodium dans le méthanol pour donner le composé I. II.C.9) Quelle est la fonction cétone de G1 la plus réactive vis--à--vis d'un nucléophile ? Justifier. En déduire les formules de H et de 1, sans détailler la stéréochimie du nouveau carbone asymétrique formé. Le composé I est ensuite mis en présence d'acide métachloroperbenzoïque. Un composé J est obtenu. Traité par une solution aqueuse de carbonate de sodium Na2003, J est hydrolysé en K qui évolue spontanément en L. / «ww-- : stéréochimie non précisée Figure 9 Composé L II.C.10) Avec quelle fonction l'acide métachloroperbenzoïque est--il susceptible de réagir? Sachant que seule la fonction la plus accessible est attaquée, donner la formule semi--développée de J. 11.0.11) a) Donner la formule semi--développée de K et proposer un mécanisme pour sa formation. b) L'évolution spontanée de K en L impliquant l'ouverture de l'hémiacétal cyclique, proposer un mécanisme expliquant cette transformation. Le composé L est ensuite transformé en M selon une réaction qui ne sera pas étudiée. O / H 93 002ch3 Figure 10 Composé M II.C.12) Quelle réaction permet de passer a la dihydrocallitrisine, composé N cherché ? Préciser les réactifs à employer. Données Enthalpies standard de dissociation de liaisons a 298 K (en kJ - kmol"') O--H : 428; C--O : 376; C=O : 799; C--H : 412. Numéro atomique : H : 1; C : 6; N : 7 Masses molaires atomiques (en g - mol--1) : H : 1; C : 12; O : 16; S : 32 Densité de la propanone liquide : 0,79 sous 1 bar et à 20°C Tables de déplacements chimiques groupe de protons 5 (ppm) groupe de protons 5 (ppm) CH3--C 0,9 CH--C 1,5 CH3--C--OR 1,2 CH--C--OR 2,0 CH3--C=C 1,6 CH--C=C 2,5 CH3--Ar 2,3 (DH--Ar 3,0 CHS--OR 3,3 CH--OR 3,7 --C=CH 4,5*6,0 ArH 6,5*8 RCOOH 10,5*12,5 H H H H J=2--12HZ J=12--18HZ Figure 11 Constantes de couplage oooFINooo