Centrale Chimie PC 2019
| Thème de l'épreuve | Avancées récentes dans le traitement de l'hépatite C |
| Principaux outils utilisés | solutions aqueuses, oxydoréduction, diagrammes E-pH, courbes courant-potentiel, mélanges binaires, chimie organique, orbitales moléculaires |
| Mots clefs | hépatite C, électrode nanoporeuse, acide ascorbique, vitamine C, Siméprévir, sulfolène, sultine |
Corrigé
:👈 gratuite pour tous les corrigés si tu crées un compte
👈 l'accès aux indications de tous les corrigés ne coûte que 1 € ⬅ clique ici
👈 gratuite pour tous les corrigés si tu crées un compte
- - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - -
👈 gratuite pour ce corrigé si tu crées un compte
- - -
Énoncé complet
(télécharger le PDF)






Rapport du jury
(télécharger le PDF)



Énoncé obtenu par reconnaissance optique des caractères
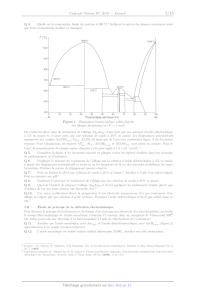
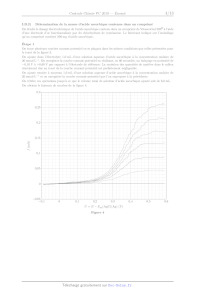
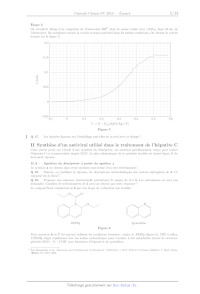
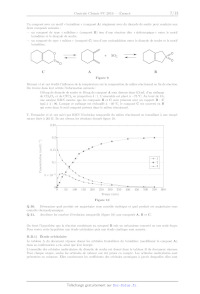
Chimie PC 4 heures Calculatrices autorisées ON OO (eæ, Avancées récentes dans le traitement de l'hépatite C L'hépatite C est une maladie du foie causée par un virus transmis par le sang. Selon l'Organisation Mondiale de la Santé, à l'échelle mondiale, environ 70 millions d'individus sont porteurs chroniques et, parmi eux, environ 400 000 personnes meurent chaque année des conséquences de cette maladie. Les médicaments antiviraux à action directe, mis sur le marché depuis 2013, ont révolutionné la prise en charge des patients et permettent de guérir plus de 95 % des personnes infectées. Cependant, leur coût est extrêmement élevé (de l'ordre de 30 000 EUR par patient en France) et surtout de nombreux patients sont porteurs du virus sans être dépistés. Ce problème propose de s'intéresser au principe innovant de la détection électrochimique de virus, dont celui de l'hépatite C, puis d'étudier la synthèse d'un antiviral à action directe, le Siméprevir. Ce sujet est accompagné d'un document réponse à rendre avec la copie. Les données sont regroupées dans ce document réponse. Certaines questions peu ou pas guidées, demandent de l'initiative de la part du candidat. Leur énoncé est repéré par une barre en marge. Il est alors demandé d'expliciter clairement la démarche, les choix et de les illustrer, le cas échéant, par un schéma. Toute démarche engagée, même non aboutie, et toute prise d'initiative seront valorisées. Le barème prend en compte le temps nécessaire à la résolution de ces questions. I Détection électrochimique du virus de l'hépatite C Parmi les stratégies de détection et de dosage de virus, les sondes électrochimiques sont l'objet de nombreuses études!. Les électrodes nanoporeuses d'or sont particulièrement intéressantes pour ces applications, car elles présentent une bonne stabilité, une grande surface active et des pores de taille variable selon les conditions de fabrication. L'or présente par ailleurs l'avantage d'être aisément fonctionnalisable par réaction avec des thiols. Ces réac- tions permettent de créer une monocouche organique auto-assemblée à la surface de l'électrode pour la rendre spécifique à la détection d'un virus. Cette partie étudie un mode de préparation des électrodes nanoporeuses d'or, puis un dosage réalisé avec une électrode d'or fonctionnalisée. I.A --- Fabrication d'une électrode d'or nanoporeuse? Un alliage, de formule chimique AlÿAu», est préparé par fusion d'aluminium et d'or de puretés supérieures à 99,9%. Les lingots obtenus sont refondus pour former ensuite des rubans par refroidissement rapide sous atmosphère inerte. Les rubans d'alliage sont ensuite traités soit par de la soude à 20% en masse, soit par de l'acide chlorhydrique à 5% en masse. Le traitement par la soude est tout d'abord effectué à température ambiante jusqu'à l'arrêt du dégagement gazeux, puis à 90 °C ; la durée totale du traitement ne dépasse pas une heure. Le traitement par l'acide chlorhydrique est réalisé à 90 °C jusqu'à la fin du dégagement gazeux ; sa durée est de l'ordre de 30 min. On étudie tout d'abord la préparation de l'alliage Al, Au. Pour cette étude, le diagramme de phases solide/li- quide simplifié des mélanges d'aluminium et d'or est donné figure 1. Q 1. Quelles masses de métaux purs doit-on utiliser pour obtenir 10 g d'alliage ALÇAu ? Q 2. À quelle température faut-il au minimum porter le mélange de métaux pour préparer l'alliage Al Au par fusion complète ? Q 3. Les dix grammes d'alliage fondu sont refroidis progressivement jusqu'à 500 °C. Donner l'allure de la courbe d'analyse thermique correspondante, en faisant apparaitre les températures caractéristiques et en précisant les phases présentes dans chaque domaine de la courbe. MS. Hejazi, M.H. Pournaghi-Azar, F. Ahour, Electrochemical detection of short sequences of hepatitis C 3a virus using a peptide nucleic acid-assembled gold electrode, Anal. Biochem. 399 (2010), 118-124 Partie construite à partir des articles suivants : -- Maryanne M. Collinson, Nanoporous Gold Electrodes and Their Applications in Analytical Chemistry, ISRN Analytical Che- mistry (2013), Article ID 692484 ; -- Zhonghua Zhang, Yan Wang, Zhen Qi,Jikui Li, Xiufang Bian, Nanoporous Gold Ribbons with Bimodal Channel Size Distributions by Chemical Dealloying of Al-Au Alloys, J. Phys. Chem. C, Vol. 113, No. 4 (2009), 1308-1314. 2019-02-25 11:35:40 Page 1/9 CHELLES Q 4. Quelle est la composition finale du système à 500 °C ? Indiquer la nature des phases en présence ainsi que leurs compositions molaire et massique. T(C) 1060°C 1064°C 1000 - 900- 800- 7004 } 650°C 624°C 600- 625°C 500- 400 I I l l Î Ï l l Ï 0 10 20 30 40 50 60 70 80 90 100 AI Pourcentage atomique d'or AU Figure 1 Diagramme binaire isobarce solide/liquide des alliages aluminium/or (P = 1 bar)* On étudie les deux voies de traitement de l'alliage Algp Au», d'une part par une solution d'acide chlorhydrique à 5% en masse ct, d'autre part, par une solution de soude à 20% en masse. Les diagrammes potentiel-pH superposés des couples Au(OH)3,,/Au,,, AI(IT)/AT ainsi que de l'eau sont représentés figure À du document réponse. Pour l'aluminium, les espèces A Al: AI(OH); et AI(OH);4 sont prises en compte. Pour le tracé, la concentration de chaque espèce dissoute a été prise égale à 1,0 x 107* mol-L-f. Q 5. Compléter la figure À du document réponse en plaçant toutes les espèces étudiées dans leur domaine de prédominance ou d'existence. Q 6. Expliquer le principe du traitement de l'alliage par la solution d'acide chlorhydrique à 5% en masse à partir des diagrammes potentiek-pH et écrire la ou les équations de la ou des réactions modélisant les trans- formations. Préciser la nature du dégagement gazeux observé. Q 7. Peut-on évaluer le pH d'une solution de soude à 20% en masse ? Justifier à l'aide d'un calcul adapté. Peut-on mesurer son pH ? Q 8. Expliquer le principe du traitement de l'alliage par une solution de soude à 20% en masse. Q 9. Quel est l'intérêt de préparer l'alliage Al Au et de lui appliquer les traitements étudiés plutôt que d'utiliser de l'or pur pour obtenir une électrode d'or ? Q 10. Une autre publication décrit la préparation d'une électrode nanoporeuse d'or par traitement d'un alliage or/argent par une solution d'acide nitrique. Pourquoi l'acide chlorhydrique n'est-il pas utilisé dans ce Cas ? I.B - Étude du principe de la détection électrochimique Pour illustrer le principe de la détection et du dosage d'un virus par une électrode d'or fonctionnalisée, on étudie le dosage électrochimique de l'acide ascorbique (vitamine C) contenu dans un comprimé de Vitascorbol 500%. On utilise pour cela une électrode d'or fonctionnalisée à l'aide de chlorhydrate de cystéaminef. Q 11. Justifier que l'acide ascorbique, noté ASC (aq): et l'acide déshydroascorbique, noté AscH, (aq): (figure 2) appartiennent à un couple oxydant-réducteur. Q 12. L'acide ascorbique est utilisé comme additif alimentaire (E300). Justifier son rôle antioxydant. D'après : J.L. Murray, H. Okamoto, T.B. Massalski, The Al-Au(Aluminum-Gold)System, Bulletin of Alloy Phase Diagrams Vol. 8 No. 1 (1987) Expériences adaptées de : Takashi Ito, D. M. Neluni T. Perera, and Shinobu Nagasaka, Gold Electrodes Modified with Self-Assembled Monolayers for Measuring L-Ascorbic Acid, J. Chem. Educ., 85 (8), (2008), 1112-1115. 2019-02-25 11:35:40 Page 2/9 (cc) BY-NC-SA HO HO 0 O 0 O D 2 HO TT HO TT HO OH O OÔ Acide ascorbique (AscH,) Acide déshydroascorbique (Asc) Figure 2 I.B.1) Tracé de la courbe courant-potentiel complète On commence par tracer la courbe courant-potentiel complète d'une électrode d'or fonctionnalisée par le chlor- hydrate de cystéamine plongeant dans un électrolyte contenant de l'acide ascorbique. On réalise pour cela un montage à trois électrodes dont les caractéristiques sont décrites ci-dessous. --_ Electrode de travail : Fil d'or nanoporeux traité par une solution aqueuse de chlorhydrate de cystéamine à 0,010 mol-L! pendant une heure. -- Contre-électrode : Acier inoxydable. -- Electrode de référence : AgC1/Ag saturée en chlorure de potassium, potentiel Æ,., = 0,20 V. -- Électrolyte : 50,0 mL d'acide chlorhydrique à 0,050 mol-L! dans lesquels ont été dissous 5,0 X 107* mol d'hy- drogénophosphate de sodium (Na, HPO,) et 5,0 x 107 mol de chlorure de sodium. La solution est désaérée avant et pendant les mesures par bullage de diazote pour enlever le dioxygène dissous. Une pointe de spatule d'acide ascorbique (AscH,) est dissoute dans l'électrolyte avant le début des mesures. La courbe obtenue est présentée sur la figure 8. 0,3 0.2 0.1 L Ê -- --0.1 --0,2 --0,3 --0,4 1 --0,5 0 0.5 1 U--E- E,.(AgCI/Ag) (V) Figure 3 Courbe courant-potentiel complète d'une solution d'acide ascorbique avec électrode de travail en or fonctionnalisée Q 13. Réaliser un schéma légendé du dispositif expérimental utilisé pour tracer la courbe courant-potentiel complète représentée sur la figure 3. Q 14. Déterminer la composition de l'électrolyte à l'équilibre ainsi que son pH avant la dissolution de l'acide ascorbique et en déduire sous quelle forme se trouve l'acide ascorbique une fois dissous dans ce dernier. Q 15. Expliquer l'allure de la courbe de la figure 3 en détaillant les phénomènes électrochimiques se produi- sant aux endroits de cette courbe repérés par les lettres (a), (b), (c) et (d). Q 16. Estimer la surtension seuil cathodique du couple H7 /H, (8) EURt la surtension seuil anodique du couple (aq) O (#)/H20 sur électrode en or fonctionnalisée utilisée dans cette expérience. 2019-02-25 11:35:40 Page 3/9 (cc) BY-NC-SA I.B.2) Détermination de la masse d'acide ascorbique contenue dans un comprimé On étudie le dosage électrochimique de l'acide ascorbique contenu dans un comprimé de Vitascorbol 500 à l'aide d'une électrode d'or fonctionnalisée par du chlorhydrate de cystéamine. Le fabricant indique sur l'emballage qu'un comprimé contient 500 mg d'acide ascorbique. Étape I On trace plusieurs courbes courant-potentiel en se plaçant dans les mêmes conditions que celles présentées pour le tracé de la figure 3. On ajoute dans l'électrolyte 1,0 mL d'une solution aqueuse d'acide ascorbique à la concentration molaire de 20 mmol-L_*. On enregistre la courbe courant-potentiel en réalisant, en 60 secondes, un balayage en potentiel de --0,10 V à +0,60 V par rapport à l'électrode de référence. La variation des quantités de matière dans le milieu réactionnel due au tracé de la courbe courant-potentiel est parfaitement négligeable. On ajoute ensuite à nouveau 1,0 mL d'une solution aqueuse d'acide ascorbique à la concentration molaire de 20 mmol-L_' et on enregistre la courbe courant-potentiel que l'on superpose à la précédente. On réitère ces opérations jusqu'à ce que le volume total de solution d'acide ascorbique ajouté soit de 6,0 mL. On obtient le faisceau de courbes de la figure 4. 0,3 0,25 0,2 0,15 I (mA) 0,1 0,05 --0,05 0,1 0 0,1 0,2 0,3 0,4 0,5 0,6 U-E--- E,(AgCI/Ag) (V) Figure 4 2019-02-25 11:35:40 Page 4/9 (cc) BY-NC-SA Étape 2 On introduit 40 mg d'un comprimé de Vitascorbol 500®, dont la masse totale vaut 1,825 g, dans 50 mL de l'électrolyte. On enregistre ensuite la courbe courant-potentiel dans les mêmes conditions. On obtient la courbe donnée sur la figure 5. 0,2 0,15 0,1 T (mA) 0,05 --0,05 0,1 0 0,1 0,2 0,3 0,4 0,5 0,6 U--=E---E,;(AgCI/Ag) (V) Figure 5 Q 17. Les données figurant sur l'emballage sont-elles en accord avec ce dosage ? IT Synthèse d'un antiviral utilisé dans le traitement de l'hépatite C Cette partie porte sur l'étude d'une synthèse du Siméprévir, un antiviral spécifiquement conçu pour traiter l'hépatite C et commercialisé depuis 2013. Le plan schématique de la synthèse étudiée est donné figure B du document réponse. IT. À -- Synthèse du Siméprévir à partir du synthon 4 Le synthon 4 est obtenu dans cette synthèse sous forme d'un seul stéréoisomère. Q 18. Donner, en justifiant la réponse, les descripteurs stéréochimiques des centres stéréogènes de 4. Ce composé est-il chiral ? Q 19. Proposer une séquence réactionnelle permettant de passer de 4 à 5. Les mécanismes ne sont pas demandés. Combien de stéréoisomères de 5 peut-on obtenir par cette séquence ? Le composé 5 est transformé en 6 par une étape de cyclisation non étudiée. O O N O N OT NN A A EEDQ Quinoléine Figure 6 Pour convertir 6 en 7, les auteurs utilisent les conditions suivantes : amine A, EEDQ (figure 6), THF à reflux. L''EEDQ réagit rapidement avec les acides carboxyliques pour conduire à des anhydrides mixtes de structure générale RCO -- O -- COR' avec formation d'éthanol et de quinoléine. Âsa Rosenquist et al. Discovery and Development of Simeprevir (TMC135), a HCV NS3/4A Protease Inhibitor, J. Med. Chem. (2014), 57, 1673-1693. 2019-02-25 11:35:40 Page 5/9 (cc) BY-NC-SA Q 20. Donner la structure de l'amine A utilisée dans cette étape. Q 21. Proposer un mécanisme réactionnel de formation de l'anhydride mixte et justifier le rôle de l'EEDQ. Le composé 7 est ensuite transformé en 8. Q 22. Quel est l'intérêt du passage par le composé bicyclique 6 pour passer de 5 à 8 ? Une réponse précise et argumentée est attendue. Le passage de 9 à 11 est réalisé grâce à une réaction de Mitsunobu. On donne figure 7 le mécanisme schématique de la réaction de Mitsunobu dans le cas de la synthèse d'un éther de phénol où on a noté PhOH le phénol. OE OE /FO2R PhR COR phOH PhsR COR o Ph3P + N=N ---- N--N ------ N--NH + PhO / étape a / © étape b RO:C DIAD RO;C RO,C étape c | R'OH © Ph3P--O + R'--OPh --=------ R'O--PPh;, PhO© étape d FOR + AT NN RO;C Figure 7 Q 23. Indiquer (sans recopier les différentes réactions) la nature de chacune des étapes a à d du mécanisme de la réaction de Mitsunobu. Q 24. Donner l'équation de la réaction permettant d'obtenir 11 à partir de 9 et 10. Les composés 9, 10 et 11 pourront être représentés par leur numéro respectif dans cette équation. Q 25. Justifier la stéréosélectivité de l'obtention de 11. Q 26. Proposer une séquence alternative à la réaction de Mitsunobu pour obtenir 11 à partir de 9 et 10. Une réaction de cyclisation permet ensuite de transformer 11 en 12. Q 27. De quelle réaction s'agit-il ? Quel est le sous-produit gazeux formé lors de cette cyclisation ? Q 28. Proposer des conditions expérimentales permettant de réaliser la transformation 12 -- 13. Détailler le mécanisme réactionnel. Quel(s) autre(s) groupes) fonctionnel(s) aurai(en)t pu réagir dans cette étape ? Expliquer la chimiosélectivité observée. Q 29. Proposer un mécanisme pour la dernière étape (en utilisant une représentation simplifiée du compo- sé 14). Le DBU est une base permettant d'activer le réactif 15. II.B - Étude de la synthèse du 3-sulfolène, composé 2 La première étape de la synthèse (figure B du document réponse), est fondée sur un analogue de réaction de Diels-Alder entre le fumarate de diméthyle (composé 1) et le 3-sulfolène (composé 2), donneur de butadiène permettant d'obtenir le synthon 3. Le 3-sulfolène est obtenu en faisant réagir du butadiène avec du dioxyde de soufre. On propose dans cette partie d'étudier les aspects cinétiques et thermodynamiques de cette réaction. Co CX + SO IN RC O Figure 8 On trouve dans la littérature scientifique diverses études portant sur des réactions analogues à cette réaction. Des résultats expérimentaux relatifs à une réaction analogue utilisant un composé avec un « motif butadiène » (composé A) sont présentés ci-dessous. Partie construite à partir des articles suivants : -- T. Fernandez, J.A. Sordo, F. Monnat, B. Deguin, P. Vogel, Sulfur Dioxide Promotes Its Hetero-Diels-Alder and Chelotropic Additions to 1,2-Dimethylidenecyclohexane, J. Am. Chem. Soc., 120 (1998), 13276-13277 ; -- F. Monnat, P. Vogel, J.A. Sordo, Hetero-Diels- Aider and Chelotropic Additions of Sulfur Dioxyde to 1,2-Dimethylidenecycloalkanes. Determination of Thermochemical and Kinetics Parameters for Reaction in Solution and Comparaison with Estimates from Quantum Calculations, Helv. Chim. Acta., 85 (2002), 712-732. 2019-02-25 11:35:40 Page 6/9 (cc) BY-NC-SA Un composé avec un motif « butadiène » (composé A) réagissant avec du dioxyde de soufre peut conduire aux deux composés suivants : -- un composé de type « sulfolène » (composé B) issu d'une réaction dite « chélotropique » entre le motif butadiène et le dioxyde de soufre, -- un composé de type « sultine » (composé ©) issu d'une cycloaddition entre le dioxyde de soufre et le motif butadiène. O -- 20 = + 8m s£ O C A B Figure 9 Monnat et al. ont étudié l'influence de la température sur la composition de milieu réactionnel en fin de réaction. On trouve dans leur article l'information suivante : 150 mg de dioxyde de soufre et 40 mg de composé À sont dissous dans 0,3 mL d'un mélange de CD,CL et de CFCL en proportion 4 : 1. L'ensemble est placé à --75 °C. Au bout de 8 h, une analyse RMN montre que les composés B ct C sont présents avec un rapport B : C égal à 4 : 96. Lorsque ce mélange est réchauffé à --40 °C, le composé EUR est converti en B qui reste donc le seul composé présent dans le milieu réactionnel. T. Fernandez et al. ont suivi par RMN l'évolution temporelle du milieu réactionnel en travaillant à une tempé- rature fixée à 261 K. Ils ont obtenu les résultats donnés figure 10. 0,25 0,2 4 = 2 0,15 S 2 E --+-- ] 5 0,1 --#-- 2 a a 3 5 © 5 x 107? 0 à --À 0 50 100 150 200 250 300 350 400 450 500 550 600 Temps (min) Figure 10 Q 30. Déterminer quel produit est majoritaire sous contrôle cinétique et quel produit est majoritaire sous contrôle thermodynamique. Q 31. Attribuer les courbes d'évolution temporelle (figure 10) aux composés À, B et C. On émet l'hypothèse que la réaction conduisant au composé B suit un mécanisme concerté en une seule étape. Pour tester cette hypothèse une étude orbitalaire puis une étude cinétique sont menées. II.B.1) Étude orbitalaire Le tableau À du document réponse donne les orbitales frontalières du butadiène (modélisant le composé A), dans sa confirmation s-cis, ainsi que leur énergie. L'ensemble des orbitales moléculaires du dioxyde de soufre est donné dans le tableau B du document réponse. Pour chaque atome, seules les orbitales de valence ont été prises en compte. Les orbitales moléculaires sont présentées en colonnes. Elles contiennent les coefficients des orbitales atomiques à partir desquelles elles sont 2019-02-25 11:35:40 Page 7/9 (cc) BY-NC-SA construites, conformément à l'approche CLOA (Combinaison Linéaire d'Orbitales Atomiques). Le calcul a été réalisé en positionnant le dioxyde de soufre dans le plan (Ox2). En supposant que le mécanisme de la réaction entre le composé A cet le dioxyde de soufre soit concerté en une seule étape, l'étude orbitalaire permet de proposer la structure de la figure 11 pour l'état de transition de la réaction chélotropique. La figure 12 présente deux exemples afin de visualiser les propriétés stéréochimiques de cette réaction. O S Figure 11 TT O0 + SO» - SX o DS TT Dao) L9 + SO) > < + SK à : 2 50% 50 % Figure 12 Q 32. Déterminer la géométrie du dioxyde de soufre en utilisant le modèle de la VSEPR. Q 33. Justifier le nombre d'orbitales moléculaires du dioxyde de soufre présentées dans le tableau B. Q 34. Identifier, en justifiant, puis représenter l'orbitale du dioxyde de soufre permettant d'expliquer sa réactivité avec le butadiène. Les orbitales moléculaires du dioxyde de soufre peuvent être obtenues en étudiant le recouvrement entre le fragment «5 » et le fragment « O, allongé ». Q 35. Déterminer à partir de quelles orbitales de fragment l'orbitale identifiée à la question 34 a été construite. Préciser son caractère liant, non-liant ou antiliant d'une part et o ou x d'autre part. Q 36. Expliquer par des arguments orbitalaires pourquoi, dans l'état de transition proposé figure 11, le plan du dioxyde de soufre est perpendiculaire au plan du butadiène. Q 37. À l'aide des exemples de réactions fournis figure 12, déterminer si l'étude orbitalaire, ayant conduit à proposer l'état de transition représenté figure 11, permet de valider ou d'écarter l'hypothèse selon laquelle la réaction suit un mécanisme concerté en une seule étape. II.B.2) Étude cinétique On admet que les réactions de formation du sulfolène et de la sultine admettent un ordre. On définit : -- k,j4 la constante de vitesse de la réaction chélotropique conduisant au sulfolène (composé B) : -- k On définit la loi de vitesse de la réaction chélotropique comme la vitesse de formation du composé B : diB dt. «do là constante de vitesse de la réaction de cycloaddition conduisant à la sultine (composé C). -- Kehel [A]*[SO,J°. Une étude par RMN est conduite à 261 K dans des conditions de dégénérescence de l'ordre par rapport au dioxyde de soufre, ce qui amène à définir une constante de vitesse apparente k,,.. Les résultats montrent que l'ordre partiel par rapport au diène À vaut a = 1. 2019-02-25 11:35:40 Page 8/9 (CH)ELTET: En reproduisant l'expérience avec des concentrations initiales différentes en dioxyde de soufre et toujours en se plaçant dans des conditions de dégénérescence de l'ordre par rapport au dioxyde de soufre, on obtient les résultats présentés dans le tableau 1. (SO, 1, (mol-L-1) 4,68 9,55 12,64 15,16 10 &j, (min 1) 18,53 70,90 | 110,7 174,9 Tableau 1 Q 38. À l'aide des résultats expérimentaux. déterminer l'ordre partiel par rapport au dioxyde de soufre ainsi que la valeur de kr. Q 39. Déterminer si l'étude cinétique permet de valider ou d'écarter l'hypothèse selon laquelle la réaction suit un mécanisme concerté en une seule étape. La constante de vitesse de la réaction de cycloaddition vaut k,,x, = 6,4 X 10 * L'-mol *-min ! à 261 K. Le tableau 2 fournit les données thermodynamiques correspondant à la formation de B ou de EUR à partir de À ct du dioxyde de soufre. Formation de BFormation de C À,H° (kJ-mol"|) --58,6 --33,5 AÀ,S° (J-K7!:mol-*) --184 --151 Tableau 2 Q 40. Montrer que les résultats cinétiques et thermodynamiques précédents sont en accord avec les observa- tions expérimentales de Monnat et al. et de Fernandez et al. présentées page 7. II.B.3) Le 3-sulfolène, « donneur » de butadiène La réaction entre le 3-sulfolène (composé 2) et le fumarate de diméthyle (composé 1) conduit au composé 3 (figure B). La réaction est conduite à 105 °C. Q 41. Montrer qu'à cette température le 3-sulfolène se comporte comme un « donneur » de butadiène. Q 42. Donner la structure du composé 3 en précisant la stéréochimie de chaque stéréoisomère obtenu et la relation entre ses stéréoisomères. La détermination des stéréodescripteurs n'est pas attendue. eceerINeee 2019-02-25 11:35:40 Page 9/9 (cc) BY-NC-SA OO Numéro de place | | [el Numéro d'inscription | | 9iQnature t & Nom | | de . Prénom | | CONCOURS CENTAALE-SUPÉLEC Epreuve : Chimie PC Ne rien porter sur cette feuille avant d'avoir complètement rempli l'entête Feuille / -- Aluminium -- Or -- | 0 1 2 3 4 9 6 7 ë 9 10 IT 12 15 14 _2,5 Figure À Diagrammes potentiel-pH de l'aluminium et de l'or (T1 = 298 K) Ne rien écrire 2019-02-25 11:48 :01 X002-DR/20180913 MKIV dans la partie barrée #P Données Constante des gaz parfaits : R = 8.314 J-K !:mol !. Températures : T(K) = t(°C) + 273,15. Produit ionique de l'eau (à 25 °C) : pK, = 14. on RT Approximation à 298 K : F Im(10) & 0,06 V. Densité de solutions de soude à 20 °C % masse d'hydroxyde de sodium|0,16[9,19113,73/18,26119,16/20,07120,98/21,90122,82 densité 1,00/1,10) 1,15 | 1,20 | 1,21 | 1,22 | 1,23 | 1,24 | 1.25 Potentiels standard d'oxydoréduction à 25 °C _ + + 3+ Au(OH); (s) /Au, @r (g) /Hb O ii) NO, (aq) /NO/ AB (a) /Ag(s) ASC (a) /AscH; (aq) Ho /H (g) AP /Al 1,45 V 1,23 V 0,96 V 0,80 V 0,48 V 0,00 V | --1,66 V AscH, est l'acide ascorbique, Asc l'acide déshydroascorbique. Constantes d'acidité à 25 °C Acide ascorbique AscEL : pK 1, = 4,1: pK 49 = 11,8. Acide phosphorique H,PO, : pK 1, = 2,1: pK 9 = 7,2: pK y3 = 12,3. Masse molaire Acide ascorbique : M = 176 g-mol !. Extrait du tableau périodique des éléments Hydrogène | #-- Nom de l'élément Hélium 1 <-- Numéro atomique 2 H | <-- Symbole chimique He 1,0080 | «-- Masse molaire atomique 4,0026 Lithium Béryllium Bore Carbone Azote Oxygène Fluor Néon 3 4 D 6 7 8 9 10 Li Be B C N O F Ne 6,9395 || 9,0122 10,814/112,011 || 14,007 || 15,999 || 18,998 || 20,180 Sodium Magnésium Aluminium Silicium Phosphore Soulre Chlore Argon 11 12 13 14 15 16 17 18 Na | Mg AI Si P S CI Ar 22,990 || 24,306 26,982 || 28,085 || 30,974 || 32,068 || 35,452 || 39,948 Potassium Calcium Scandium Titane Vanadium Chrome Manganèse Fer Cobalt Nickel Cuivre Zinc Gallium ||Germanium Arsenic Sélénium Brome Krypton 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 39 36 K Ca SC Ti V Cr | Mn | Fe Co Ni Cu | Zn | Ga | Ge | As Se Br Kr 39,098 || 40,078 || 44,956 || 47,867 || 50,941 || 51,996 | 54,938 || 55,845 || 58,933 || 58,693 || 63,546 || 65,38 || 69,723 || 72,630 || 74,921 || 78,971 || 79,904! 83,798 Rubidium || Strontium Yttrium Zirconium Niobium Molybdène ||'Technétium|| Ruthénium || Rhodium Palladium Argent Cadmium Indium Étain Antimoine Tellure Ilode Xénon 37 38 39 40 AT 42 43 44 45 46 47 48 49 50 o1 92 93 54 Rb Sr Y Zr | Nb | Mo | Tc Ru | Rh | Pd | Ag | Cd In Sn Sb Te I Xe 85,467 || 87,62 || 88,906 | 91,224 || 92,906 || 95,95 [98] |1101,07 || 102,91 || 106,42 || 107,87 || 112,41 || 114,82 || 118,71 || 121,76 || 127,60 || 126,90 || 131,29 Césium Baryum Hafnium Tantale Tungstène Rhénium Osmium Iridium Platine Or Mercure Thallium Plomb Bismuth Polonium Astate Radon 55 56 72 73 74 75 76 77 78 79 80 81 82 83 84 85 86 Cs Ba Hf Ta W Re Os Ir Pt Au | Hg T1 Pb Bi Po At Rn 132,91 || 137,33 178,49 |180,948|| 183,84 || 186,21 || 190,23 || 192,22 || 195,08 || 196,97 || 200,59 || 204,38 || 207,2 || 208,98 || [209] [210] [222] Schéma de synthèse du Siméprévir H3CO,C hydroquinone, EtOH étapes ' [js 105-110 ; CO:CH3 o -------------- non étudiées étape EE ---- non étudiée pyridine, 25°C 7 LiOH L | O 7 amine À, EEDQ THF, CH3OH, H,0 OH O O- N < O- 0 6 THF reflux O°C O OH L \ \ 10, PPh3, DIAD, THF -15°C à 25 °C NS O NX NH dl ES O OK \ | T T Siméprévir 15, DBU étape O _ THF, 50°C non étudiée : DL RE ON V [>--S0,NH, Figure B Schéma de synthèse du Siméprévir Données sur les orbitales du butadiène HO Énergie (eV) --9,22 Tableau À Orbitales frontalières du butadiène et du dioxyde de soufre Numéro OM 1 2 3 4 5 6 Énergie (eV) --37,92 | --37.04 | --19.88 | --17.22 | --16,80 | --16.26 Soufre 3s | 0,00000! 031270! 0,63352| 0.00000 | 0,00000 | --0.30320 3p, | 0,40929! 0,00000! 0,00000! 0,00000 | --0,46388| 0,00000 3p, | 0,00000! 0,00000! 0,00000! 0,65481 | 0,00000! 0,00000 3p. | 0,00000! 0,26170) 0,11524| 0,00000 | 0,00000! 0,53902 Oxygène | 2s | 0,62607| 0,62078|--0.,31038| 0,00000 | 0,28468 | --0,07190 2p, |--0,11866|--0,16800|--0,41246| 0,00000 | 0,30325|--0,28791 2p, | 0,00000! 0,00000! 0,00000! 0,53443 | 0,00000! 0,00000 2p. |--0,10100!--0,05717|--0,16195| 0,00000 | 0,46841| 0,46979 Oxygène | 2s |--0,62607| 0,62078|--0,31038| 0,00000 | --0,28468 | --0,07190 2p, |--0,11866| 0,16800| 0,41246| 0,00000 | 0,30325| 0,28791 2p, | 0,00000! 0,00000! 0,00000! 0,53443 | 0,00000! 0,00000 2p. | 0,10100|--0,05717|--0,16195| 0,00000 | --0,46841| 0,46979 Numéro OM 1 8 9 10 11 12 Énergie (eV) --12,97 | --12,50 | --10,10 | --1,03 1,64 2,40 Soufre 3s | 0,00000! 0.00000! 0,51398| 0,00000! 0,38048| 0.,00000 3p, |--0,06446| 0,00000! 0,00000! 0,00000! 0,00000! 0,78303 3p, | 0,00000! 0,00000! 0,00000! 0,75580| 0,00000! 0,00000 3p. | 0,00000! 0,00000!--0,46052| 0,00000! 0,64468| 0,00000 Oxygène | 2s | 0.05773| 0.,00000! 0,04150| 0,00000!--0,10676 | --0,15384 2p, | 0,55789| 0,00000! 0,10302| 0,00000! 0,45623| 0,28761 2p, | 0,00000! 0,70711| 0,00000!--0,46302) 0,00000! 0,00000 2p. |--0,42819| 0,00000! 0,49954| 0,00000! 0,01620| 0,29504 Oxygène | 2s |--0.05773| 0.,00000! 0,04150| 0,00000 --0,10676| 0,15384 2p, | 0,55789| 0,00000--0,10302| 0,00000!--0,45623| 0,28761 2p, | 0,00000--0,70711| 0,00000!--0,46302| 0,00000! 0,00000 2p. | 0,42819| 0,00000! 0,49954| 0,00000! 0,01620 | --0,29504 Tableau B Orbitales moléculaires (OM) du dioxyde de soufre Tableaux construits à l'aide des orbitales fournies dans la base de donnée d'Orbimol (http://www.lct.jussieu.fr/pagesperso/orbimol/fr/index-fr.shtml)