Centrale Chimie PC 2022
| Thème de l'épreuve | Seringues optiques pour la photolibération localisée de principes actifs |
| Principaux outils utilisés | solutions aqueuses, cinétique chimique, oxydoréduction, chimie organique, orbitales moléculaires, informatique pour tous |
| Mots clefs | excitation biphotonique, ester cinnamique, mesure pKa, fluorescence, oxazolone, coumarine |
Corrigé
:👈 gratuite pour tous les corrigés si tu crées un compte
👈 l'accès aux indications de tous les corrigés ne coûte que 1 € ⬅ clique ici
👈 gratuite pour tous les corrigés si tu crées un compte
- - - - - - - - -
👈 gratuite pour ce corrigé si tu crées un compte
- - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - -
Énoncé complet
(télécharger le PDF)











Rapport du jury
(télécharger le PDF)




Énoncé obtenu par reconnaissance optique des caractères
Lai
Chimie
PC
4 heures Calculatrice autorisée
2022
Seringues optiques pour la photolibération
localisée de principes actifs
Les entités chimiques biologiquement actives utilisées comme principes actifs
dans les médicaments sont tra-
ditionnellement introduites dans l'organisme par voie orale, intraveineuse ou
intramusculaire. Ces méthodes
présentent une résolution spatiale très faible. Des techniques de
micro-injections permettent de mieux cibler la
zone d'action du produit, mais elles sont invasives, car elles induisent une
altération des tissus traversés.
Ce sujet propose d'étudier des systèmes qualifiés de « seringue optique »
développés récemment dont le fonc-
tionnement est décrit ci-après.
Un principe actif est rendu biologiquement inerte en bloquant son site
d'interaction spécifique au moyen d'un
groupement protecteur photoactivable. Le principe actif ainsi protégé est
introduit dans un organisme par
pénétration directe au travers des membranes cellulaires. Une excitation
biphotonique délivrée par un laser
pulsé permet de déprotéger le principe actif in vivo avec une résolution
spatiale subcellulaire.
Ce type de système permet de délivrer un principe actif à l'échelle d'une
unique cellule voire d'un organite
cellulaire et cela sans altération des tissus.
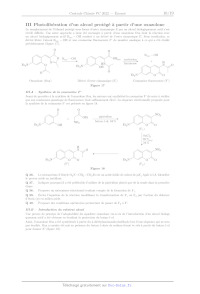
principe
+
protection FEii
introduction
dans un organisme
sous
produit
principe
Et il)
principe
actif
--------------+
excitation biphotonique
LS e) CUS
biologique
Rose) TU TS
biologique
organisme organisme
Figure 1 Schéma de la libération d'un principe actif dans un organisme par une
seringue optique
Ce sujet se compose de quatre parties. La première compare l'excitation
monophotonique classique et l'excitation
biphotonique. Les deux suivantes étudient deux types de groupements protecteurs
photoactivables utilisés pour
protéger des alcools. La quatrième conclut l'étude proposée.
Certaines données utiles sont regroupées en fin d'énoncé. Ce sujet est
accompagné d'un document réponse à
rendre avec la copie, même s'il n'a pas été utilisé. Ce document réponse
contient le tableau périodique des
éléments.
Quelques publications sur le sujet :
-- Angewandte Chemie - International Edition, 46 (1/4), p. 2467-2469, 2007.
-- Org. Lett., 10 (12), p. 2341-2344, 2008.
-- Zebrafish, 7 (2), p. 199-204, 2010.
X005/2022-02-28 10:18:06 Page 1/15 (Ghsey-\c-sa |
I Comparaison des excitations mono et biphotonique
L'excellente résolution spatiale des seringues optiques est basée sur
l'excitation biphotonique des entités chi-
miques protégées. Cette partie étudie les points communs et les différences
entre les excitations monophotonique
et biphotonique.
I. A --- Excitation monophotonique
L'excitation monophotonique d'une entité chimique correspond à l'absorption
d'un photon d'énergie adaptée
qui fait passer l'entité de son état fondamental à un état excité.
E à
-------- état excité
NAARAAANN + excitation à un photon
état fondamental
Figure 2 Diagramme énergétique rendant compte du processus d'excitation d'une
entité chimique par
absorption d'un photon de longueur d'onde À, (en considérant seulement deux
états possibles)
Q 1. Relier la différence d'énergie entre les deux états de l'entité à la
longueur d'onde À,.
Pour mettre en évidence ce phénomène, le spectre d'absorption de l'ion
hexaaquatitane (111) Ti(H0)E aa) a
été enregistré. Pour cela, du chlorure de titane (IV) TiCL,,,, a été dissous
dans de l'acide chlorhydrique de
concentration égale à 1 mol-L-. Un excès de poudre de zinc a été ajouté. Après
filtration, la solution obtenue a
été rapidement transférée dans une cuve de 1 cm de longueur qui a ensuite été
placée sous atmosphère d'argon
et scellée. Le spectre UV-visible a ensuite été enregistré et est reproduit en
figure 3.
0,50
0,40 --
0,30 --
A
0,20 --
0,10 --
0,00 | |
400 D0Ù 600 700
À (nm)
Figure 3 Spectre d'absorption d'une solution de Ti(H0)E a) dans l'acide
chlorhydrique
Q 2. Écrire l'équation de la réaction modélisant la formation du complexe T0)
dans cette expé-
rience.
Q 3. Expliquer pourquoi la solution de Ti(H0)E a) doit être gardée sous
atmosphère d'argon.
Q 4. Écrire la configuration électronique de valence de l'ion Ti** dans son
état fondamental.
3+
Q 5. La figure À du document réponse donne le diagramme d'orbitales
moléculaires (OM) de Ti(H30)",
complexe de géométrie octaédrique. Compléter ce diagramme avec les électrons de
valence du complexe dans
l'état fondamental. On considèrera que l'eau est un ligand o-donneur pur.
Q 6. Sur le diagramme d'orbitales moléculaires, représenter par une flèche la
transition électronique respon-
sable de l'absorption d'un photon dans le visible. Évaluer la valeur (en
électron-volt, eV) de l'écart énergétique
entre les deux orbitales moléculaires impliquées.
X005/2022-02-28 10:18:06 Page 2/15 (C)EATETSS
I.B --- Ezxcitation biphotonique
Au début des années 1930, Maria Gôppert-Mayer a proposé une théorie selon
laquelle une entité chimique
peut passer de son état fondamental à un état excité lorsqu'elle absorbe
simultanément deux photons de même
longueur d'onde notée À.
Ea
l état excité
AAAARAAIN
h 4excitation à deux photons
ANARAAARRAAIN
état fondamental
Figure 4 Diagramme énergétique rendant compte du processus d'excitation d'une
entité chimique par
absorption simultanée de deux photons de longueur d'onde À, (en considérant
seulement deux états possibles)
Q 7. Déterminer la relation entre À, et À,. En déduire le type de rayonnement à
utiliser pour irradier une
solution du complexe Ti(H0)E oo) afin de provoquer son excitation biphotonique.
Une excitation biphotonique est observée lorsqu'un échantillon est irradié par
un laser pulsé dont le faisceau
est concentré au niveau du point focal image d'une lentille convergente. Avec
le même montage optique, une
excitation monophotonique aurait lieu sur tout le trajet lumineux (figure 5).
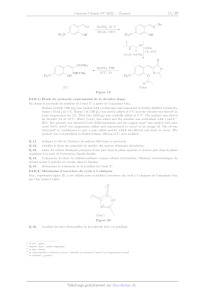
Photon --**""#
D < Zone Le excitée Échantillon Excitation Excitation à 1 photon à 2 photons Figure 5 Comparaison des zones concernées par l'excitation monophotonique et biphotonique Ceci est illustré par la photographie de la figure 6 qui présente une cuve spectroscopique contenant une espèce fluorescente (qui émet une lumière jaune lorsqu'elle est irradiée). En haut de la cuve, la solution est soumise à une excitation monophotonique (notée 1P) : l'émission de lumière a lieu sur toute la longueur de la cuve. En bas, la solution est soumise à une excitation biphotonique (notée 2P) : l'émission de lumière a lieu seulement au centre de la cuve (point blanc indiqué par une flèche). Figure 6 Crédits : W.B. Amos et M. Cipollone Q 8. Proposer une explication pour rendre compte du fait que l'excitation biphotonique ne peut avoir lieu qu'au niveau du point focal image d'une lentille convergente. Dans l'ouvrage collectif Photosensitive Molecules for Controlling Biological Function, James Chambers et Ri- chard Kramer affirment que L'excitation à deux photons présente principalement trois avantages par rapport aux procédés conven- tionnels d'excitation à un photon unique : 1. l'excitation est localisée dans un volume de l'ordre du femtolitre (1fL = 1 x 10 ° L qui est environ le volume d'une bactérie Æ. coli), de sorte que la photo-déprotection peut n'être limitée qu'à une cellule spécifique voire à une région cellulaire ; 2. il y a moins de photo-dégradation des tissus biologiques ; 3. la pénétration dans l'échantillon est plus profonde. X005/2022-02-28 10:18:06 Page 3/15 (cc) BY-NC-SA Les caractéristiques d'un laser pulsé utilisé pour une excitation biphotonique sont données en figure 7. EN 300 + £ -- -- longueurs d'onde : 700 à 980 nm OU & -- puissance de crête pendant une impulsion : 300 kW oe À -- durée d'une impulsion : 50 fs 2, -- fréquence de répétition : 76 MHz 0 temps | Figure 7 Caractéristiques d'un laser pulsé Q 9. Déterminer la puissance moyenne du laser pulsé et la comparer à la puissance de crête. Relier cette comparaison à un des avantages cités par James Chambers et Richard Kramer. Q 10. En vous basant sur l'étude du spectre d'absorption des entités chimiques présentes dans une cellule animale proposé en figure 8, expliquer pourquoi l'excitation biphotonique permet une pénétration plus profonde dans une cellule animale que l'excitation monophotonique. 106 ss... eau 5 _ . LOT protèêines LR ; OCT hémoglobines 10 -- 1 : \ ------ mélanines PTS 4 . \ = 10° Fe : \ oe : \ T 2 x 1 | 3 0 2 10 - GO 10° _] _] 10 | | | | En © © © OO © OO OO OO OO © (em) (em) OO OO OO OO OO OO OO © -- ON CS + 1 CO T- DO © D À (nm) Figure 8 Spectre d'absorption des entités chimiques présentes dans une cellule animale (l'axe des ordonnées est gradué en coefficient d'absorption molaire) II Photolibération d'un alcool protégé sous forme d'ester cinna- mique Une première méthode pour rentre inactif un alcool biologiquement actif (noté R;,, -- OH dans la figure 9) consiste à le protéger sous forme d'ester cinnamique. Sous irradiation, le principe actif est libéré de manière quantitative ainsi qu'un sous-produit qui est ici une coumarine fluorescente (voir sous-partie ILE). | Br NS : Rbio Br O excitation R,--OH + lumineuse L D HO OH HO O O Br Br principe actif protégé principe actif coumarine sous forme d'ester cinnamique libéré fluorescente Figure 9 Cette partie présente la synthèse d'un ester cinnamique puis étudie la photo-déprotection de l'alcool puis enfin la fluorescence de la coumarine libérée. X005/2022-02-28 10:18:06 Page 4/15 (C)EATETSS IT. À -- Synthèse d'un alcool protégé Pour démontrer l'efficacité de la méthode, on étudie l'ester cinnamique E où l'alcool protégé R;,,, -- OH est de l''éthanol Et -- OH. Le schéma de synthèse correspondant est proposé en figure 10. Br SO SO Bro ACOH, 55% LL HO OH 'Ho oH © Br Br SNS Et toluène 0 (A) (B) 0% HO OH 1) PPh;, toluène Br 2) NaOH, eau, 60% (E) (C) (D) Figure 10 Q 11. Expliquer pourquoi, dans les laboratoires, le dibrome est souvent remplacé par le tribromure de pyri- dinium qui a la même réactivité chimique que le dibrome. Q 12. Proposer des structures pour les espèces C et D. Q 13. Indiquer le rôle de la soude dans la seconde étape de la transformation menant de C à D. Avant d'entreprendre la transformation menant à E, une protection des groupes caractéristiques hydroxyle de B peut être envisagée. Plusieurs groupements protecteurs sont proposés dans le tableau 1. Groupement protecteur | Conditions de protection Conditions de déprotection o 1) NaH -- R--OH > -- ?
Bromure de benzyle 2) BrCH, Ph CN), !
| CISI(CE )» /
Chlorure de triméthylisilyle | R -- OH -- > R--O--Si-- |Bu,NF
pyridine \
1) NaH Solution aqueuse d'acide
R -- OH > R--O--
Chlorométhyloxyméthane 2) CICH,OCH, sulfurique H,SO,
1) NaH RO
R -- OH >
Chlorure d'o-nitrobenzyle 2) C ON Lumière (À & 300 nm)
l
ox)
Tableau 1
Q 14. Expliquer pourquoi protéger B peut s'avérer nécessaire.
Q 15. Proposer des conditions pour la déprotection d'un phénol protégé par le
bromure de benzyle.
Q 16. Donner le mécanisme de la protection de l'alcool noté R--OH par le
chlorométhyloxyméthane. Justifier
l'utilisation de la solution aqueuse d'acide sulfurique H,S0, pour la
déprotection associée.
Q 17. Identifier le groupement protecteur le plus adapté en vue de la synthèse
de E.
II.B -- Mécanisme de la photo-déprotection de l'éthanol
Sous irradiation, une liaison C = C de l'entité chimique E s'isomérise, ce qui
conduit à la formation de l'entité
Z. Cette dernière évolue spontanément pour conduire à la libération de
l'éthanol ainsi qu'à la formation de la
coumarine fluorescente F (figure 11).
|
Br NS Br
O excitation évolution Et_OH +
lumineuse spontanée L
D
HO OH HO O O
Br Br
(E) (F)
Figure 11
X005/2022-02-28 10:18:06 Page 5/15 (C2) BY-Nc-SA |
Q 18. Représenter la structure de Z. Citer la relation de stéréo-isomérie qui
existe entre les espèces chimiques
Q 19. Proposer un mécanisme permettant d'expliquer la libération de l'éthanol
et la formation de la couma-
rine F à partir de Z. Expliquer pourquoi cette transformation ne peut pas avoir
lieu pour l'espèce E.
IT.C -- Suivi de la photo-déprotection de l'alcool par spectroscopie de RMN du
proton
Le spectre de RMN 'H de l'ester cinnamique E dans un solvant deutéré est
reproduit en figure B du document
réponse.
Q 20. Attribuer chacun des signaux du spectre en complétant le tableau À du
document réponse avec les
lettres a, b, c, d, e ou avec le symbole g.
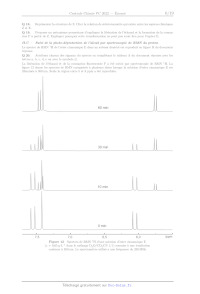
La libération de l'éthanol et de la coumarine fluorescente F a été suivie par
spectroscopie de RMN 'H. La
figure 12 donne les spectres de RMN enregistrés à plusieurs dates lorsque la
solution d'ester cinnamique E est
illuminée à 350 nm. Seule la région entre 5 et 8 ppm a été reproduite.
60 min
_
_ulll me 1]
lu [hu
JA v
7,5 7,0 6,5 6,0 Jppm
Figure 12 Spectres de RMN H d'une solution d'ester cinnamique E
(c = 0,65 g-L_! dans le mélange D,0/CD;CN 1/1) soumise à une irradiation
continue à 350 nm. Le spectromètre utilisé a une fréquence de 250 MHz
_
X005/2022-02-28 10:18:06 Page 6/15 (C2) BY-Nc-SA |
Q 21. Indiquer les informations que ces données expérimentales permettent de
fournir sur la conversion de
l'ester cinnamique E.
Q 22. Déterminer les valeurs des constantes de couplage (en hertz) des protons
responsables des doublets
dans le spectre initial et dans le spectre à 60 min. Montrer que les valeurs
trouvées sont en accord avec le schéma
de photo-déprotection proposé.
ITI.D -- Compromis hydrophile-lipophile de l'ester cinnamique E
Les milieux biologiques présentent des valeurs de pH comprises entre 4,5 et
7,4. Aïnsi, pour une application
in vivo, une espèce utilisée comme seringue optique doit pouvoir passer
facilement d'une forme neutre soluble
dans les milieux lipophiles, comme les bicouches lipidiques, à une forme
chargée soluble dans l'eau. Cette nature,
tantôt lipophile, tantôt hydrophile, notamment liée aux différentes formes
acido-basiques de l'espèce chimique,
lui permet de traverser la membrane d'une cellule.
Pour étudier l'utilisation potentielle de l'ester cinnamique E comme seringue
optique, ses constantes d'acidité
ont été mesurées par spectrophotométrie.
Pour cela, une solution de l'ester cinnamique E à une concentration de 5,6
amol-L-! est préparée dans une
solution tampon universel contenant un mélange d'acides borique, acétique et
phosphorique à 0,1 mol-L-*. La
température est maintenue à 20 °C.
Le pH de la solution ainsi préparée est réglé par ajout de soude ou d'acide
chlorhydrique concentrée (> 5mol-L-1).
Pour chaque valeur de pH, un spectre d'absorption est enregistré. Les
différents spectres sont reproduits sur la
figure 13. Deux expériences ont été réalisées, la première en allant de pH =
6,8 à pH = 3,0 (graphe de gauche)
et la seconde en allant de pH = 6,3 à pH = 9,0 (graphe de droite).
15- 15- |
pH = 6,8
pH = 3,0 _
1,0 L À 1,0 [
< < 0,5 + l 0,5 - pH = 6,8 pH = 3,0\ 0 | | DJ 0 250 300 350 400 450 250 À /nm Figure 13 Gauche : spectres d'absorption pour PH = 3,0 ; 3,7 ; 4,4: 4,7; 5,2; 5,7; 6,3 : 6,6 ; 6.8. Droite : pour pH = 6,3; 6.6; 6.8 ; 7,0: 7,2; 74: 7,6: 7,8 ; 8,0 ; 8,1 ; 8,3; 8,5 ; 8,7 ; 8.8 ; 8,9 ; 9,0 L'étude du graphe de droite combinée à l'utilisation d'un tableur a permis de déterminer la valeur de l'un des pK, de l'ester cinnamique E. Les résultats fournis par le tableur, en conservant toutes les décimales, sont 8,431478 pour le pK, et 0,085329 pour l'incertitude associée à un niveau de confiance de 95 %. Q 23. Exprimer le résultat de la mesure de ce pK. Le tableau 2 correspond au relevé de l'absorbance en fonction du pH à À = 365 nm pour le graphe de gauche. pH 3,0 3,7 4,4 4,7 5,2 5,7 6,3 6,8 Absorbance (365) 0,13 0,21 0,42 0,60 0,87 1,11 1,24 1,25 Tableau 2 Q 24. Associer, en justifiant, une structure moléculaire à chaque forme acido-basique de l'ester cinnamique E notées AH,, AH et A*T. Q 25. Déterminer, à l'aide des données du tableau 2, la valeur de l'autre pK, de l'ester cinnamique E. Pour cela, on pourra d'abord démontrer que [H30°,,/(A -- À,H=3,0) -- K,(Aou-6.8 -- A). Q 26. Conclure quant à l'utilisation potentielle in vivo de l'ester cinnamique E en tant que seringue optique. X005/2022-02-28 10:18:06 Page 7/15 (C2) BY-Nc-SA | IT.E -- Application de la fluorescence moléculaire au suivi de la photo-déprotection Une entité est dite fluorescente lorsqu'après avoir été excitée par absorption d'un ou de deux photons, elle revient à l'état fondamental en émettant un nouveau photon (désexcitation radiative). La état excité À AA VA A NA photon émis --"------ état fondamental Figure 14 Diagramme énergétique rendant compte du processus de désexcitation radiative d'une entité chimique qui a été préalablement excitée par absorption d'un ou de deux photons (en considérant seulement deux états possibles) L'intensité de la lumière émise par un échantillon contenant une entité fluorescente est appelée intensité de fluorescence. Elle peut être mesurée par un fluorimèêtre. Pour cela, une cuve spectroscopique de longueur £ reçoit un rayonnement incident d'intensité /, qui excite les entités chimiques présentes. L'entité fluorescente se désexcite en émettant de la lumière dont un photo-récepteur mesure l'intensité 7, (exprimée en unité arbitraire U.a..). Dans la suite, on considère qu'une seule espèce chimique absorbe la lumière à la longueur d'onde de l'étude. Q 27. Rappeler l'expression de l'absorbance À en fonction de l'intensité du rayonnement incident 1, et de l'intensité du rayonnement transmis J,. On note ®,;, le rendement quantique de fluorescence qui est défini comme le rapport du nombre de photons émis par fluorescence sur le nombre de photons absorbés par la molécule. Q 28. Relier Z, à 1,, A et D. En se plaçant à haute dilution, on peut faire le développement limité 1074 & 1 -- 2,3. 29. Dans cette hypothè SE, montrer que l'intensité de fluorescence s'écrit où X une constante dont on donnera l'expression en fonction de ®;;, de £, du coefficient d'absorption molaire de l'espèce chimique qui absorbe la lumière (noté EUR). Lors de la photo-déprotection d'un principe actif protégé sous forme d'ester cinnamique, la coumarine fluo- rescente F est libérée. Comme ni l'ester cinnamique ni le principe actif ne sont fluorescents, la quantité de coumarine libérée (et donc l'avancement de la photo-déprotection) peut être suivi en mesurant l'intensité de fluorescence de la solution au cours du temps. Dans l'expérience présentée ci-après, une solution de l'ester cinnamique E (à la concentration EUR, = 5,7 pmol-L-{ dans un mélange d'acétonitrile (CH; CN) et de tampon tris(hydroxyméthyl)aminométhane fixé à pH = 7) a été irradié à 350 nm avec une intensité lumineuse? 1, = 12,9 x 10 E-min !. L'intensité de fluorescence à 450 nm a été mesurée au cours du temps et la courbe obtenue est présentée en figure 15 (u.a. signifie « unité arbitraire »). Pour rendre compte des résultats expérimentaux, une modélisation microscopique a été proposée avec le méca- nisine suivant k] E Z réactions photochimiques k_7 k Z --" > EtOH + EF réaction non photochimique
Les valeurs numériques de k,, k_, et k, ont pu être mesurées et sont fournies
dans le tableau 3
Q 30. Établir, d'après ce modèle, les trois équations différentielles
auxquelles obéissent les concentrations
des espèces E, Z et F.
Dans un premier temps, on se place dans l'hypothèse où la transformation de E
en Z conduit à un équilibre
rapide du système, la réaction ayant une constante thermodynamique d'équilibre
K°.
1
L'intensité de la lumière excitatrice est donnée en E-min * (einstein par
minute) où un einstein correspond à l'énergie lumineuse
absorbée par une mole de réactif.
X005/2022-02-28 10:18:06 Page 8/15 (C2) BY-Nc-SA |
Ir (u.a.)
0 2000 AO0Û GO00
t (s)
Figure 15
k. k_. ko
1,8 x 107*s7! 3,2 x 10 *s7! 2,2 x 107* st
Tableau 3
Q 31. Montrer que la concentration en coumarine F vérifie alors une équation
différentielle du type
diF1 _
TH + a[F] = ac.
Exprimer la constante a en fonction de k, et K"°.
Q 32. En déduire l'expression de l'évolution temporelle de la concentration en
coumarine F en fonction du
temps.
Q 33. À l'aide du résultat de la question 29, déterminer l'expression de
l'intensité de fluorescence IF en
fonction du temps en supposant que seule la coumarine F contribue à la
fluorescence. Identifier la ou les
caractéristiques de la courbe expérimentale qui valident le modèle obtenu et
celles qui l'invalident.
Pour améliorer le modèle, l'hypothèse d'un équilibre entre E et Z est
abandonnée. Le programme Python de la
figure C du document réponse a été écrit pour résoudre le système des trois
équations différentielles établies à
la question 30 puis pour tracer l'intensité de fluorescence en fonction du
temps.
Q 34. Dans le programme proposé en figure C du document réponse, certaines
lignes sont incomplètes.
Compléter les parties manquantes.
Q 35. Le graphe obtenu lors de la mise en oeuvre de ce programme est reproduit
en figure 16. Expliquer en
quoi ce modèle est plus fidèle aux résultats expérimentaux que le premier
modèle.
Ir (u.a.)
| | | | |
0 1000 2000 3000 4000 9000 6000
t (s)
Figure 16
X005/2022-02-28 10:18:06 Page 9/15 (C2) BY-Nc-SA |
IIT Photolibération d'un alcool protégé à partir d'une oxazolone
Le remplacement de l'éthanol protégé sous forme d'ester cinnamique E par un
alcool biologiquement actif s'est
révélé difficile. Une autre approche a donc été envisagée à partir d'une
oxazolone Oxa dont la réaction avec
un alcool biologiquement actif R,,, -- OH conduit à un dérivé de l'ester
cinnamique FE'. Sous irradiation, ce
dérivé libère l'alcool R;,, -- OH et une coumarine fluorescente F" de manière
analogue à ce qui a été étudié
précédemment (figure 17).
Ô
K | | R,.. -- OH
0 R;;, -- OH D Oki excitation
FLN umineuse N
2 O Et,N OH Ld D Lé
FT NL O
OÔ NS
Et, N 07 YO
Oxazolone (Oxa) Dérivé d'ester cinnamique (EF) Coumarine fluorescente (F"°)
Figure 17
IIT. À -- Synthèse de la coumarine F°
Avant de procéder à la synthèse de l'oxazolone Oxa, les auteurs ont synthétisé
la coumarine F"° de sorte à vérifier
que son rendement quantique de fluorescence était suffisamment élevé. La
séquence réactionnelle proposée pour
la synthèse de la coumarine F? est précisée en figure 18.
@ OÔ
| ur NO,
+ a OEt pipéridine | NS
NO, butan-1-ol, 84% LC
Et,N OH Et, N 07 "oO
(F)
SnCL
HCI,2 0)
76%
N NH
S É . Sr
Et,N O So Et, N O So
(F?) (F2)
Figure 18
Q 36. Le nitroacétate d'éthyle ON --CH, --CO,Et est un acide faible de valeur
de pK, égale à 5,8. Identifier
le proton acide en justifiant.
Q 37. Indiquer pourquoi il a été préférable d'utiliser de la pipéridine plutôt
que de la soude dans la première
étape.
Q 38. Proposer un mécanisme réactionnel rendant compte de la formation de F;.
Q 39. Écrire l'équation de la réaction modélisant la transformation de F, en F,
par l'action du chlorure
d'étain (11) en milieu acide.
Q 40. Proposer des conditions opératoires permettant de passer de F, à F°
ITI.B -- Introduction du substrat alcool
Une preuve de principe de l'adaptabilité du squelette oxazolone vis-à-vis de
l'introduction d'un alcool biologi-
quement actif a été obtenue en étudiant la protection du butan-1-ol.
Ainsi, l'oxazolone Oxa a été synthétisée à partir du
4-diéthylaminosalicyladéhyde lors d'une séquence qui ne sera
pas étudiée. Oxa a ensuite été mis en présence du butan-1-olate de sodium formé
in situ à partir du butan-1l-ol
pour donner FE? (figure 19).
X005/2022-02-28 10:18:06 Page 10/15 CETTE
NN OO OO À
SO BuNH,, 25 °C SN
30 min, 100%
COOBu
D BuONa. THF
NHCOMe 10°C, 2h
Et,N H
(E?)
Figure 19
III.B.1) Étude du protocole expérimental de la dernière étape
On donne le protocole de synthèse de l'ester E" à partir de l'oxazolone Oxa.
Q 41.
Q 42.
Q 43.
Sodium hydride (200 mg) was washed with cyclohexane and suspended in freshly
distilled tetrahydro-
furane (10 mL) at 0 °C. Butan-1-ol (500 1L) was slowly added at 0 °C and the
mixture was stirred at
room temperature for 2h. Then Oxa (853 mg) was carefully added at 0 °C. The
mixture was stirred
for another 2h at 10 °C. Water (5 mL) was added and the solution was
neutralized with 1 mol-L*
HCI. The mixture was extracted with dichloromethane and the organic layer! was
washed with satu-
rated NaCI, dried* over magnesium sulfate and concentrated in vacuo$ to an
orange oil. The oil was
triturated? in cyclohexane to give a pale yellow powder which was filtered and
dried in vacuo. The
product was recrystallized in dichloroethane. 695 mg of E' were isolated.
Indiquer le rôle de l'hydrure de sodium Na dans ce protocole.
Justifier le choix des quantités de matière des espèces chimiques introduites.
Lister les entités chimiques présentes d'une part dans la phase aqueuse et
d'autre part dans la phase
organique à la suite de l'extraction liquide-liquide.
Q 44.
Commenter le choix du dichlorométhane comme solvant d'extraction. Plusieurs
caractéristiques du
solvant seront à prendre en compte dans la réponse.
Q 45.
Déterminer le rendement de la synthèse de l'ester E?
III.B.2) Mécanisme d'ouverture du cycle à 5 chaïnons
Oxa', représentée figure 20, a été utilisée pour modéliser l'ouverture du cycle
à 5 chainons de l'oxazolone Oxa
par l'ion butan-l-olate.
Q 46.
(Oxa')
Figure 20
Localiser les sites électrophiles de la molécule Oxa' en justifiant.
to stir : agiter
organic layer : phase organique
to dry : sécher
to concentrated a solvent in vacuo : distiller un solvant à l'aide d'un
évaporateur rotatif
to trilurate : gratter
X005/2022-02-28 10:18:06 Page 11/15 (C2) 8Y-Nc-sA |
Les surfaces d'isodensité des orbitales moléculaires frontalières de la
molécule Oxa' sont reproduites en figure 21.
Le tableau 4 précise les coefficients portés par chaque atome dans la HO (plus
haute orbitale moléculaire occupée)
et dans la BV (plus basse orbitale moléculaire vacante) ainsi que les charges
électroniques partielles de chaque
atome.
L FA " 4 Ô #4
CR)
Ne 3
HO BV
Figure 21
Atome 1 2 3 4 5 6 7
Coefficient dans la HO --0,46 --0,31 0,49 0,36 --(0,41 0,05 0,34
Coefficient dans la BV 0,64 --0,39 --0,26 0,46 --0,03 --0,38 0,45
Charge partielle --0,10 0,04 --0,28 0,24 --0,25 0,30 --(0,22
Tableau 4 Valeurs calculées à l'aide du site MolCalc
Q 47. Interpréter la régiosélectivité de l'ouverture du cycle à 5 chainons de
la molécule Oxa par l'ion butan-
1-olate.
Q 48. Proposer un mécanisme réactionnel pour cette ouverture de cycle. On
pourra l'écrire sur la molécule
Oxa'
On aurait pu imaginer la formation de l'espèce E"' au lieu de la formation de
E? (figure 22).
O O
|
NT OBu NT OBu
AN NX
O OH
(E?) (E")
Figure 22
Q 49. Estimer la valeur de l'enthalpie standard de la réaction E' = E7".
Commenter.
Q 50. En supposant que les entropies molaires standard des formes E' et E""
sont égales, montrer que l'équi-
libre entre FE' et E"° est fortement en faveur de E? à 10 °C.
Q 51. Indiquer s'il faut augmenter ou diminuer la température pour augmenter la
proportion de E". Démon-
trer ce résultat. Commenter alors la valeur de température choisie.
IV Conclusion
Q 52. À la lumière de ce qui a été étudié dans ce sujet, citer des propriétés
d'une seringue optique adaptée
à la photo-déprotection d'un principe actif in vivo.
Page 12/15 (CERTES
X005/2022-02-28 10:18:06
Données
Données relatives à certaines espèces chimiques®
Dibrome
Formule brute Br;
Masse molaire 159,81 g:mol"*
Propriétés physiques
Température de fusion --7,2 °C
Température d'ébullition 58,8 °C
Pression de vapeur saturante à 20 °C 23,3 kPa'
Mentions de danger
H314 Provoque de graves brulures de la peau et de graves lésion des
LES Y. veux
H330 Mortel par inhalation
H400 Très toxique pour les organismes aquatiques
Tribromure de pyridium
Formule brute CHSNH", Br,
Masse molaire 319,82 g-mol"!
Propriétés physiques
Température de fusion 132-134 °C
Mentions de danger
H314 Provoque de graves brulures de la peau et de graves lésion des
HE à yeux
H335 Peut irriter les voies respiratoires
Dichlorométhane
Formule brute CH CL
Masse molaire 83,933 g-mol-!
Propriétés physiques
Température de fusion --95,1 °C
Température d'ébullition 40,0 °C
Mentions de danger
H315 Provoque une irritation cutanée
H319 Provoque une sévère irritation des yeux
H336 Peut provoquer une somnolence ou des vertiges
H351 Susceptible de provoquer le cancer
8 Extraites du site du fournisseur de produits chimiques Sigma-Aldrich.
% Pour l'eau à la même température, Wikipedia donne 23,4 mbar.
X005/2022-02-28 10:18:06 Page 13/15 CETTE
Table de déplacements chimiques en spectroscopie de RMN du proton
O
O LU |]
@, (7EUR CT
13 12 11 10 9 8 7 6 5 4 3 2 1 0
Relation entre la constante de couplage et écart de déplacement chimique
A
JE Vo
-- .J constante de couplage en Hz
-- 1, fréquence de l'appareil pour le noyau considéré en Hz
-- A5 écart de déplacement chimique en ppm
Valeurs de certaines constantes de couplage proton-proton en spectroscopie de
RMN du proton
2 J\g = 0 -- 5 Hz
H\ 3J\1p = 11-18 Hz
Fc 3 J8D = 6 -- 14 Hz
3J0p = 4 -- 10 Hz
Jo = *J2c = (0 -- 2 Hz
Électronégativités (selon Pauling)
H C O F CI Br
2,20 2,55 3,44 3,98 3,16 2,96
Enthalpies standard de formation à 298 K
(E)-acide cinnamique (solide)
(Z)-acide cinnamique (solide)
| A;H° (kJ-:mol-!)
-- 328
--310
X005/2022-02-28 10:18:06
Page 14/15
CETTE
Constantes d'acidité à 298 K
NN NN
A :
Couple LZ Z N N
N N F\ D
du ridine oH O© H'H Zee
Py PY phénol phénolate pipéridine
pk 5,2 10,0 11,2
Couple H2CO3 (aq) / HCO; (a) HCO; (aa) / CO aa) H (@)/ Hd
PA, 6,3 10,3 S 35
Potentiel rédox standard à 298 K
2+ A+ rp:3+ -- 4+ 2+
Couple Da) /Zn4s Lao [Tia Ho /H (g) Sn 30) /Sno O; (g) /H0%
E° (V) --0,76 0,06 0 0,15 1,23
On considèrera que les potentiels rédox standard relatifs aux ions métalliques
hydratés M sont identiques
aux potentiels rédox standard relatifs aux aqua-complexes M(H20) aa)
Énergies de dissociation de liaison à 298 K
Liaison À -- B N---H N--C N=C O---H O--C O=C
D\_8 (kJ-mol") 389 292 615 362 368 750
Densité de liquides à 0 °C
Espèce Butan-1-ol
Masses molaires moléculaires
d 0,83
Espèce NaH Butan-1-ol Oxa E
M (gmol"\) 24 71 316 348
Constantes physiques
Constante d'Avogadro
Charge élémentaire
N 1 = 6,02 x 10% mol |
e = 1,6 x 10 C
Célérité de la lumière dans le vide c = 3,0 x 10$ ms |
Constante de Planck
h = 6.63 x 10 % J:s
Constante des gaz parfaits R = 8,314J-K°!-mol |
eeoeFrINeee
X005/2022-02-28 10:18:06
Page 15/15 COELES
Numéro de place
Numéro d'inscription Sionature |
ci lon |
> Prénom
CONCOURS CENTRRLE-SUPÉLEC Épr euve : Chimie PC
Ne rien porter sur cette feuille avant d'avoir complètement rempli l'entête
© Neriempotersur ce feuille avant vor complètement rempli ete ile LL ]/LLT
Question 5
E à a AE
/ \
/ \
/ \
/ \
/ ne \
/ ne
/ | \
/ VOA
/ V/ \
/ / \
/ T Vi
Ly Va
17 \ 3
AT \ a
1 \ a
1 \
7 / \ '
7 / \
» / Va
4 7 / Va
f / \
/ \
Px Ed à / \i
Ap ----------------" / \
Y ns / \
\ \
P / \
Z \ / \
\ / \
\ / mn) \
ms
\/ y \ \,
A 7 \
ZA / \ \
/ \ 7 \ \
J \ \
Às ( \ D \ \
\ \ / \ \
\ \ / \ \
\ \ / \ \
/ \ \
\ \ 7 \ \
\ \ 7 \ \
\
\ \ y \ \
\ \7 \ \
f
\ \
34, L
À
7
NX
_
J
ed
> \ \
D
me v \ \ \ L\
3d YZ ns \ \ Sa
x? --y* a) \ \ \
d \ \ \ Ki
2? \ \ \ i\
\ \ \
\ \ \ \
\ \ \ \ À
\ \ \ \
\ \ \ \ VA
\ \ \ \
\
\ \ \ EN
À ON NY
\\ \ \ \ \
\\ \ À
N \ \ \
Y \ \ \ ne
\ \ \ ne
\\ \ \
Vu Lot
VON A > \
VON 0 TA \
\ Yi oT \
\ \ 7 \ \
\ \\ v
\ \ \ 7 \ ee
\ \ Y 27 \y
\ \ 2 eo TN
J
\ \ SA oT 07 \
\ \ \ J / \
Es / /
\ \ \ / / \
\ \ a 7 \
\ \ / \
\ \ 07 vo
\ \ Dé /
\ \ / 07
\ \ 07 /
\ \ Dé 7
\ \ / °T
\ \ T /
/ /
\ /
M
L; octaédrique
Figure À Diagramme d'orbitales moléculaires d'un complexe ML, octaédrique
luametatex 2.0932 20211203 LMTX
Ne rien écrire dans la partie barrée
X005-DR/2022-01-16 19:42:10
Question 20
3
2
L
JE . 2
a b C, d EUR
[4 6 5 4 3 2 1 /ppm
Figure B Spectre de RMN 'H de l'ester cinnamique E (c = 0,65g-L_!) enregistré
par un spectromètre de fréquence
250 MHz dans le mélange D,0/CD,CN 1/1
Proton(s) H H, H H, H H. H
Signal de RMN
Tableau A
Question 34
import numpy as np, matplotlib.pyplot as plt
I0 = 12.9e-8 # intensité de la lumière excitatrice (E.min-1)
ki, kmi, k2 = 1.8e-3, 3.2e-3, 2.2e-3 # constantes de vitesse (s-1)
K = 17.7 # constante définie à la question 29
EO =
20 =
FO =
yO = np.array([EO, ZO, FO])
concentrations en E, Z et F
def f(Y:np.ndarray, t:float):
DL =
L2 = ee
23 =
return np.array([L1i, L2, L3])
def euler(f:callable, a:float, b:float, N:int, yO:np.ndarray) -> ([float]l,
[np.ndarrayl] ):
h = (b - a) / N #pas de la méthode
t = [al #liste des temps
Y = [y0]
for k in range(O, N):
newY = Y[-1] + h * f(Y[-1], t[-1])
Y.append(newY)
t.append(t{[-1] + h)
return t, Y
E, Z et F
ti, tf = 0, 6000 # instant initial et instant final (s)
N = 1000 # nombre de points
t, Y = euler(f, ti, tf, N, y0)
F = np.array(lel2] for e in Y]) # concentrations en F à chaque instant
I =
plt.plot(t, IF, 'k-')
plt.xlabel('$t$ (s)')
plt.ylabel('$I F$ (u.a.)')
plt.tick_params(axis='y', which='both', left-False, labelleft-False)
plt.show()
Figure C
[997] [682] [ec] [282] [&S] [T SZ] Patd Pate [ere] [Fra] [LE] 68t0'8£c || 6SEO'
TES || FOTEZ brad
M | ON | PM | A SH 39 A4 | 9) | V | 4 dN fl ed UL 2V | sprunoy
SOL GOL LOT OOT 66 86 LG 96 CG 76 66 GO TG 06 GS
wunbouoIMeT| | TNTOQON lunaoppuo| MTIUL | unmrosug| umuionpe)| Uno) | UN) umo |
|tuniuomTq| umiunqdoN| UNIUBI] |lumunoeozg| MMTIOUT, | UNTIUT
296 7LT GT GY£6 SOT 9 LOT CO£6'FOT 0G'G9T GG6 SCT ZST O'TST OCT [eyT] GPL
2206'OFT GL'OFI I6'S£T
NT | AA | WL | 14 | OH | AG | AL | PO | n4 | &S | wa | PN | 14 | 89 | CT |
spmequer
LEZ OZ 69 89 L9 99 C9 79 C9 G9 T9 09 6G sc LG
UN9NT| [un1qro) x | UAIAU L || WNIQIA |UNIUTTOH| lumisordéq{| MNIAIT,
|lunruopes||unidomal|umrreures! luniuouoigl OUTAPOON owÂpooseiq|| UNIX)
|SUCUJURT
[F6] [F62.| [862 [682] [687] [98] [eg] [z8| [T82| [82 [222] [OZ [692] [898
[297] Era Ftda
80 | SL | AT | ON | I | UN | U9 | SH | SA | AN | SH | Ua | S$S | qQ | FH 0168 |
CY | M
SIT LIT OTT CTI VIT SIL GLL CII OTL GOT SOI LOT JOLI COL POI |°°PIUPV SS LS
uossour$0||9SSQUUT | lunnouuoarp||untAooSO||TUNTAOII A | |UNIUOUIN|
lunmpmmodon||unuosuoog|lumopesureg|funnouoml| UNISSET || UMTIIUO |lunri81oqeog|
| UMTUNT| lumrpropoqmy UMP | TNTOUCIX
[sac [OT &] [604 086808 || ,o1 x l'a || FO 9'00& |12G996'96T|| T'G6T AAA O6T Ta
9ST sl 62Y6' OST C'82T E'LET |IGGpCOG GET
u'x 3V od [4 dd LL SF nv 3 d JT SO 9 NM EL 3H 122$ || CE SJ)
98 CS 7S GS GS LS OS GZ SZ L2 92 CZ 122 &Z CL SP 96 GG
UOPeY || 9983SV |IumIuooq|| 4NUuSI || QUOI |IUNEU [|| 2919 10 OUI || MNIPEHT ||
WNIUSO |IUNIUOUY|suassunt || S[RJU8T, | UMNIUFEH wunAIeg || UNIS,
S'TET 06'9CT J'ZCT OL'TCT L'8TI C8 TITI F'CIT 898"LOT ÿ'90T GG06' TOI T'IOI
[86] 96 7906°T6 t'I6 90688 9°L8 897'GS
OX I SL | AS | US | UI | PO | SV | P4 | UAH | NH | SL | OM | AN | 1Z A IS | qH
7< 6 GG TG OS GY SY LV OF CT Tr C7 GV LT OF 6S 8£ LE UOU9Y OPOI SIMIPI, [eumouauy|| BL || wnipuy fumrupeo|| JU981Y |lumiperreq|unipouy| ammuoqgny! lunnougper]| leuepq{ont UNION |lunruoozz|| nt} À |unnuoxgl|tunrprqny OS'£S 662 0'62 OTTG FL 'CL &L'69 y'c9 G'£9 69°8G C££6'8S 'ca OS£6 FC 00'TG ÿ6 0G LS'LY 6CCG' FF T'OF 860'6£ IH | 1 | ©S | SV | #9 | 89 | uZz | n9 | IN | 09 | ex | UM | 49 | A | LL | ©S | 89 | x 9EUR CE 7£ GS GS TS OS 6G SG LC 9C GG vG &G GG LG OG GI UOJdAIY || OUOI |UIMIU9[OS || TUOSIVY | lumrureuos|| UNIES) DUT 7 SIA) [PHIN 318407) J94 osouesueId|| 2UIOIU") |ItnIpeurA|| SUCIT, |HNIPUBIS || MM) |UMISSEI04 OV GE T'G£ 0T92£26'0£ T'8G VSTS6 9& C'yc C692686 CT IV | 19 S d IS IV SIN | CN SL LL OL GT ÿL GI GL TL UOSIVY 9IO[U) 9INOS |jooydsouq|| MNIOITIS |unEumunty unusouseI\|| UNIPOS 8ST'0G |T£OFS66 8TI| OO'OT TO'FI TO'GI 8'OI 8TGI0'6 L ON vi O N D a 9EUR TT OL 6 8 L 9 G Y & UO9N ION[A [lou2SAXO|| 9902Y |louoqie9 || o10g tun[Aïg|| NII 09Z00'F (0GOG SAOUWTS ou) J0 SJUSIOM 9TW0)Y 'MY VI S21d8,p) sArepI onbruoze 9sseIN SO0'T OH H G L Uno squour9[s sep onbrportod nes[qer ugBOPATE