Centrale Chimie PC 2023
| Thème de l'épreuve | Synthèses chimiques au laboratoire et dans l'industrie |
| Principaux outils utilisés | cristallographie, thermodynamique, solutions aqueuses, mélanges binaires, procédés industriels continus, informatique pour tous, chimie organique |
| Mots clefs | éthanolamine, dioxyde de carbone, acide-base, réacteur ouvert, hydroboration, stéréochimie, kempène, Karplus |
Corrigé
:👈 gratuite pour tous les corrigés si tu crées un compte
👈 l'accès aux indications de tous les corrigés ne coûte que 1 € ⬅ clique ici
👈 gratuite pour tous les corrigés si tu crées un compte
- - - - - - - -
👈 gratuite pour ce corrigé si tu crées un compte
- - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - -
Énoncé complet
(télécharger le PDF)












Rapport du jury
(télécharger le PDF)






Énoncé obtenu par reconnaissance optique des caractères
Chimie
PC
4 heures Calculatrice autorisée
2023
Synthèses chimiques au laboratoire et dans l'industrie
Ce sujet comporte deux parties indépendantes. La première propose d'étudier
l'efficacité de la capture de dioxyde
de carbone par une solution aqueuse d'éthanolamine et débute par la synthèse
industrielle de l'éthanolamine.
La deuxième porte sur une synthèse d'un diterpène, le (+/-)-Kempène-2, qui met
en oeuvre une réaction d'hy-
droboration dont la régiosélectivité, la stéréosélectivité et la cinétique sont
étudiées au préalable.
Les numéros entre crochets renvoient aux références bibliographiques situées en
fin d'énoncé.
Toutes les données nécessaires sont regroupées à la fin du sujet.
I Les solutions aqueuses d'éthanolamine pour capturer le dioxyde
de carbone
L'éthanolamine, également appelée monoéthanolamine ou 2-aminoéthanol en
nomenclature systématique, est
un liquide toxique, inflammable, corrosif, incolore et visqueux dont l'odeur
est similaire à celle de l'ammoniac.
L'éthanolamine est un ingrédient de base dans la production de savons,
détergents, émulsifiants, vernis, inhibi-
teurs de corrosions, etc. Elle est aussi un intermédiaire chimique, car, par
exemple, par réaction avec l'ammoniac,
elle conduit à l'éthylènediamine qui est un agent chélateur courant.
L'éthanolamine est aussi un additif fréquem-
ment utilisé en cosmétique. Elle intervient, au niveau biologique, dans les
groupes de tête hydrophiles des
phospholipides qui constituent les membranes cellulaires ; en effet,
l'éthanolamine s'associe par estérification au
groupe glycérol 3-phosphate fixé à l'extrémité de l'acide gras constituant la
partie apolaire du phospholipide.
Les solutions aqueuses d'éthanolamine, solutions basiques, permettent de fixer
des gaz acides comme le sulfure
d'hydrogène et le dioxyde de carbone.
no JT ë b RER
La H,N NH, RSS
2 0 !
éthanolamine éthylènediamine phospholipide à tête polaire
Figure 1
IA -- Synthèse industrielle de l'éthanolamine
La synthèse industrielle de l'éthanolamine est réalisée en réacteur ouvert,
alimenté d'une part par de l'oxyde
d'éthylène et d'autre part par un mélange eau-ammoniac. Dans cette sous-partie
sont abordées successivement
la synthèse de l'oxyde d'éthylène, la dissolution de l'ammoniac dans l'eau puis
l'étude de l'unité de synthèse de
l'éthanolamine.
I.A.1) Synthèse de l'oxyde d'éthylène
Plus de 20 millions de tonnes d'oxyde d'éthylène sont synthétisées annuellement
à partir d'éthylène partiellement
oxydé par le dioxygène à une température comprise entre 220 et 280 °C et sous
une pression de 1 à 3 MPa. En
France, seule l'entreprise Ineos Chemicals Lavera produit de l'oxyde d'éthylène
avec une capacité de production
de 220 000 tonnes par an. La synthèse est modélisée par la réaction d'équation :
O
1
H,C=CH, (9) + 302 (g) ----> Z\ (L.1)
Les deux réactifs doivent avoir une pureté d'au moins 99,5% et un catalyseur
solide à base d'argent dispersé
sur de l'alumine alpha poreuse est nécessaire.
Q 1. Justifier la valeur de l'enthalpie standard de formation de Oz (@-
Q 2. En s'appuyant sur une étude thermodynamique précise, commenter les
conditions industrielles de tem-
pérature et de pression mise en place lors de la synthèse de l'oxyde
d'éthylène. (La justification par Putilisation
de lois de modération ne sera pas acceptée.)
X007/2023-03-15 09:08:42 Page 1/16 (Ghsey-\c-sA
Un métal extrêmement divisé est nécessaire. La surface spécifique du catalyseur
est de l'ordre de 10 m° par
gramme.
Q 3. Sachant que l'argent cristallise en réseau cubique faces centrées,
déterminer la valeur de la surface
d'un cube d'argent pur de masse 1 gramme. Commenter.
L.A.2) Dissolution de l'ammoniac dans l'eau
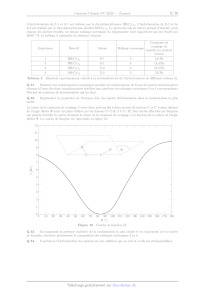
Le diagramme binaire d'équilibre liquide-vapeur du système ammoniac-eau sous
une pression de 1 bar est donné
en figure 2.
110
100
90
80
70
60
50
SZ 40
-- 30
20
10
0
_10
_20
_30
_ 40!
0 10 20 30 40 90 60 70 80 90 100
% massique en eau
Figure 2 Diagramme d'équilibre isobare du mélange binaire ammoniac-eau à une
pression de 1 bar
Il ne sera pas tenu compte des propriétés basiques de l'ammoniac.
Q 4. Préciser la nature des phases présentes dans les différents domaines du
diagramme. Nommer les courbes
limitant les domaines et préciser les informations qu'elles peuvent fournir.
Q 5. Tracer l'allure de la courbe d'analyse thermique obtenue lors du
refroidissement isobare à flux ther-
mique constant d'un système de composition massique égale à 70 % en eau,
initialement à l'état gazeux. Déter-
miner et interpréter le nombre de degré de liberté pour le système biphasé.
Q 6. Déterminer la masse maximale d'ammoniac pouvant être dissoute dans 1000 g
d'eau à 20 °C sous une
pression de 1 bar. Justifier, à partir de l'allure du diagramme binaire, si
cette dissolution est endothermique ou
exothermique.
L.A.3) Unité industrielle de synthèse de l'éthanolamine
La synthèse de l'éthanolamine est effectuée sous une pression totale de 70 bars
dans un réacteur continu dans
lequel le mélange est un liquide homogène (figure 3). Les températures et
débits d'entrée et de sortie sont précisés
dans le tableau 1.
mélange (H,0,NH;), 125 °C, 70 bar
O Éthanolamine
Réact
/_\ es » NH;,H0 + sous-produits
Figure 3
La température d'ébullition de l'eau sous une pression de 70 bar vaut 285 °C.
L'enthalpie standard de vaporisa-
tion de NH; 4, vaut, à 298 K, 20 kJ-mol-.
Q 7. En précisant les hypothèses faites, montrer que le mélange eau-ammoniac
qui alimente le réacteur est
bien liquide dans les conditions de la synthèse.
Q 8. Préciser l'équation de réaction modélisant la transformation chimique
ayant lieu dans le réacteur.
Déterminer si la transformation mise en jeu dans le réacteur est totale ou non.
X007/2023-03-15 09:08:42 Page 2/16 (C2) 8Y-Nc-sA |
BB © NN +
Entrée | Sortie
Température (°C) 125 --
Débit massique (kg-h7*) 20 000 | 20000
Débit en quantité de matière en NH, (kmol-h"") 790 690
Débit en quantité de matière en H,O (kmol-h"") 140 140
Débit en quantité de matière en oxyde éthylène (kmol-h*) 100 &
Débit en quantité de matière en éthanolamine (kmol-h--*) 0 % 100
Tableau 1 Caractéristique du réacteur [7]
On peut, en première approximation, considérer la capacité thermique moyenne du
mélange constante égale à
Cnoy © 9 kJ K-T-kg !. L'évolution du système au sein du réacteur est
adiabatique et le régime est permanent.
L'enthalpie standard de réaction est --55 kJ:mol"{.
Q 9. Déterminer la valeur de la température de sortie du réacteur. Commenter.
« The objective of this project is to design the most efficient and most
versatilel system of reactors for a plant
converting ammonia and ethylene oxide into ethanolamines. The three
ethanolamines produced in this process
are monoethanolamine (MEA), diethanolamine (DEA), and triethanolamine (TEA). Of
these three products,
MEA generally produces the highest profit margin. The reactions that take place
are all very fast. Thus, the
reactor size does not need to be very big. This system features one stainless
steel plug flow reactor", three meters
long and thirty centimeters in diameter, to give the most efficient reaction
for the space in the reactor. We have
to ensure that all of the ethylene oxide reacted. Any ethylene oxide left in
the system after the reaction would
react with something else downstream and increase corrosion and cause pressure
differentials in the downstream
processes that would be very damaging to that equipment. In general, the
residence time{ of this reactor, based
on a goal of 100 million pounds of ethanolamines per year, will be about thirty
seconds. If only MEA is desired,
the residence time can be reduced since MEA forms most quickly of all the
potential products. This could also
allow for more ammonia to flow through the reactor, increasing the
ammonia/ethylene oxide ratio and thus the
percentage of MEA formed. » (d'après [7]).
Q 10. Identifier si le procédé de synthèse de l'éthanolamine est un procédé
continu ou discontinu et nommer
le type de modélisation du réacteur utilisé et les raisons de ce choix.
Pour comparer l'efficacité de deux modèles de réacteurs, un réacteur modélisé
en écoulement piston et un
réacteur modélisé parfaitement agité (RPAC), le taux de conversion de l'oxyde
d'éthylène est déterminé en
fonction du temps de passage x. Le taux de conversion est noté f(x) pour le
modèle RPAC et g(x) pour le
modèle piston.
Les hypothèses suivantes sont supposées vérifiées pour chaque réacteur :
-- Ja réaction est d'ordre apparent 1 par rapport à l'époxyde ;
-- la température est constante dans chacun des réacteurs ;
-- à cette température, la constante de vitesse apparente est égale à k = 2 x
10 %s 1.
Q 11. Établir les expressions des taux de conversion de l'oxyde d'éthylène en
fonction de la constante de
vitesse apparente k et du temps de passage x, dans les deux modèles de
réacteur. Écrire alors les deux fonctions
Python f et g d'entête
def f(x:float, k:float) -> float:
def g(x:float, k:float) -> float:
qui calculent le taux de conversion de l'oxyde d'éthylène pour le temps de
passage x et la constante de vitesse
k, respectivement pour un réacteur RPAC et un réacteur en écoulement piston.
En utilisant ces deux fonctions, un programme Python permet de visualiser
l'évolution du taux de conversion
en fonction du temps de passage pour une constante de vitesse donnée. Le graphe
obtenu lors de la mise en
oeuvre de ce programme est fourni en figure 4.
versatile : polyvalent.
stainless steel : acier inoxydable.
plug flow reactor : réacteur à écoulement piston.
residence time : temps de passage.
X007/2023-03-15 09:08:42 Page 3/16 (C2) BY-Nc-SA |
1,0
-_--
--æ-- --
="
--
, ="
æ"
_
_
_
0.6
Taux de conversion
Piston
Û 900 1000 1500 2000 2900 3000
Temps de passage (s)
Figure 4 Taux de conversion en oxyde d'éthylène en fonction du temps de passage
Q 12. Comparer l'efficacité des deux modèles de réacteurs.
I.B - Étude de la capture et du relargage du dioxyde de carbone par des
solutions aqueuses
basiques
Le dioxyde de carbone possédant des propriétés acides au sens de Brônsted, sa
capture, à l'aide d'une solution
basique est, à priori, envisageable. Outre l'étude de sa capture, son relargage
est aussi analysé afin de pouvoir
réutiliser la solution basique pour d'autres captures. Deux solutions sont
envisagées pour cela et leur efficacité
comparée :
-- une solution aqueuse de soude ;
-- une solution aqueuse d'éthanolamine.
L.B.1) Suivi par pressiométrie de la capture du dioxyde de carbone par une
solution d'éthano-
lamine
La transformation chimique ayant lieu lors de la mise en contact du dioxyde de
carbone et de l'éthanolamine
est une transformation complexe. Pour la modéliser de manière simple, lorsque
CO, est en défaut, il est commu-
nément admis que le système évolue pour conduire à la formation d'un carbamate.
Ce qui peut être modélisé
par la réaction d'équation suivante :
H
HO NH, HO NH; HO N O7
2 7 +CO= 7 + V7 YY (1.2)
(aa) (aa) Il (ac)
O
_carbamate
| | |
R; R,
do Di
Ro
Figure 5 Carbamate
Q 13. Proposer un mécanisme réactionnel pour rendre compte de cette réaction.
Une étude expérimentale au laboratoire est mise en oeuvre afin de déterminer le
pourcentage de CO, gazeux
capté par une solution aqueuse d'éthanolamine ainsi que l'enthalpie standard de
réaction de la réaction (1.2).
Pour cela, 100,0 mL d'une solution aqueuse d'éthanolamine de concentration
0,500 mol-L-! sont introduits dans
un erlenmeyer de volume intérieur d'environ 360 mL.
Un bouchon équipé d'un robinet 3 voies est vissé hermétiquement sur cet
erlenmeyer. L'une des voies permet
l'ajout de gaz à l'aide d'une seringue, l'autre permet de mesurer, à l'aide
d'un capteur adapté, la pression totale
à l'intérieur de l'erlenmeyer (figure 6). Le volume des tuyaux de connexion est
négligé. La valeur de la pression
initiale est P, = 1005 hPa (1 hPa = 100 Pa).
X007/2023-03-15 09:08:42 Page 4/16 (C2) 8Y-Nc-sA |
L
capteur P
Figure 6
Sous cette pression F;, 60 mL de CO, gazeux sont placés dans la seringue et
injectés dans l'erlenmeyer. La
température est maintenue constante à 21 °C. Un état d'équilibre est rapidement
atteint et une pression totale
P = 1032 hPa est mesurée.
Q 14. Déterminer le pourcentage de CO, gazeux capté par la solution aqueuse
d'éthanolamine dans les
conditions de l'expérience.
Q 15. Donner la valeur, à l'équilibre chimique, du quotient réactionnel de la
réaction (1.2) dans les conditions
de l'expérience.
L'erlenmeyer est ensuite placé dans un baïin thermostaté et, à l'équilibre
chimique, la pression totale P est
mesurée pour différentes températures 0 et les quotients réactionnels à
l'équilibre Q,.(eq) sont déterminés. Les
résultats obtenus sont présentés dans le tableau 2.
Ü (°C) 26 31 36 Al A6 5]
Q, (eq) 42 X 107% | 24 x 107% | 16 x 107% | 12 x 10% | 8x 10% | 5 x 10%
Tableau 2
Q 16. Déduire de ces résultats la valeur de l'enthalpie standard de réaction
de la réaction (1.2). Commenter.
LB.2) Suivi par titrage de la capture et du relargage de dioxyde de carbone par
différentes
solutions basiques
Deux solutions basiques sont utilisées :
-- une solution aqueuse de soude de concentration voisine de 0,50 mol-Lt,
-- une solution aqueuse d'éthanolamine à une concentration voisine de 0,50
mol:L*.
Le protocole expérimental mis en oeuvre est le suivant :
-- introduire dans une burette de 25 mL le réactif titrant, de l'acide
chlorhydrique de concentration 0,100 mol-L* :
-- premier titrage des solutions basiques, prélever 2,0 mL de solution basique,
les placer dans un bécher de
90 mL, ajouter 20 mL d'eau puis titrer par la solution acide ;
-- deuxième titrage, reprendre le montage décrit dans la section I[.B.1 et
introduire, à l'aide de la seringue, 60 mL
de dioxyde de carbone (pression P, = 1005 hPa, température 1; = 21°C) dans 20
mL de la solution basique :
agiter cinq minutes à température ambiante. La solution obtenue est notée
S;pture- Prélever 2,0 mL de la
solution Séapture EURt les verser dans un bécher, titrer comme précédemment
après avoir rajouté 20 mL d'eau ;
-- troisième titrage, porter la solution restante, S,pturer à reflux une
dizaine de minutes. Prélever à nouveau
2,0 mL de solution, les placer dans un bécher et la titrer comme précédemment
après avoir rajouté 20 mL
d'eau.
Six courbes de titrages sont ainsi obtenues :
Solution basique soude (0,50 mol-L*) éthanolamine (0,50 mol-L--)
Figure 7 8
Premier titrage courbe (51) courbe (E1)
Deuxième titrage courbe (52) courbe (E2)
Troisième titrage courbe (53) courbe (E3)
Un programme rédigé en langage Python a permis de tracer les courbes des
figures 7 et 8 à partir des valeurs
expérimentales stockées dans des listes. Ainsi, pour tracer la courbe (S2) sur
la figure de gauche de la figure 7,
deux listes de même taille V2 et PH2 sont utilisées. V2[i] et PH2[i]
correspondent respectivement au volume
de réactif titrant introduit et au pH de la solution lors de la mesure i.
X007/2023-03-15 09:08:42 Page 5/16 (C2) BY-Nc-SA |
pH
Courbes de titrage Dérivée de la courbe $S2
12 Re | ess, * 0 Fee ptet TRE E FFT
a . + S 2 Te ttes .
10 Es . x _ S3 y . ++,
8 4, ° d +
*, dpH --2
6 "+ dv
f --3
4 à |
CAT & k je
9 Cécéoée XX k k à à À --À 4
00 25 50 75 10,0 125 15,0 17,5 00 2,5 5,0 7,5 10,0 12,5 15,0 17,5
V (mL) V (mL)
Figure 7 Résultats expérimentaux avec la soude
DES * El
10 ati, RER RS See ee + E2
+ + XXXX 4e.
tes Or ee x E3
++ +4 . X "+ ., .
T+ + + +4 7x x | ° e
6 tr a,
+
+
4 6 +
+
4 À
x 4
x Pet,
tes
2
0 2 4 6 8 10 12
V (mL)
Figure 8 Résultats expérimentaux avec l'éthanolamine
Q 17. Écrire en Python la fonction d'entête
def derive(V:list, pH:list) -> (list, list):
qui, à partir des valeurs expérimentales de volume et de pH, construit deux
nouvelles listes permettant de tracer
la courbe dérivée représentée à droite sur la figure 7. Ecrire ensuite la
fonction d'entête
def volequiv(V:list, dpH:list) -> float:
qui, à partir des deux listes produites par la fonction derive, détermine la
valeur du volume correspondant à
l'extrémum de la dérivée du pH.
L'application des fonctions précédentes aux données expérimentales de la courbe
S2 fournit un résultat de 9,8 mL
pour la fonction volequiv.
Q 18. Écrire la ou les équations des réactions support du titrage, mises en jeu
lors du second titrage pour la
solution basique de soude (courbe 52).
Q 19. Déterminer le pourcentage de dioxyde de carbone gazeux capté par la
soude. Confronter ce résultat à
celui obtenu question 14.
Q 20. Exploiter qualitativement les résultats expérimentaux pour conclure quant
à la possibilité de relargage
ou non du dioxyde de carbone soit par la solution aqueuse de soude, soit par la
solution aqueuse d'éthanolamine.
Q 21. Indiquer s'il est possible de récupérer le dioxyde de carbone gazeux en
ajoutant un acide fort à la
solution Séapture OPtenue lors du second titrage. Conclure.
X007/2023-03-15 09:08:42 Page 6/16 (C2) BY-Nc-SA |
I.B.3) Étude d'une unité de capture de dioxyde de carbone sur un site industriel
Dans le but de réduire l'émission de gaz à effet de serre, l'Union européenne a
décidé, depuis les accords de
Kyoto, de fixer des quotas d'émission. Au-delà, d'un certain seuil, les
entreprises doivent payer une taxe de
l'ordre de 30 EUR la tonne de dioxyde de carbone émise.
Le traitement du dioxyde de carbone émis sur un site industriel n'est pas
toujours possible. Une piste envisagée
consiste alors à :
-- alimenter, sur ce site, une colonne de traitement du dioxyde de carbone
gazeux émis, avec à contre-courant,
une solution d'éthanolamine :
-- transférer les solutions aqueuses recueillies sur un second site industriel
à l'aide de pompes et de pipelines ;
-- traiter les solutions aqueuses sur le second site industriel afin de
récupérer le dioxyde de carbone gazeux
pour l'exploiter ou l'enfouir et de régénérer la solution d'éthanolamine.
Q 22. Expliquer le traitement à mettre en oeuvre sur le second site et
justifier le choix de l'éthanolamine
plutôt que la soude.
L'éthanolamine ne possède pas de propriétés oxydantes notoires, malgré tout,
les solutions d'éthanolamine
favorisent l'oxydation du fer en fer(Il), ce qui constitue un inconvénient pour
l'utilisation des colonnes de
traitement, pompes, pipelines et autres dispositifs de stockage métalliques.
Q 23. Représenter l'allure des courbes intensité-potentiel permettant
d'interpréter l'oxydation d'un métal
en milieu acide.
Q 24. Justifier si l'oxydation du fer en fer(Il) par des solutions aqueuses
d'éthanolamine peut s'interpréter :
(a) par le fait que la solution aqueuse d'éthanolamine est basique :
(b) par le fait que l'éthanolamine forme des complexes avec les ions fer(Il) en
solution.
IT Synthèse du (+/-)-Kempène-2
Le (+/-)-Kempène-2 est un diterpène tétracyclique isolé des sécrétions de
défense émises par les termites soldats
Nasutitermitunae. Deux étapes de la synthèse proposée par William G. Dauben et
al. font intervenir une
hydroboration dont l'une utilise un dialkylborane à la place du borane.
L'hydroboration des alcènes trouve de
nombreuses applications en synthèse organique, car elle présente une
régiosélectivité et une stéréosélectivité
intéressante. Largement étudiée par H.C. Brown, elle lui a valu le prix Nobel
de chimie en 1979.
Figure 9 (+/-)-Kempène-2
Une étude de la régiosélectivité et de la stéréosélectivité ainsi qu'une étude
cinétique de la réaction d'hydrobo-
ration sont abordées en préliminaire de la synthèse du (+/-)-Kempène-2.
II.A -- Étude de la réaction d'hydroboration des alcènes
II.A.1) Régiosélectivité de la réaction d'hydroboration des alcènes
Diverses expériences ont été réalisées afin d'étudier la régiosélectivité de la
réaction d'hydroboration. Quelques
résultats obtenus par Herbert C. Brown et son équipe entre 1960 et 1981, sont
rassemblés dans le tableau 3 qui
donne la proportion a/b des régioisomères borés formés :
_ quantité de matière de produit dans lequel le bore est fixé sur l'atome de
carbone a
_ quantité de matière de produit dans lequel le bore est fixé sur l'atome de
carbone b
Page 7/16 @evnc-sa
a/b
X007/2023-03-15 09:08:42
Expérience Alcène Réactif Rapport a/b
1 ARR BH, 94/6 |1]
a D
2 --X BH, 99/1 [1]
3 - BH, | 58/42 1]
D
à
4 CT BH; | 81/19 [3]
D
BH, | 93/7 [3
BH, | 66/34 [3]
BH, | 60/40 [5]
2
8 a D FR 99/1 [5]
9-BBN
Tableau 3 Résultats expérimentaux relatifs à la régiosélectivité de
l'hydroboration de différents alcènes
Q 25. Représenter une structure de Lewis du borane, BH, et justifier sa
géométrie.
Q 26. Déterminer les informations apportées par les expériences 1, 2 et 3 sur
la réaction d'hydroboration.
Q 27. Déterminer les informations apportées par les expériences 4, 5 et 6 sur
la réaction d'hydroboration ;
on pourra examiner les effets électroniques.
Q 28. Déterminer les informations apportées par les expériences 7 et 8 sur la
réaction d'hydroboration.
L'hydroboration des alcènes étant sous contrôle cinétique, un contrôle
frontalier de la réaction est envisageable.
Q 29. Citer l'orbitale frontalière de l'alcène que l'on doit prendre en
considération pour cette étude.
Le tableau 4 donne la valeur absolue du coefficient de la combinaison linéaire
dans l'orbitale frontalière concernée
sur les carbones a et b de l'alcène mis en oeuvre dans les expériences
numérotées de 1 à 7.
Alcène de l'expérience n° 1 2 3 4 5 ( 7
Carbone a 0,473 0,519 0,391 0,157 0,106 0,181 0,322
Carbone b 0,355 0,333 0,407 0,079 0,036 0,111 0,270
Tableau 4 Valeur absolue du coefficient de la combinaison linéaire dans
l'orbitale
frontalière concernée sur les carbones a et b de l'alcène (source : logiciel
ChimPackPro)
Q 30. Conclure, en argumentant, quant à la validité de l'hypothèse d'un
contrôle frontalier pour la réaction
d''hydroboration.
II.A.2) Stéréosélectivité de la réaction d'hydroboration des alcènes
L'aspect stéréochimique de la réaction d'hydroboration a été étudié sur 4
alcènes deutérés : le (E)-1,2-dideuté-
rohex-1-ène noté E-1, le (Z)-1,2-dideutérohex-1-ène noté Z-1, le
(E)-1-deutérohex-1-ène noté E-2, le (Z)-1-deu-
térohex-1-ène noté Z-2.
Le deutérium, de symbole D, est un isotope de l'hydrogène, qui n'est pas
observé en RMN ÎH. En nomenclature
officielle, il est désigné par le préfixe deutéro. Pour les règles CIP, le
deutérium est prioritaire devant l'hydrogène.
X007/2023-03-15 09:08:42 Page 8/16 (C2) BY-Nc-SA |
L'hydroboration de E-1 et Z-1 est réalisée par le dicyclohexylborane HB(Cy),.
L'hydroboration de E-2 et de
Z-2 est réalisée par le dicyclohexylborane deutéré DB(Cy),. Le protocole mis en
oeuvre permet d'obtenir, pour
chacun des alcènes étudiés, un unique mélange racémique du régioisomère boré
majoritaire qui est étudié par
RMN 'H. Le tableau 5 rassemble les résultats obtenus.
Constante de
Expérience Réactif Alcène Mélange racémique de Ou :
obtenu
1 HB(Cy)o E-1 3 3,6 Hz
2 HB(Cy)2 Z-1 4 12,4 Hz
3 DB(Cy )o E-2 4 12,4 Hz
4 DB(Cy) 1-2 3 3,6 Hz
Tableau 5 Résultats expérimentaux relatifs à la stéréosélectivité de
l'hydroboration de différents alcènes [4]
Q 31. Dessiner une représentation topologique spatiale en représentation de
Cram des quatre stéréoisomères
obtenus à l'issue des deux transformations étudiées sans attribuer les mélanges
racémiques 3 ou 4 correspondants.
Préciser les relations de stéréoisomérie qui les lient.
Q 32. Représenter la projection de Newman d'un des quatre stéréoisomères dans
la conformation la plus
stable.
La valeur de la constante de couplage J entre deux protons liés à deux atomes
de carbone EUR et C" voisins dépend
de l'angle dièdre ® entre les plans définis par les liaisons C'-C-H et C-C'-H°.
Des calculs effectués par Karplus
ont permis d'établir la courbe donnant la valeur de la constante de couplage J
en fonction de la valeur de l'angle
dièdre ®. La courbe de Karplus est reproduite en figure 10.
DE
IlF- --
J (Hz)
0 | | | | | | | | | | | | | | |
0 10 20 30 40 50 60 70 80 90 100 I10 120 130 140 150 160 170 180
® (°)
Figure 10 Courbe de Karplus [8]
Q 33. En supposant la présence exclusive de la conformation la plus stable et
en s'appuyant sur la courbe
de Karplus, attribuer précisément la composition des mélanges racémiques 3 et 4.
Q 34. Conclure si l'hydroboration des alcènes est une addition syn ou anti et
si elle est stéréospécifique.
X007/2023-03-15 09:08:42 Page 9/16 (C2) BY-Nc-SA |
II. A.3) Étude cinétique d'une réaction d'hydroboration
L'étude cinétique porte sur la réaction du disiamylborane, HB(sia),, sur les
cycloalcènes à 0 °C [2].
a) Préparation de la solution de disiamylborane HB(sia),
Les solutions de disiamylborane n'étant pas stables, elles doivent être
utilisées in situ juste après leur préparation.
O
(2
Figure 11 Tétrahydrofurane
Dans un bicol de 200 mL parfaitement sec, parcouru par un courant de diazote,
sont introduits 20,00 mL d'une so-
lution de 2-méthylbut-2-ène dans le tétrahydrofurane (THF figure 11) anhydre à
la concentration de 6,00 mol-L"*.
Le ballon est refroidi à --20 °C et un volume de 24,30 mL de solution de borane
de concentration 2,47 mol-L-*
dans le THF anhydre est additionné lentement. Le milieu réactionnel est
maintenu sous agitation pendant 9h
afin d'atteindre un taux de transformation du 2-méthylbut-2-ène de 99%. 85,5 mL
de THF anhydre sont ensuite
rajoutés au milieu réactionnel et la solution de disiamylborane dans le THF
anhydre, ramenée à une température
de --2 °C, est prête à l'emploi pour les études cinétiques.
Q 35. Justifier le choix du solvant.
Q 36. Établir une représentation topologique du disiamylborane formé.
b) Étude cinétique de la réaction du disiamylborane sur le cyclopentène à 0 °C
Une solution de cyclopentène de concentration 3,00 mol-L! dans le THF anhydre
est préparée et maintenue à
D °C.
Pour réaliser la transformation chimique intervenant entre le disiamylborane et
le cyclopentène à 0 °C, 20,00 mL
de la solution de cyclopentène sont ajoutés à la solution de disiamylborane.
Pour suivre la transformation
chimique, des prélèvements de 0,50 mL de solution sont réalisés à différentes
dates t. Chaque échantillon prélevé
est placé dans un tube à hémolyse contenant 0,10 mL de 1-décène et est ensuite
stocké à --78 °C. Les échantillons
sont analysés par la suite par chromatographie en phase vapeur. L'exploitation
du chromatogramme permet
d'accéder à la concentration en cyclopentène dans le milieu réactionnel. Les
résultats obtenus sont rassemblés
dans le tableau 6.
t (s) 610 1270 1950 | 2530 | 4320 | 5820 | 7080 | 8760
lcyclopentène] (mol-L-1) | 0,284 | 0.216 | 0.176 | 0.153 | 0.113 | 0.090 |
0.077 | 0.063
Tableau 6 Concentration du cyclopentène à différents dates { au cours de la
transformation
chimique intervenant entre le disiamylborane (HB(sia),) et le cyclopentène à 0
°C
Q 37. Préciser le rôle du 1-décène dans les différents prélèvements.
Q 38. Justifier le fait que les conditions opératoires permettent la
détermination de l'ordre global de la
réaction.
Q 39. Déterminer l'ordre global de la réaction et la valeur de la constante
cinétique de la réaction à la
température de 0 °C.
Q 40. Donner une représentation topologique du produit obtenu à l'issue de la
transformation.
c) Influence de la taille du cycle
L'étude précédente a été menée dans les mêmes conditions sur le cyclohexène et
sur le cycloheptène. Le tableau 7
fournit les constantes cinétiques obtenues dans chaque étude.
composé
cyclohexène
cycloheptène
k (L:mol-".s)
13 x 107$
72 x 107"
Tableau 7 Constantes cinétiques de la réaction du disiamylborane sur différents
cycloalcènes à 0 °C
Composé cyclopentène cyclohexène cycloheptène
Conformation la \
plus stable 1
Tableau 8 Représentation des cycloalcènes dans la conformation la plus stable
Page 10/16 COELES
X007/2023-03-15 09:08:42
Q 41. Proposer une interprétation des faits expérimentaux.
II.A.4) Conclusion sur l'étude de la réaction d'hydroboration des alcènes
Q 42. En faisant référence à l'ensemble des résultats expérimentaux, proposer,
sur un exemple pertinent, un
mécanisme réactionnel pour la réaction d'hydroboration des alcènes par le
borane et donner l'allure du profil
énergétique correspondant.
ITI.B -- Synthèse du (+/-)-Kempène-2 à partir de la 2,6-diméthylbenzoquinone 1
Une analyse rétrosynthétique proposée par Melanie Schubert et Peter Metz [10]
met en évidence la nécessité de
former en premier lieu la jonction de cycle entre les cycles à 6 chainons
(figure 12).
(+/-)-Kempène-2 --
Figure 12
C'est également la première étape de la synthèse du (+/-)-Kempène-2 proposée
par William G. Dauben et al.
16] qui est l'objet de l'étude qui suit. Une première transformation permet
l'obtention du composé 2 à partir du
composé 1 (figure 13).
O O
| |
O O
1 2
Figure 13 Composés 1 et 2
Q 43. Proposer un réactif permettant l'obtention du composé 2 à partir du
composé 1.
Q 44. Donner une représentation topologique spatiale du (ou des)
stéréoisomère(s) du composé 2 obtenu(s).
Les stéréoisomères isolés sont ensuite chauffés à reflux dans de l'acide
éthanoïque en présence de zinc. Le
traitement du brut réactionnel permet d'obtenir le composé 3 (figure 12) avec
un rendement de 13% à partir
du composé 1.
Q 45. À l'aide d'un ou de plusieurs réducteurs proposés dans le tableau 9 et de
tout réactif jugé nécessaire,
proposer une voie de synthèse multi-étapes permettant d'obtenir le composé 4
(figure 14) à partir du composé 3
sans se préoccuper de la stéréochimie.
Q 46. Indiquer le rôle du OBn dans la différenciation des fonctions cétones.
Une suite de réactions non explicitée ici permet d'obtenir le composé 5 (figure
15) à partir du composé 3 avec
un rendement de 39%.
Le composé 5 est ajouté à un équivalent de disiamylborane, HB(sia),, dans le
THF à 40 °C pendant 72 h puis le
milieu est refroidi à 0 °C et du peroxyde d'hydrogène H,0, dans une solution de
soude est rajouté. Le composé
6 est isolé avec un rendement de 82%.
Page 11/16 CITES
X007/2023-03-15 09:08:42
OBn
OBn
Figure 14 Composé 4
Réducteur
Caractéristiques
C'est un hydrure très général, il réduit en alcool la plupart des composés
chimiques tels que
LiAIH,
les aldéhydes, les cétones, les acides carboxyliques et leurs dérivés, les
nitriles. Il est peu sé-
lectif.
C'est un réducteur assez doux, qui permet de réduire les cétones, les aldéhydes
et les chlo-
NaBH,
rures d'acide en alcool. Les esters et autres dérivés d'acide réagissent
lentement ou pas du
tout.
Le DiBAI (aussi noté DiBAIH, pour DiisoButylAluminiumHydrid) est aussi un agent
de ré-
DiBAIH
duction, mais pas aussi fort que LiAIH,, il est donc plus sélectif. Il permet
en particulier de
réduire un ester en aldéhyde.
La L-Sélectride® (trisiamylborohydrure de Lithium) est un agent réducteur très
sélectif du
L_Sélectride fait de son encombrement stérique. Il conduit à des réductions
régiosélectives et stéréosé-
lectives des aldéhydes et des cétones en alcool. Une hydrolyse acide du milieu
réactionnel
permet d'obtenir l'alcool.
Tableau 9 Quelques réducteurs mis en oeuvre en chimie organique et leurs
caractéristiques [9]
H
OBn
Figure 15 Composé 5
H,C
[-
,C C
TICN/ 7
H H,
Br
H,C
Iodure de tétrabutylammonium Bromure de benzyle
Figure 16
Le composé 6 est ensuite placé pendant 48 h dans une solution d'hydrure de
sodium NaH dans le THF en
présence d'un équivalent de bromure de benzyle BnBr et d'iodure de
tétrabutylammonium pour conduire au
composé 7 avec un rendement de 98%.
Le composé 7 est mis en présence de borane dans le THF à 0 °C pendant 6 h puis
du peroxyde d'hydrogène
dans une solution de soude est rajouté. Le composé 8 est isolé avec un
rendement de 77 %.
Une suite de réactions non explicitée ici permet d'obtenir le composé 9 (figure
17) avec un rendement de 53%.
8
X007/2023-03-15 09:08:42
Page 12/16 CITES
Q 47. Compte tenu de la régiosélectivité de la réaction d'hydroboration des
alcènes, proposer une représen-
tation topologique spatiale pour les composés 6 et 7.
Q 48. Indiquer le rôle de l'iodure de tétrabutylammonium dans l'obtention du
composé 7.
Q 49. Donner une représentation topologique spatiale du composé 8.
Q 50. Commenter le choix des réactifs borés dans les deux hydroborations.
Le composé 9, placé dans le toluène en présence de EtAICL, et d'un équivalent
de 2-méthylbut-1,3-diène (ou
isoprène), est chauffé à 80 °C pendant 24h. Le composé 10 est isolé avec un
rendement de 66%.
Une suite de réactions non explicitée ici permet d'obtenir le composé 11
(figure 17) à partir du composé 10 avec
un rendement de 68%.
OBn OH
OH
9 11 13
Figure 17 Les composés 9, 11 et 13
H
© MTS
as
OBn
Le composé 11 est placé en présence d'isopropylamidure de lithium (LDA) dans le
THF pour conduire au
composé 12 après traitement du brut réactionnel. Le composé 12, de formule
brute C:5H390%, est un composé
tricyclique présentant deux cycles à 6 atomes de carbone et un cycle à 5 atomes
de carbone.
Le composé 12 est chauffé à 80 °C pendant deux heures dans le benzène en
présence d'une quantité catalytique
d'acide paratoluène sulfonique (APTS). Le composé 13 (figure 17) est isolé avec
un rendement de 61 % (passage
de 11 à 13).
Le composé 13 mis en présence de chlorure d'éthanoyle dans la pyridine conduit
au composé 14 qui est isolé
avec un rendement de 66%.
Q 51. En supposant que la transformation du composé 9 en composé 10 est sous
contrôle frontalier, prévoir
la régiosélectivité de la réaction.
Q 52. Indiquer le rôle du EtAICL utilisé lors de la transformation du composé 9
en composé 10.
Q 53. Donner une représentation topologique spatiale du composé 10 sachant que
le stéréodescripteur des
deux nouveaux centres stéréogènes est $S.
Q 54. Donner une représentation topologique du composé 12.
Q 55. Proposer un mécanisme réactionnel pour le passage du composé 11 au
composé 12 et justifier la
régiosélectivité prenant place lors de la cyclisation.
Q 56. Proposer un mécanisme réactionnel pour le passage du composé 12 au
composé 13 sachant qu'il y a
formation d'un hémiacétal cyclique intermédiaire.
Q 57. Donner une représentation topologique spatiale du composé 14.
Une suite de transformations non détaillées ici permet la formation du
(+/-)-Kempène-2 avec un rendement de
13% à partir du composé 14.
Q 58. Déterminer la valeur du rendement de cette synthèse. Commenter.
X007/2023-03-15 09:08:42 Page 13/16 CHETES
Données
Constantes physiques
Constante d'Avogadro N 1 = 6,02 x 10° mol !
Constante des gaz parfaits R =8,314J-K {:mol |
Constantes d'acidité à 298 K
NH} ac) /NE (ao) HCO3 (ao) /HCO; 0 HCO; CO
pK, 9,2 6,2 10,3
Masses molaires atomique et moléculaires (g-mol-")
Éthanolamine Argent Eau Ammoniac Oxyde Dioxyde de
d'éthylène carbone
61 108 18 17 44 44
Informations diverses
-- L'éthanolamine est liquide à température ambiante, sa densité est de 1,02.
-- Le rayon atomique de l'argent vaut 160 pm.
Enthalpies standard de formation à 298 K
HC=CH (2) O (a) L\,
90 0
| A;H° (kJ-mol-!)
Diagramme potentiel-pH de l'élément fer (concentration de tracé 0,01 mol-L-"),
avec superposition, en
pointillé, du diagramme potentiel-pH de l'eau.
2,0
1,5
1 Fest
R O2 (2)
1,0 EE --
Sr 0,5 H,0 DT
R
0,0 | _ Fe?+ Fe(OH)34,
_0,5 =
Ho (9)
-- 1,0
0 1 2 3 1 9 6 T 8 9 I0 Il 12 13 14
pH
Énergie des orbitales frontalières et valeur absolue des coefficients dans la
combinaison linéaire
de l'orbitale frontalière (calculs effectués avec le logiciel ChimPackPro)
2-méthylbu-1,3-diène ou isoprène
BV :0,2eV HO : --9,6 eV
271 [Cr 0,275 0,390
C2? 0,169 0,198
? 4 |C3 0,148 0,123
C4 0,338 0,248
X007/2023-03-15 09:08:42
Modélisation du composé 9
Page 14/16
- BV : -6,3eV | HO : --15,1eV
S
C1 0,011 0,404
HZ
:0 C2 0,339 0,201
CEE
?
-
!
8
""
*
B
"
8
"
:
" !
!!
-
#!$
Q
8>b74
?EbE
E
Q
#$
7
; H
! ""
8
R
"
7
#$
7;
+
#$
#
6
*
:
#$
*
!
Q -
8
!
G
!!"
A
A
@
7
#"$
A
#$
=
"
#$
:
#$
7
#"$
8
#$
?
!
'
#!$
?
#$
A
# $
*
A
I
# $
:
-
R
"
< " D " " * " # #!$ #$ 8 #$ -H #"$ 8; < #"$ 0 !! = #"$ #"$ : ! * ; :) < Q ? G #$ 7 H # $ * # $ @ - N #$ !! F a ! 6 #" $ ? #$ G Y ! E ` # !$ . # $ A < - Q * !" 8 ! ; = T C R & ! Q - Q ! ! A @ N G ;) : ) ) * D X ? Q5 C C + 8 - = : 8 < D X " Q - R X - 6 T 0 - #$ # " N " C \ H " A A : 6 "" 7 !" 8 ) Q " ? G J '7'7% B G Q RJ + ? #$ - R T 7 # $ * G C 0 # $ C H " =; ? 8 " !! H "" + T+ - - H N < C H C ` \ G : - H ! 6 ; : ) "