0 0 a
Chimie à
Prec ©
4 heures Calculatrice autorisée ON
Les médicaments : une histoire en perpétuelle évolution
Les principes actifs sources de médicaments puisent leur origine dans le monde
minéral, végétal ou animal ou
sont obtenus par voie synthétique au laboratoire, les procédés étant parfois
étendus à l'échelle industrielle.
La découverte des médicaments, d'abord empirique, a suivi l'évolution de la
compréhension médicale des pa-
thologies affectant l'être humain. Si certaines substances aux qualités
thérapeutiques indéniables sont connues
depuis l'Antiquité (l'opium), la fin du XIXe siècle voit, d'une part
l'isolement de principes actifs d'origine vé-
gétale (la morphine par exemple) et, d'autre part la synthèse totale de
médicaments simples comme l'aspirine.
Aujourd'hui la mise sur le marché de médicaments nécessite notamment :
-- d'élaborer au laboratoire des méthodes de synthèse efficaces et
respectueuses de l'environnement ;
-- de déployer ces stratégies de synthèse à l'échelle industrielle ;
-- d''analyser le mode d'assimilation du médicament dans l'organisme ;
-- de caractériser la stabilité du médicament afin d'en fixer la posologie et
la date de péremption.
Ce sujet propose d'aborder successivement ces quatre aspects sur les exemples
concrets de l'ibuprofène et de la
thiénamycine, un antibiotique dont la structure présente un noyau B-lactame.
OH
| NH
O di
Ibuprofène Noyau B-lactame Thiénamycine
Le candidat pourra adopter une représentation simplifiée des molécules lors de
l'écriture des mécanismes réac-
tionnels en chimie organique.
I Stratégie de synthèse
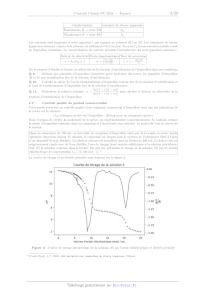
I. A --- Procédé Boots
L'ibuprofène est un anti-inflammatoire non stéroïdien dont la synthèse
historique par le procédé Boots a été
établie en 1960!. La séquence réactionnelle de cette synthèse est précisée sur
figure 1.
O
O O O
D O 99% :; Sieu -- 96 -- 98%, Sippa = 1.00%,
SiBPcI -- 1.00%, S1Bs -- 0.2%
Experimental data Dynamic data (concentration with respect time) for different
reaction conditions
Scale Lab scale
Models Available
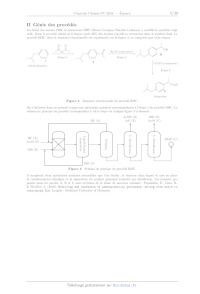
La figure 6 schématise le cycle catalytique permettant d'interpréter cette
transformation.
X008/2024-05-03 18:04:16 Page 7/20 (CO) BY-Nc-SA |
OH
B
H°
H,0
TSsOH
PdCL(PPh3) = = [PdCI(PPh;)] OTs
Ci H+CTr © . D
H*/OTs || CO/HO H+/Cr
COOH Y Y
CI
PdCI(COOH)(PPh;))
G C; E
+H*
COOH
H*,CO;
F _
Ph3P
Pd°C1
Ph;P-
Cu
Figure 6 Cycle catalytique
X008/2024-05-03 18:04:16 Page 8/20 (CO) BY-Nc-SA |
Q 22. Identifier le catalyseur et nommer chacune des étapes du cycle
catalytique.
Q 23. Écrire l'équation de la réaction modélisant la transformation de l'étape
3 (figure 4) puis évaluer
l'enthalpie standard de cette réaction.
Q 24. Par une étude thermodynamique, analyser l'influence de la pression et de
la température sur le sens
d'évolution de la transformation. Commenter les choix industriels. On supposera
chacun des constituants à l'état
gazeux.
ITI.D -- Analyse du procédé BHC
Q 25. Qualifier les conditions catalytiques des étapes 2 et 3 du procédé BHC
et avancer quelques avantages
et inconvénients de chaque type de catalyse.
III Solubilité de l'ibuprofène
L'assimilation d'un médicament nécessite sa solubilisation en milieu aqueux.
L'ibuprofène est souvent administré
sous forme de comprimés solides. On constate expérimentalement que
l'assimilation dépend énormément du pH
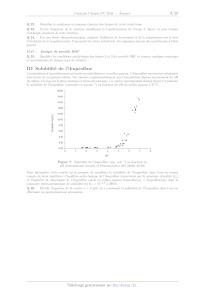
du milieu, à la fois sur le plan cinétique et thermodynamique. La courbe
expérimentale donnée figure 7 représente
la solubilité de l'ibuprofène (exprimée en mg-mL !) en fonction du pH du milieu
aqueux à 37 °C.
2000 -
1800 -
1600 -
1400 + »
e $
Solubility (mg/mL)
Figure 7 Solubilité de l'ibuprofène (mg : mL) en fonction du
pH (International Journal of Pharmaceutics 253 (2003) 49-59)
Pour interpréter cette courbe on se propose de modéliser la solubilité de
l'ibuprofène dans l'eau en tenant
compte de deux équilibres : l'équilibre acido-basique de l'ibuprofène
(caractérisé par la constante d'acidité K,)
et l'équilibre de dissolution de l'ibuprofène solide en milieu aqueux
ibuprofène(s) = ibuprofène(aq) dont la
constante thermodynamique de solubilité est X, = 107% à 298 K.
Q 26. Établir l'équation de la courbe s = f (pH) où s représente la solubilité
de l'ibuprofène dans l'eau en
effectuant les approximations nécessaires.
X008/2024-05-03 18:04:16 Page 9/20 (CO) BY-Nc-SA |
IV Stabilité du médicament
La stabilité d'un médicament et la prévision de sa durée de vie reposent sur
une étude de l'évolution de
la concentration du principe actif en solution aqueuse (dans des conditions
acides ou basiques données) à
température fixée. Les directives d''ICH (/nternational Conference on
Harmonisation of technical requirements
for registration of pharmaceuticals for human use) font référence et sont
essentielles pour fixer la date de
péremption des produits finis.
Si l'ibuprofène présente une très forte stabilité (sa date de péremption est de
4 à 5 ans), ce n'est pas le cas de la
plupart des antibiotiques, telle que la (+)-thiénamycine (figure 8 a) ou l'un
de ses dérivés, l'imipénèm (figure 8
b) dont la stabilité en milieu aqueux est étudiée dans cette partie.
--+ AT
S
CO:H CO:H
a. structure de la thiénamycine b. Structure de l'imipénem
Figure 8
IV.A -- Étude de la dégradation d'un dérivé de la thiénamycine
IV.A.1) Étude structurale de la thiénamycine
Q 27. Indiquer la signification physique du symbole (+) devant thiénamycine.
Q 28. Attribuer le descripteur stéréochimique de la double liaison CC
dissymétrique ainsi que de l'atome de
carbone stéréogène repéré par un astérisque dans la structure de la
thiénamicyne.
Q 29. Déterminer le nombre total de stéréoisomères de configuration de la
thiénamycine. Justifier la réponse.
On ne demande pas de les représenter.
IV.A.2) Cinétique de dégradation de l'imipénem en milieu tampon
On étudie la cinétique d'hydrolyse de l'imipénem noté Im à 298 K en présence
d'un tampon phosphaté. La
réaction modélisant la transformation admet un ordre. Les conditions
expérimentales sont les suivantes :
T = 298 K, concentration initiale en imipénem [Im], = 6,0 - 10% mol - L-!,
[H2PO;], = [HPOY], = 1 mol-L 1.
La cinétique est suivie par des mesures d'absorbance notée À à 300 nm. Les
spectres d'absorption de l'imipénem
(courbe A) et d'un de ses produits d'hydrolyse (courbe B) sont reproduits sur
la figure 9.
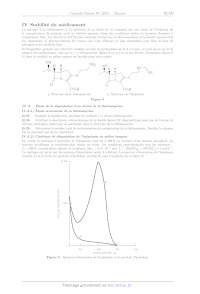
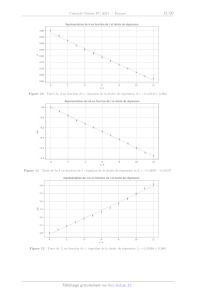
10,000 --
A
-
=
>
E
en
=
D 5.000
an
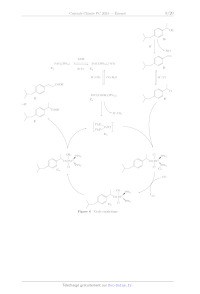
< rm < == oO Z B ; | | | 250 300 350 400 WAVELENGTH, nm Figure 9 Spectres d'absorption de l'imipénem et du produit d'hydrolyse X008/2024-05-03 18:04:16 Page 10/20 CEE Les résultats obtenus sont consignés dans le tableau 3 (Absorbance notée À et temps t exprimé en heures). (A 0 1 2 3 4 9 ( 7 8 9 10 11 12 A 1,00 0.96 0,92 0,88 0,85 0,82 0,79 0,76 0,73 0,70 0.67 0,64 0,62 Tableau 3 Évolution temporelle de l'absorbance A (Journal of Pharmaceutical Sciences Vol 87, n°12, décembre 1998, p.1572-1576) On admet que l'équation de la réaction modélisant la transformation s'écrit de manière simplifiée : Imipénem -- Produits. Q 30. Dans l'optique de proposer un modèle cinétique qui permette de décrire convenablement les résultats expéri- mentaux du tableau 3, on trace les nuages de points suivants et les barres d'incertitude associées : Commenter les conditions expérimentales et évaluer le pH du milieu réactionnel. -- À en fonction du temps (figure 10) -- In À en fonction du temps (figure 11) -- _ en fonction du temps (figure 12) Les droites de régression et leur équation ont été également ajoutées à l'aide du logiciel python. Page 11/20 CITES X008/2024-05-03 18:04:16 Représentation de À en fonction de t et droite de régression Q È 4 G & 10 L2 th Figure 10 'Tracé de À en fonction de t ; équation de la droite de régression À = --0,0314t + 0, 984 Représentation de InA en fonction de t et droite de régression 00 +. 0 2 4 6 8 19 L2 t'h Figure 11 Tracé de In À en fonction de t ; équation de la droite de régression In À = --0, 03974 -- 0,00157 Représentation de L'À en fonction de t'et droite de régression es 4 F 1.4 - 1.1 - Fe E-- 1.0 À +. 0 2 4 6 8 19 12 tin Figure 12 'Tracé de _ en fonction de t ; équation de la droite de régression _ = 0, 0509EUR + 0, 980 X008/2024-05-03 18:04:16 Page 12/20 (C)EXTES Q 31. Proposer un modèle cinétique macroscopique approprié permettant d'expliquer les résultats du ta- bleau 3. Une réponse argumentée avec l'établissement d'une expression analytique du modèle choisi est attendue. Déterminer une valeur numérique du (des) paramètre(s) du modèle. Q 32. Estimer le temps de demi-réaction pour une concentration initiale en imipénem Hmj, = 3,0 x 10 Y mol-L !. IV.B -- Synthèse totale de la (+)-thiénamycine La stratégie de synthèse de la thiénamycine présentée dans la suite du sujet est celle élaborée par Hanessian et ses collaborateurs (1990) dans l'article suivant : Hanessian, S., Desilets, D., & Bennani, Y. L. (1990). A novel ring-closure strategy for the carbapenems: The total synthesis of (+)-thienamycin. The Journal of Organic Chemistry, 55(10), 3098-3103. https://doi.org/10.1021/j000297a026 La numérotation des différents composés (1, 2, 3 etc) est totalement indépendante de celle des parties Let IT du sujet. La synthèse de la (+)-thiénamycine débute à partir du composé énantiomériquement pur 1 disponible dans le commerce ou préparé à partir de la L-thréonine elle-même énantiomériquement pure. Le schéma rétrosynthétique est présenté sur la figure 13. TBDMSO CO,H 13 thiénamycine TBDMSO TBDMSO OH O OH L-thréonine Figure 13 Schéma rétrosynthétique IV.B.1) Synthèse du composé 6 Le composé 6 est obtenu à partir du composé commercial 1 selon la séquence réactionnelle présentée sur la figure 14. TBDMSO sr Sr H H CuLi H H TS boom (7 5 Réactifs = NH | NH à préciser NC CO;PNB (@) 1 2 3 Coupure oxydante TBDMSO TBDMSO RS NO MsCI ; So CH;NO,; 2 < 2 < À N N Y ss COPNB pyridine Y à on Base 6 CO;PNB Figure 14 Séquence réactionnelle modélisant la synthèse du composé 6 X008/2024-05-03 18:04:16 Page 13/20 CEE Q 33. Indiquer la réactivité de l'organocuprate lithié (CH3 = CH - CHo)o CuLi mis en jeu lors de la trans- formation 1 -- 2. Q 34. Proposer des réactifs pour transformer le composé 2 en composé 3. La transformation du composé 3 en composé 4 consiste à effectuer la coupure oxydante de la double liaison CC terminale. Les coupures oxydantes de doubles liaisons CC sont fréquemment utilisées en synthèse organique afin de dégrader le squelette hydrogénocarboné des molécules. Diverses méthodes de mise en oeuvre de ces puissantes oxydations sont décrites dans la littérature, parmi lesquelles on retient celle utilisant le tétraoxyde d'osmium décrite dans l'encadré ci-après. Un équivalent de tétraoxyde d'osmium, OsO,, traite le dérivé éthylénique. Le diol vicinal syn obtenu est ensuite opposé à un équivalent de périodate de sodium NalO, afin de réaliser la coupure. O O 0 QUHO OsO, (1 eq). THF, 25°C GA) NalO, (1 eq) H,0 + (+) , 90% diol vivinal syn Une alternative est d'utiliser simultanément une quantité catalytique de tétraoxyde d'osmium (de l'ordre de quelques mg) et deux équivalents de NalO, : un pour regénérer OsO, et l'autre pour couper le diol vicinal intermédiairement obtenu. L'ensemble des réactifs est introduit dans « le même pot » (« one pot reaction » en anglais). \ OsO, (quantité catalytique) 0) 0) / \ NalO, (2 ed) É AC À Le coût de cette méthode est le suivant : -- périodate de sodium : 22 EUR pour 5 g : -- tétraoxyde d'osmium : 329 EUR pour 1 g. Les pictogrammes indiqués sur le flacon de tétraoxyde d'osmium sont donnés sur la figure 15. Figure 15 Pictogrammes portés sur le flacon de tétraoxyde d'osmium Q 35. Donner la configuration électronique de valence de l'osmium de symbole Os à l'état fondamental en justifiant. Q 36. Proposer un schéma de Lewis du tétraoxyde d'osmium OsO4. Q 37. Donner la structure du composé 4. Q 38. Indiquer deux intérêts à l'alternative proposée dans les conditions opératoires présentées dans l'enca- dré. On additionne progressivement une solution d'une base dans le nitrométhane anhydre CH3NO, sur le composé 4 lui-même en solution dans le nitrométhane anhydre. Après traitement du brut réactionnel, on obtient le composé 5. Ce dernier est traité par du chlorure de méthanesulfonyle en présence d'un excès de pyridine. Il se forme composé 6. Q 39. Écrire le mécanisme de la transformation 4 -- 5 en symbolisant la base par IB®. Q 40. Parmi les bases suivantes : pyridine ; 1,1,3,3-tétraméthylguanidine ; soude et triéthylamine, indiquer laquelle vous semble la plus appropriée pour former la base conjuguée du nitrométhane dans la transformation 4 -- 5. Justifier votre choix. X008/2024-05-03 18:04:16 Page 14/20 (CD) BY-Nc-sA D + Q 41. Expliquer l'intérêt d'utiliser du chlorure de méthanesulfonyle lors de la transformation 5 -- 6 puis justifier la sélectivité observée lors de l'obtention du composé 6. IV.B.2) Synthèse du composé 10 Le composé 10 est préparé à partir du composé 6 en 4 étapes détaillées dans la séquence réactionnelle présentée sur la figure 16. TBDMSO TBDMSO TBDMSO HO I 1) LiHMDS, THF Le _100°C 1) LiHMDS, THF NO; > >
Y NCLCOPNB 2) CHCOOH 2) PhSeC1
6
H:0:
Y
TBDMSO TBDMSO
YH OH
Coupure oxydante
CO,PNB
CO,PNB
Figure 16 Synthèse du composé 10
Le composé 7 est préparé en traitant d'abord le composé 6 par de
l'hexaméthyldisilazane de lithium puis en
neutralisant le milieu réactionnel avec de l'acide éthanoïque.
Q 42. Proposer un mécanisme pour la cyclisation du composé 6 en composé 7 sans
justifier la stéréosélecti-
vité.
Le protocole de la transformation 7 -- 8 décrit dans la publication est le
suivant :
« To a solution of 69 mg of hexamethyldisilazane (M = 161,4 g:mol|) in 1,0 mL
of THF at 0°C under argon
was added 0,32 mL of 1,29 mol : L 1 nBuLi in hexane and the mixture was
stirred! at 0°C' for 20 min. The
solution was cooled at -100 °C and treated with 198 mg of compound 7 (M = 495,1
g: mol !) in 6mL of THF
at --78 °C. After being stirred at --100 °C for 15 min, the solution was slowly
warmed to --80 °C and treated
with 90 mg of phenylselenyl chloride PhSeCI (M = 191,5 g-mol !) in 2 mL of THF.
The mixture was warmed
to --40 °C, acetic acid was added until pH = 5, and then, the solution was
diluted with 30 mL of saturated
NaCI solution. The aqueous layer was extracted with 2 x 25 mL of EtOAc ; the
organic layer' was treated in
the usual manner, followed by chromatography on silica gel using a mixture of
10 : 2 hexane/EtOAc as eluant
gave 184 mg of product 8 (M = 650,1 g-mol !) as an oil. »
Lo stir : agiter
The organic layer : la phase organique
Q 43. Écrire l'équation de la réaction modélisant la transformation décrite
dans la phrase en italique. Indiquer
l'intérêt de cette étape.
Q 44. Expliquer le rôle de l'ajout de 30 mL d'une solution saturée de chlorure
de sodium ainsi que l'intérêt
d'extraire deux fois la phase aqueuse avec 2 x 25 mL d'acétate d'éthyle.
Q 45. Décrire succinctement les étapes implicitement évoquées dans la phrase «
the organic layer was treated
in the usual manner ».
Q 46. Déterminer le rendement de la transformation 7 -- 8.
Le spectre de RMN du composé 10 est totalement décrit ci-après, à l'exception
des signaux associés aux noyaux
d'atomes d'hydrogène des groupes --CO,PNB et TBDMSO--. Chacun des signaux est
ainsi présenté sous le
format : Ô (ppm) (multiplicité, intégration, couplage). Les abréviations
utilisées sont les suivantes : singulet s,
doublet d, triplet t, multiplet m.
4,75 (s, 1H) ; 4,31 (m, 1H, YJ = 5,1 Hz ; *J = 6 Hz) ; 4,14 (td, 1H, *J = 7,4
Hz, YJ = 1,9 Hz);
3,15 (dd, 1H, *J = 5,1 Hz, *J= 1,9 Hz) ; 2,89 (dd, 1H, ?J = 18,8 Hz, YJ = 6,9
Hz);
2,45 (dd, 1H, *J = 18,8 Hz, *J = 7,8 Hz) ; 1,28 (d, 3H, °J = 6 Hz):
Q 47. Attribuer les signaux du spectre RMN repérés en gras et dont les
déplacements chimiques (en ppm)
sont 4,31 ; 4,14: 3,15 et 1,28.
IV.B.3) Obtention de la thiénamycine
Les trois dernières étapes mentionnées sur la figure 17 permettent d'obtenir la
thiénamycine 13 à partir du
composé 10.
X008/2024-05-03 18:04:16 Page 15/20 CEE
TBDMSO
Jul
1) (EtO),POCI, base
10 >>
O
R=-CHCHNHCO;PNB
Bu,N*, F
Y
/ SR
R=-CH,CH;,NHCO;PNB
Étape non détaillée
13 Thiénamycine
Figure 17 Obtention de la thiénamycine 13 à partir de 10
Q 48. Écrire l'équation modélisant la transformation 11 -- 12 sachant que
l'anion fluorure joue le rôle de
nucléophile. Expliciter l'intérêt du groupe TBDMS- dans la stratégie de
synthèse en identifiant deux étapes
dans lesquelles sa présence était indispensable.
La dernière étape permettant d'obtenir la thiénamycine 13 à partir de 12 n'est
pas étudiée dans le cadre de ce
problème.
X008/2024-05-03 18:04:16
Page 16/20
CETTE
Données
Orbitales frontalières de l'hydroxylamine NH, OH simulées
HO -- 13,16 eV BV -5,82 eV
Données à T -- 298 K :
-- Constante d'acidité de l'ibuprofène : pKa = 4,4
-- Constantes d'acidité de l'acide phosphorique H, PO, : pKa, = 2,2; pKas =
7,2: pKas = 12,3
-- Constantes d'acidité de l'acide citrique (représenté ci-dessous) noté H,Cit
: pKa, = 3,1; pKa = 4,8:
pKaz = 12,3
©
HO:C op OC OH
© ©
HO;C CO:H OC CO;
Structure de l'acide citrique Structure de l'ion citrate Cit*"
-- Constante d'acidité de l'acide stéarique noté RCOSH : pKa = 4,8
-- Constante d'acidité de l'ion ammonium NH} : pKa = 9,2
-- Constante d'autoprotolyse de l'eau pKe = 14,0
-- Constante des gaz parfaits : R = 8,314 J-K1:mol |
-- Enthalpie standard de dissociation de liaison AÀ,.H°(kJ : mol Y) :
._. monoxyde de :
liaison carbone CO C=0O C-C
À,.H°(kJ : mol"|) 1072 799 345
Masse molaire de l'ibuprofène M = 206,27 g - mol
Électronégativités des éléments selon l'échelle de Pauling
N:30-0:3,4-Li:0,98 - C:2,55 - Cu: 1,9
X008/2024-05-03 18:04:16 Page 17/20
Abréviations utilisées en chimie organique et pKa de composés organiques
_5--{
TBDMSO--
(tert-butyldiméthylsilyle)
y
THF tétrahydrofurane
O
H3C--S ----c|
O
MsCl (chlorure de
méthanesulfonyle)
NM NON
n-BuLi (n-butyllithium)
-------- Si Si----
4 NT NN
Li
LIHDMS hexaméthyldisilazane de
lithium
/NH
0
1,1,8,3-tétraméthylguanidine
|° QC
pyridinium pyridine
pKa = 5,3
©
CH3NO» / CHNO>
pKa = 10,2
X008/2024-05-03 18:04:16
--CO2PNB
(PNB : para-nitrobenzyle)
O
LA
ZNTN
H
HDMS Hexamethyldisilazane
| SIT | /NH
0 0
1,1,3,8-tétraméthylguanidinium 1,1,3,3-tétraméthylguanidine
pKa = 13,6
®
EtNH / EEN
triethylammonium / triethylamine
PK: -- 10,3
Page 18/20 @evncsa
Déplacements chimiques typiques de quelques protons (RMN 'H)
PR
Ps
=
X008/2024-05-03 18:04:16
\ 0
UT. C--c....
1,3-1,5 ppm | 2,1-3,2 ppm | 2,5-4,5 ppm 3,8-4,3 ppm | 4,5-5,5 ppm
Page 19/20 CIEL
r r r 6AL r r r
syy3fkyk9@y8@yj R3,y9,Re
S;2 kyfky
Groupe
7
6
5
4
3
2
1
Période
zirconium
yttrium
strontium
38
Sr
87,62
baryum
56
Ba
137,327
radium
88
Ra
[226,0254]
85,4678
césium
55
Cs
132,9054519
francium
87
Fr
[223,0197]
89)103
actinides
57)71
lanthanides
88,90585
39
Y
91
Pa
231,03588
140,116
thorium
90
Th
232,03806
138,90547
actinium
89
Ac
[227,0277]
59
Pr
uranium
protactinium
238,02891
92
U
144,242
140,90765
60
Nd
néodyme
praséodyme
58
Ce
57
La
cérium
lanthane
[264,1247]
[266,1219]
107
Bh
bohrium
seaborgium
106
Sg
186,207
75
Re
rhénium
97,9072
43
Tc
technétium
183,84
74
W
tungstène
95,94
42
Mo
molybdène
[262,1144]
105
Db
dubnium
180,94788
73
Ta
tantale
92,90638
41
Nb
niobium
[263,1125]
104
Rf
rutherfordium
178,49
72
Hf
hafnium
91,224
40
Zr
54,938045
[237,0482]
93
Np
neptunium
[144,9127]
61
Pm
prométhium
[269,1341]
108
Hs
hassium
190,23
76
Os
osmium
101,07
44
Ru
ruthérium
55,845
[244,0642]
94
Pu
plutonium
150,36
62
Sm
samarium
[268,1388]
109
Mt
meitnerium
194,217
77
Ir
iridium
102,90550
45
Rh
rhodium
58,933195
27
Co
cobalt
[243,0614]
95
Am
américium
151,964
63
Eu
europium
[272,1463]
110
Ds
darmstadtium
195,084
78
Pt
platine
106,42
46
Pd
palladium
58,6934
28
Ni
nickel
37
Rb
51,9961
fer
26
Fe
[247,0703]
96
Cm
curium
157,25
64
Gd
gadolnium
[272,1535]
111
Rg
roentgenium
196,966569
79
Au
or
107,8682
47
Ag
argent
63,546
29
Cu
cuivre
[247,0703]
97
Bk
berkélium
158,92535
65
Tb
terbium
[277]
112
Cn
copernicium
200,59
80
Hg
mercure
112,411
48
Cd
cadmium
65,39
30
Zn
zinc
"B
rubidium
50,9415
25
Mn
manganèse
!B
47,867
24
Cr
chrome
(B
44,955912
23
V
vanadium
'B
40,078
22
Ti
titane
&B
39,0983
21
Sc
scandium
%B
20
Ca
$B
#B
calcium
12
19
K
11
potassium
10
24,3050
9
22,98976928
8
aluminium
7
12
Mg
11
Na
4
magnésium
sodium
3
10,811
9,012182
6,941
[251,0796]
98
Cf
californium
162,500
66
Dy
dysprosium
[284]
113
Uut
ununtrium
204,3833
81
Tl
thallium
114,818
49
In
indium
69,723
31
Ga
gallium
26,9815386
13
Al
5
B
[252,0830]
99
Es
einsteinium
164,93032
67
Ho
holmium
[289]
114
Uuq
ununquadium
207,2
82
Pb
plomb
118,710
50
Sn
étain
72,61
32
Ge
germanium
28,0855
14
Si
silicium
12,0107
6
C
carbone
$A
#A
bore
14
13
4
Be
6
synthétique
bérylium
5
désintégration
d'autres
éléments
3
Li
masse atomique relative ou [celle de l'isotope le plus stable ]
primordial
Tableau périodique des éléments (adapté de Wikipédia)
lithium
1,00794
1
H
hydrogène
2
"A
1
!A
[257,0951]
100
Fm
fermium
167,259
68
Er
erbium
[288]
115
Uup
ununpentium
208,98040
83
Bi
bismuth
121,760
51
Sb
antimoine
74,92160
33
As
arsenic
30,973762
15
P
phosphore
14,00674
7
N
azote
%A
15
[258,0984]
101
Md
mendélévium
168,93421
69
Tm
thulium
[292]
116
Uuh
ununhexium
[208,9824]
84
Po
polonium
127,60
52
Te
tellure
78,96
34
Se
sélénium
32,066
16
S
soufre
15,9994
8
O
oxygène
&A
16
[259,1011]
102
No
nobélium
173,04
70
Yb
ytterbium
[292]
117
Uus
ununseptium
[209,9871]
85
At
astate
126,90447
53
I
iode
79,904
35
Br
brome
35,4527
17
Cl
chlore
18,9984032
9
F
uor
'A
17
18
[262,110]
103
Lr
lawrencium
174,967
71
Lu
lutécium
[294]
118
Uuo
ununoctium
[222,0176]
86
Rn
radon
131,29
54
Xe
xénon
83,80
36
Kr
krypton
39,948
18
Ar
argon
20,1797
10
Ne
néon
4,002602
2
He
hélium
(A