e3a Chimie PC 2006
| Thème de l'épreuve | Adsorption et croissance d'une couche d'oxyde sur du nickel. Synthèse de l'ibuprofène et de la cantharidine. |
| Principaux outils utilisés | diagrammes d'Ellingham, thermochimie, cristallographie, chimie organique |
Corrigé
:👈 gratuite pour tous les corrigés si tu crées un compte
👈 l'accès aux indications de tous les corrigés ne coûte que 1 € ⬅ clique ici
👈 gratuite pour tous les corrigés si tu crées un compte
- - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - -
👈 gratuite pour ce corrigé si tu crées un compte
Énoncé complet
(télécharger le PDF)







Rapport du jury
(télécharger le PDF)


Énoncé obtenu par reconnaissance optique des caractères
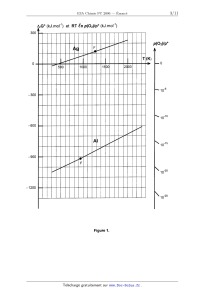
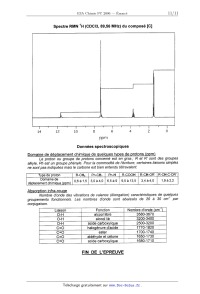
CONCOURS ENSAM - ESTP - EUCLIDE - ARCHIMEDE Epreuve de Chimie PC durée 3 heures Si, au cours de l'épreuve, un candidat repère ce qui lui semble être une erreur d'énoncé, d'une part il le signale au chef de salle, d'autre part il le signale sur sa copie et poursuit sa composition en indiquant les raisons des initiatives qu'il est amené à prendre. L'usage de la calculatrice est autorisé A rendre avec la copie : . Document--réponse (figure 1). Pensez à remplir l'entête du document réponse. Ce problème traite, dans ses deux premières parties, des phénomènes d'adsorption puis de croissance d'une couche d'oxyde sur un substrat métallique, avec application au nickel. La troisième partie est consacrée aux synthèses de deux composés organiques : ibuprofène et cantharidine, pour lesquels le nickel intervient comme réactif ou comme catalyseur. Remargues préliminaires importantes : Il est rappelé aux candidat(e)s que : 4 les explications des phénomènes étudiés interviennent dans la notation au même titre que les calculs ; les résultats exprimés sans unité ne seront pas comptabilisés. % dans tous les calculs, les gaz sont assimilés à des gaz parfaits (leurs pressions partie/les sont notées en caractères ita/iques) et les phases solides sont considérées comme nohmiscibles ; il en est de même pour les phases liquides. On utilise les indices suivants : (s) solide ; (I) liquide ; (g) gaz. <" les données numériques sont répertoriées à la fin dela deuxième partie du problème. le document--ré anse fi ure 1 devra être rendu avec la co ie a re'savoir été complété. La plupart des métaux ne sont pas stables au contact de l'air : ils réagissent spontanément en formant un oxyde. La réaction d'un métal avec le dioxygène gazeux, en absence d'un électrolyte, est appelée oxydation à basse température (typiquement pour des températures de 300 °C) ; la diffusion n'intervient guère dans le processus de croissance de l'oxyde en raison d'un coefficient de diffusion trop faible. Pour des températures plus élevées, la vitesse de croissance de l'oxyde est contrôlée par la diffusion; il s'agit d'une oxydation à haute température, également dénommée corrosion sèche. Tournez la page S.V.P . PREMIERE PARTIE ETUDE DE LA REACTION D'OXYDATION D'UN METAL L'objet de cette partie est d'étudier sous quelles conditions de température et de pression, un métal M peut être oxydé suivant la réaction : Métal + 02 = oxyde [1] A1. Définir la variance v du système à l'équilibre. La calculer dans le cas où métal et oxyde sont dans des phases solides ou liquides non miscibles. Commenter le résultat obtenu. Le tracé des diagrammes d'El/ingham de l'argent et de l'aluminium (pour une mole de dioxygène) est reproduit sur la figure 1. _A_2_. Rappeler "les conditions de l'approximation d'Ellingham". Que représentent sur ce diagramme l'ordonnée à l'origine et la pente d'une droite ? Comment explique--t-on un changement de pente sur une courbe d'Ellingham ? A3. Dans l'intervalle de température [298 K - 2200 K], exprimer l'enthalpie libre standard de la réaction d'oxydation du nickel en fonction de la température, pour une mole de dioxygène, en se plaçant dans l'approximation d'Ellingham. Tracer sur le document-réponse (où la figure 1 a été reproduite) le diagramme correspondant au nickel sur cet intervalle de température. A4. Quelles sont les conséquences d'une augmentation de température à pression constante, puis d'une augmentation de pression à température constante, sur cet équilibre ? (justifier qualitativement la réponse) A5. Sur le même graphique tracer le graphe de RT Ên[p(Oz)/po] en fonction de la température, pour les deux pressions partielles suivantes : p(02) = 0,2 bar et 10"10 bar, avec p0 = 1 bar. A6. En utilisant l'affinité chimique, retrouver les domaines d'existence du métal et de l'oxyde sur le diagramme d'Ellingham, pour une pression partielle de dioxygène de 10"10 bar. A7. Evaluer, en utilisant la figure 1 et en reportant les éventuels tracés sur le document-réponse : a) pour l'argent, la température d'équilibre d'oxydation dans l'air, b) pour le nickel et l'aluminium, la pression de dioxygène à l'équilibre, appelée pression de corrosion, à 1600 K. (il est rappelé que l'air, sous une pression d'un bar et a la température de 298 K, renferme 20 % de dioxygène) A8. Expliquer pourquoi la plupart des métaux subissent dans l'air une oxydation à la température ambiante. Dans quel domaine de pression de dioxygène devrait--on opérer pour que le nickel ne soit pas oxydé à 1000 K ? A9. Ces métaux subissant l'oxydation dans l'air doivent en être protégés. Citer deux méthodes usuelles pour éviter ce phénomène. A,G° (kJ.moi'1) et RT Ên p(0;)lp° (kJ.mol'1) Illlllllllllllllllflllll "" P(°2)'P° A "'illllll Illllll!ÿ!!lfl!.ul lllll!!.ullllllllllllllfl«> @ " Illll...lllfllllfilllïlll 0 "' ..ll'll 10"5 !" .. 1 0-20 Figure 1. Tournez la page S.V.P. ' DEUXIEME PARTIE MODELISATION DE L'OXYDATION D'UNE PLAQUE DE NICKEL Adsorption du dioxygène sur un métal Une plaque de métal a sa surface en contact avec le dioxygène, a la pression p(02), à la température T. Dans une première étape, le dioxygène s'adsorbe a la surface sur des sites privilégiés, notés "8" pour donner des atomes d'oxygène adsorbés appelés Dad, suivant la réaction : O2(g) + 28 = 2 Gad [2] B1*a. Si le processus évolue de façon spontanée, quel est le signe de I'enthalpie libre de réaction AG,... de la réaction [2] ? B1*b. Quel est le signe de l'entropie de réaction ArSad ? (justifier qualitativement) En déduire le signe de I'enthalpie de réaction ArHad de cette réaction d'adsorption. La réaction est--elle endo-- ou exothermique ? Le taux de recouvrement 1 du métal par des atomes d'oxygène adsorbés est défini 0 par : t = [ ad] [So] surface et [so] le nombre total de sites actifs par unité de surface. où [Dad] représente le nombre d'atomes d'oxygène adsorbés par unité de Approche structurale de l'adsorptîon Le nickel possède une structure compacte cubique à faces centrées, de paramètre a. BZ*a. Dessiner (en perspective ou en projection dans un plan de base) la maille du nickel et préciser le nombre de motifs par maille. 82*b. Déterminer la coordinence ainsi que la compacité de cette structure (dans le cadre d'un modèle simplifié de sphères rigides indéformables). BZ*c. Les valeurs du paramètre de maille et du rayon métallique de l'atome de nickel sont-elles compatibles avec la structure proposée ? bidimensionnelles dites de coïncidence. La figure 2(a) représentée à partir de clichés de diffraction des électrons lents (LE. E. D. ) décrit la toute première phase d'adsorption du dioxygène sur un plan appelé (001) du nickel, qui correspond simplement a la face supérieure (ou plan XY) de la maille cubique. B3*a. Dessiner la maille élémentaire du réseau bidimensionnel formé par les seuls atomes d'oxygène adsorbés (notés Dad). (a) : face supérieure (b) : vue de profil Figure 2. B3*b. Préciser la forme de cette maille de coïncidence ; déterminer son paramètre de maille a en fonction de a, puis calculer sa valeur. B3*c. Donner les coordinences du site occupé par Oad vis--à-vis de Ni et de Gad. BS*d. Evaluer le taux de recouvrement 11 dans les premiers instants. La figure 2(b) montre une coupe de la maille cubique par un plan vertical (YZ) passant par Oad et deux atomes Ni. _B_4_._ Evaluer la distance séparant les centres de deux atomes de nickel en contact avec Dad, puis la longueur de la liaison Ni-Oad, sachant que les plans horizontaux passant par Ni ou par Oad sont séparés d'une distance d = 135 pm. En déduire le rayon effectif de Gad dans l'hypothèse d'une liaison covalente et conclure. Dans un stade ultérieur de l'adsorption, une nouvelle structure bidimensionne/Ie se forme. La figure 3 reproduit les résultats obtenus par la même technique de diffraction et pour le même plan (001 ). Figure 3. Tournez la page S.V.P. 85*a. Dessiner la nouvelle maille de coïncidence. Cette maille est-elle élémentaire ? B5*b. Evaluer le taux de recouvrement correspondant 12 ; comparer avec l'étape précédente. Recouvrement du métal par la couche d'oxyde Après adsorption chimique du dioxygène sur le substrat et germination de l'oxyde, puis croissance latérale des germes, la surface du métal se recouvre uniformément d'une couche d'oxyde. Le comportement de ce film d'oxyde par rapport au substrat métallique se caractérise à l'aide d'un coefficient A appelé rapport de Pilling-- Bedworth, défini comme le rapport du volume molaire de l'oxyde formé à celui du métal consommé. Bô*a. Exprimer ce rapport A en fonction de M...) et MM, les masses molaires respectives de l'oxyde et du métal, et de leurs masses volumiques notées p(0x) et pa.... PiI/ing et Bedworth ont montré que ce rapport A doit se situer entre 1 et 2,4 pour assurer une croissance régulière de l'oxyde sur le métal ainsi qu'une parfaite adhésion sur le substrat. Bô*b. Calculer, à l'aide des données fournies en annexe, le rapport A pour les métaux suivants : magnésium (Mg), nickel (Ni) et niobium (Nb). Bô*c. Pour lequel de ces trois métaux, l'oxyde correspondant recouvre--HI le plus efficacement la surface métallique ? Que se produit-il dans les deux autres cas ? DONNEES NUMERIQUES En désigne le logarithme népérien et 109 le logarithme décimal. Données numérigues générales : Masses molaires (en g.mo|") : o : 15,0 ; Mg : 24,3 ; Ni : 58,7 ; Nb : 92,9 Constante de Boltzmann : k = 1,38.10'23 J.K'1 Constante des gaz parfaits : R = 8,31 J.K'Ïmol'1 Constante d'Avogadro : @//"Â = 6,02.1023 mol"1 Données thermodynamigues : Enthalpie molaire Elément Masse volumique ou composé Enthalpie standard Entropie molaire Température de formation à 298 K standard à 298 K de fusion (AfH°) en kJ.mol'1 (5°) en J.K'1.mol'1 (T,) en K 42,5 1235 121,3 29,9 1725 8900 38,0 2263 6670 28,3 933 10,9 2700 50,9 2320 3960 205,2 ... . _ _ ... 32,7 26,9 36,4 137,2 de fusion à T1. à 298 K sous 1bar AH... en kJ.mol'1 11,3 (p) en kg.m'3 10500 7140 > 195 92»: & --31,0 176 Z :" L", O 2 9 NiO(s) ' 244,6 2 A & A1203(5) - 15750 1740 923 2750 27,0 8570 1733 ' 'Üb "" V' V 4470 EUR [5] ___--"___, [C] (C9H1002) 2)CHgOH 2) H+ H2Û O 2- [F>]__/ T2 7 SO [D] ..Ê9ÊÏL, [E] % [F] (ma10ntawe) H*, H O ' réduction ___--___»[G] __Â_Ë_, [H] _ËÊ--IÏIl--> ibuprofène (C13H18Û2) ... 1 bar C1*a. Combien d'insaturations le composé [C] possède--HI ? D'après la première ligne de réactions, quelle(s) fonction(s) ou groupement(s) [C] possède- -t- il ? Sachant qu 'en infra- -rouge son spectre présente une bande d'absorption à 1702 cm et en interprétant le spectre RMN fourni en annexe, déterminer sa formule semi- -développée puis le nommer. Attribuer chacun des signaux à son type d'hydrogène et interpréter sa multiplicité. C1*b. Déterminer [B] de formule brute C...H1202. Proposer un autre enchaînement de réactions pour obtenir [C] à partir de [A]. C2*a. Ecrire les formules semi-développées de [D], [E] et [F]. C2*b. En quelle quantité le chlorure d'aluminium doit--il être utilisé? Justifier la réponse. Donner le mécanisme de la réaction qui conduit de [E] à [F] (ne pas justifier sa régiosélectivité). _Ç_3_a,_ Une réduction de [F] conduit à [G] de formule brute C13H1803. Déterminer [G]. Citer un réducteur possible. _C$ A quel type de réaction correspond le passage de [G] à [H] ? Ecrire la formule semi--développée de [H] puis celle de l'ibuprofène [J]. Des résultats cliniques montrent que l'organisme réagit trois fois plus vite a l'isomère (S) qu'au mélange racémique. La première étape de la synthèse de cet isomère pur nécessite la préparation de l'acide (S)-2--chloropropanoïque [K] a partir d'un acide aminé, l'alanine (ou acide (S)-2--aminopropanoïque}. Puis suit l'enchaînement suivant : % SOC|2 2- méthyl- -1 p--hényIpropane[ HO OH, H A|C|3© [N] Réarrangement _Ç_5_, Représenter dans l'espace l'acide (S)--2--chloropropano'ique [K]. _Ç_6_._ Montrer que deux sites de [L] sont susceptibles de réagir avec le 2-- méthyl-- --1- phény|propane. Sachant que [M] est l'isomère para et qu'il présente en absorption infra- -rouge une bande d'absorption à 1685 cm ,déterminer sa formule semi- -développée. Préciser la configuration absolue de son carbone asymétrique. _ÇL Ecrire la formule semi-développée de [N] et donner son mécanisme d'obtention. _Ç_ÿ_= Proposer une méthode de synthèse de [J] à partir de [P]. Synthèse de la cantharidine La cantharidine, isolée pour la première fois parle pharmacien français Robiquet en 1810, joue un rôle important dans l'écologie de plusieurs types d'insectes qui l'utilisent comme moyen de défense afin de préserver leurs oeufs des prédateurs. Sa structure est la suivante : Elle peut être obtenue à partir de [A], par l'enchaînement suivant : __çOZCH3 w 'ÈoZCH3 =cH2sch5 A] 1] LiAIHQ B 1 CH 80 Cl, ridine ' [C [] 2) H2Û H+ [ ] 2) C2H5SN8 : ] Î:H2sczH5 Tournez la page S.V.P. D1*a 10 __cstc2H5 ? ' 1) OsO suivi d'h drolyse réductrice |C| " V [D] 5 2) H2, Ni 3) HIO4 :ÔHZSCZH5 [D] 30 [E] |) Ph Li, éther [F] _ 2),H20 H :CH3 CHO . La cantharidine est-elle chirale? Donner les configurations absolues des carbones asymétriques 1, 2, 3 et 4. D1*b. Donner une représentation schématique de son spectre RMN en indiquant la position relative des pics et en précisant pour chaque signal, sa multiplicité et son intensité (nombre d'hydrogènes équivalents). Sur quel diénophile faut-il faire réagir le butadiéne pour obtenir le composé [A] ? Quelle est le nom de cette réaction ? Indiquer le transfert des électrons conduisant au produit [A]. L'action de LiAIH4 sur [A] conduit aprés hydrolyse à la formation d'un composé [B], présentant en infra- r--ouge une forte absorption vers 3600 cm (bande large); indiquer la formule semi- -développée de [B]. Pourquoi utilise-t-on le chlorure de méthanesulfonyle, CH3802C|, qui a la même réactivité qu'un chlorure d'acer ? Quels sont les produits issus de chacune des réactions - notées 1), 2), 3) - permettant de passer de [C] à [D], de formule brute C12H18O3 ? Il est précisé que le dihydrogène en présence de nickel de Raney réduit les fonctions thioéthers en alcane. Par quelle(s) réaction(s) [E] peut-il être obtenu à partir de [D] ? Représenter la molécule [F] et le schéma du mécanisme permettant de l'obtenir. Quel produit [F'] se formerait-il par action de (Ph)2CuLi avec [E], suivie d'une hydrolyse acide ? La synthèse dela cantharidine se termine par les trois étapes suivantes : H H----3------*O "\ .----Q--Zæ--HÀQ--> cantharidine CH3 CHPh 11 Spectre RMN 1H (CDCI3, 89,56 MHz) du composé [C] 14 12 10 8 6 4 2 0 Dim Données spectroscopiques Domaine de dé Iacementchimi ue de uel uest es de rotons m Le proton ou groupe de protons concerné est en gras ; R et R' sont des groupes alkyle, Ph est un groupe phényle. Pour la commodité de l'écriture, certaines liaisons simples ne sont pas indiquées mais le carbone est bien entendu tétravalent. Type de proton Ph-CH-- R-COOH R--CH-OR' R-CH--C--OR' Domaine de ' _ ' ' délacement chimi--ue . .... °»6 81»5 3»0 8 410 6,5 à 9 9,5 a 13,5 3,4 à 4,0 1,9 a 2,2 e Absorption infra-mug Nombre d'onde des vibrations de valence (élongation) caractéristiques de quelques groupements fonctionnels. Les nombres d'onde sont abaissés de 20 à 30 cm'1 par conjugaison. Liaison Nombre d'onde cm" - 3580--3670 - 3200-3400 - 2500--3200 17704 820 1700---1 740 1650-1730 1680-1710 FIN DE L'EPREUVE YYYYOOO OOOOIII