Mines Chimie PC 2002
| Thème de l'épreuve | Génie de la réaction chimique. Synthèse du (+)-occidentalol. |
| Principaux outils utilisés | cinétique chimique, chimie organique |
| Mots clefs | occidentalol, réacteur chimique, orbitale moléculaire, méthode de Hückel |
Corrigé
:👈 gratuite pour tous les corrigés si tu crées un compte
👈 l'accès aux indications de tous les corrigés ne coûte que 1 € ⬅ clique ici
👈 gratuite pour tous les corrigés si tu crées un compte
- - - - - - - - - - - - - - - - - - - - - - - - - - - - - - -
👈 gratuite pour ce corrigé si tu crées un compte
- - - - - - - - -
Énoncé complet
(télécharger le PDF)










Rapport du jury
(télécharger le PDF)




Énoncé obtenu par reconnaissance optique des caractères
12073
A 2002 Chimie PC
ECOLE NATIONALE DES PONTS ET CHAUSSEES.
ECOLES NATIONALES SUPERIEURES DE L'AERONAUTIQUE ET DE L'ESPACE,
DES TECHNIQUES AVANCEES, DES TELECOMMUNÏCATIONS,
DES MINES DE PARIS, DES MINES DE SAINT--ETIENNE, DES MINES DE NANCY,
DES TELECOMMUNÏCATIONS DE BRETAGNE.
ECOLE POLYTECHNÏQUE ( Filière TSI ).
CONCOURS D'ADMISSION 2002
EPREUVE DE CHIMIE
Filière : PC
Durée de l'épreuve : 4 heures
L'usage d'ordinateur ou de calculatrice est interdit
Sujet mis à la disposition des concours : Cycle International, ENSTIM, TPE--ENR
Les candidats sont priés de mentionner de façon apparente sur la première page
de la copie :
CHIMIE 2002--Filière PC
. Cet énoncé comporte 12 pages de texte.
Si au cours de l'épreuve, un candidat repère ce qui lui semble être une erreur
d'énoncé, il le signale sur
sa copie et poursuit sa composition en expliquant les raisons des initiatives
qu'il est amené à prendre.
DEBUT DE L'ENONCE
Un procédé de fabrication est en général conçu autour d'une ou plusieurs
réactions chimiques. La connaissance
de base, thermodynamique et cinétique, de ces réactions est certes essentielle,
mais c'est le génie de la réaction
chimique qui va permettre de concevoir les réacteurs industriels, de calculer
leurs dimensions et d'optimiser
leurs conditions de fonctionnement.
Ce problème aborde certains aspects du génie de la réaction chimique dans un
contexte relativement simple : on
se propose de découvrir le principe de fonctionnement de trois types de
réacteurs, leur mode de calcul, ainsi que
leurs critères de choix.
On considérera dans tout ce problème que le milieu réactif est liquide, de
volume constant, et comporte en
général Il composés A,, supposés constituer entre eux une solution idéale.
kième
Ce milieu est le siège de m réactions chimiques repérées par l'indice k ( 1 5 k
5 rn). La réaction correspond
II
au bilan : Zva Ai =0. Les coefficients stoechiométriques ... sont algébriques :
leur signe obéit à la
i=l
convention usuelle sur les produits et réactifs d'une transformation chimique.
La vitesse spécifique d'une réaction chimique k, notée wk, est exprimée en
quantité de matière par unité de
temps et de volume.
Page 1/12 Tournez la page S.V.P.
Chimie 2002 Filière -- PC
A--I. PREMIERE APPROCHE DES MODELES DE REACTEURS
On considère tout d'abord un "réacteur élémentaire", c'est-à-dire une enceinte
de volume constant V, utilisée
pour réaliser une ou plusieurs réactions chimiques dans des conditions désirées.
A l'instant t, on suppose que ce réacteur contient ni (t) moles de chaque
constituant A (i = l,..n) dont les
concentrations respectives Ci(t) sont supposées uniformes dans tout le volume.
Ce réacteur est alimenté par un
débit molaire JOE(t) en chaque constituant i ; par ailleurs chaque constituant
i est soutiré avec un débit molaire
Jis(t). On suppose également que ce réacteur fonctionne dans des conditions
isothermes.
1- Montrer que la variation au cours du temps de la concentration molaire de
chaque constituant dans le réacteur
' ' ' . dCi m 1 ( )
peut s ecr1re sous la forme . _dt_= ?:;va wk +--'7 J iE -- J iS
2- On envisage tout d'abord le cas particulier : Jæ = 0 et Jas = 0 pour tout i
et à tout instant. Le système physico--
chimique étudié est--il ouvert ou fermé '? Est--il isolé '? Vers quel type
d'état asymptotique tend-il lorsque t --> oo ?
3-- On se place maintenant dans le cas général où les débits molaires JOE et
Jis ne sont pas tous nuls. Dans le cas
où les débits molaires Jæ et Jis sont constants dans le temps, le système tend
asymptotiquement vers un état
stationnaire. Définir ce terme avec précision.
A--H.-- PRESENTATION DES TROIS TYPES DE REACTEURS IDEAUX
Les réacteurs dits idéaux constituent des modèles de référence pour la
description des réacteurs réels. Dans ce
problème, on distinguera les trois grandes classes suivantes :
-- le réacteur fermé parfaitement agité
(RFPA)
-- le réacteur continu parfaitement agité
(RCPA)
-- le réacteur tubulaire ou réacteur piston (RP)
Page 2/ 12
Chimie 2002 Filière - PC
On désignera par V le volume total de chacun des réacteurs.
Dans le cas du réacteur fermé parfaitement agité (RFPA), J m = 0 : J iS V i &
{l,..,n}. Le mélange réactionnel est
introduit dans le réacteur à l'instant t = 0 et soutiré à l'instant tf. Tout au
long de l'opération, les concentrations
respectives C" (t) évoluent de la valeur initiale C? à la valeur finale Cf .
Les réacteurs ouverts (RCPA) et (RP) sont traversés par un écoulement de débit
volumique total F supposé
uniforme et constant. On note 1 le rapport V/F et on le nomme temps de séjour.
On suppose que la composition
de lahmentaüon E de ces reacteurs est mamtenue constante (les concentrations Ci
des composes 1 dans
l'alimentation sont constantes) et qu'ils fonctionnent dans des conditions
stationnaires (les concentrations
internes Ci et les concentrations de soutirage Cis des composés i
respectivement dans le réacteur et dans le
soutirage sont constantes).
Dans le cas des réacteurs parfaitement agités (RF PA et RCPA), le milieu est
supposé avoir une composition
uniforme en tout point et identique à celle du flux sortant du réacteur dans le
cas du RCPA.
Dans le cas du réacteur piston RP, au contraire, les espèces chimiques se
déplacent tout au long du réacteur en se
transformant progressivement.
Dans cette partie A.II, on examine le cas particulier où une seule réaction (m
= l), de vitesse spécifique w], peut
se produire dans le milieu.
!'
(:.
. ' d - .
4-- Pour le réacteur de type RF PA, établir la relatmn : t; = I C' , valable
pour tout 1.
C? "i, 1"'1
CS --(:]E
5-- Pour le réacteur de type RCPA, établir la relation : r : ------'----'-- ,
valable pour tout i.
"i,1"'1
6-- Le réacteur piston RP est considéré comme une suite de "réacteurs
élémentaires" (au sens donné à ces termes
en A.I) disposés en série et de volume dV.
Justifier la relation différentielle valable en tout point à l'état
stationnaire :
aci
_ .OE
d0
=v...wl (l) avec d0= F
Remarque : on peut aussi considérer 0c0mme le temps mis par un élément de
fluide entre 1 'entrée E du réacteur
et la position considérée.
Intégrer ensuite la relation différentielle (l) sur l'ensemble du réacteur
piston pour trouver :
S
J'Ci dCi
T = _ (2)
E
Ci "i,1"'1
Page 3/12 Tournez la page S.V.P.
Chimie 2002 Filière - PC
A--III.-- COMPARAISON DES TROIS TYPES DE REACTEURS IDEAUX-- CHOIX
D'UN REACTEUR DANS UN CAS SIMPLE
On se propose de comparer les performances des trois types de réacteurs
présentés dans la partie A.II sur le cas
précis d'une réaction.
7-- Soit un réacteur de 100 L de type RCPA. Ce réacteur est le siège d'une
seule réaction : A1 ---> A2, d'ordre 0 par
rapport à A2 et d'ordre on inconnu par rapport à A1. La concentration de A1
dans l'alimentation est CF = 0,1
mol.L". On donne ci-après les résultats d'une étude expérimentale relative à ce
réacteur dans laquelle on a
déterminé la concentration C? en A1 dans le soutirage pour différentes valeurs
du débit volumique total F.
Donner l'expression de la loi de vitesse dans l'hypothèse d'un ordre en égal à
1. Calculer les valeurs de la
constante de vitesse k1 pour les cinq valeurs de F reportées dans le tableau.
Conclure.
Donner la valeur numérique moyenne de cette constante de vitesse en précisant
l'unité.
8-- Sachant que l'on veut traiter un débit de 50 L. min " du mélange
réactionnel précédent (concentration initiale
en A1 : 0,1 mol.L"), déterminer quel taux de transformation de A1 en A2
permettent d'atteindre :
a- un RCPA de 100 L;
b-- deux RCPA de 50 L chacun disposés en série .
9-- Avec un réacteur piston de 100 L, toujours pour un débit de 50 L. min ", le
taux de transformation obtenu est
de 95%. En reprenant l'expression du temps de séjour retrouver cette valeur.
Commenter.
On prendra exp(--2,8) z 0,06 .
Page 4/12
Chimie 2002 Filière - PC
A-IV.-- ETUDE D'UN SYSTEME REACTIONNEL PLUS COMPLEXE.
On envisage dans cette partie le problème très fréquent de réactions
consécutives, à partir d'un exemple, la
fabrication de la méthylolurée.
C'est un intermédiaire important dans la fabrication des matières plastiques
appelées uroplastes. La méthylolurée
: NH2CONHCHZOH (composé A3) se forme dans une solution aqueuse à 35 °C et pH =
5 par la réaction entre
Purée NH2CONH2 (composé A1) et le formol (nom commun du méthanal en solution
aqueuse, composé Az, ).
Cette réaction (réaction 1) se déroule selon un ordre 1 par rapport à chacun
des réactifs. Sa constante de vitesse
est notée k1 :
NHZCONH2 + HZCO --Ë1--> NH£ONHÇHfiH [1]
A1 A2 A3
Une autre réaction (réaction 2) a lieu ensuite, également d'ordre 1 par rapport
à chacun des réactifs :
NHZCONHCHZOH + NH2CONH2 ---kz--> NH,CONHCH,NHÇONH2 + H20 [2]
A3 A1 A4 A5
Les constantes de vitesse ont les valeurs suivantes :
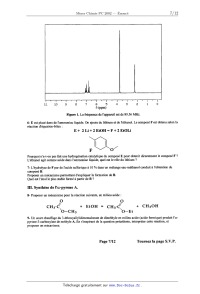
1<1 = 3,36. 104 mol"'.L.s'l k2 = 4,02. 10'5 mol'l.L.s'l En opérant en présence d'un excès d'urée (5 mol.L"), on provoque une dégénérescence d'ordre par rapport à l'urée. La concentration en formol de l'alimentation est de 0,5 mol.L". Il n'y a pas de méthylolurée dans l'alimentation. 10-- On envisage de réaliser la production de A3 dans un réacteur piston RP. Après l'avoir généralisée au cas de deux réactions chimiques, écrire la relation (1) (établie à la question 6) pour les composés A2 puis A3. 1 1-- Exprimer en fonction du paramètre 6 la variation de la concentration en méthanal. 12-- Déterminer ensuite la variation de la concentration en méthylolurée le long du réacteur. Montrer qu'elle passe par un maximum pour une valeur donnée de la variable 6. . . k Calculer ce temps de Séj0UI optimal. On prendra ln(-Ë--] z 2,1 . 2 Pour cette durée optimale de séjour, le taux de transformation calculé grâce à l'expression précédemment obtenue est proche de 90% 13-. A quelle longueur optimale du réacteur, supposé cylindrique, de diamètre interne D et alimenté par le débit volumique F, correspond ce temps de séjour optimal ? Page 5/12 Tournez la page S.V.P. Chimie 2002 Filière - PC Partie B : Synthèse de l'occidentalol Le (+)--occidentalol est un sesquiterpène naturel présent dans la sève de certains conifères (thuya occidentalis par exemple). La détermination de sa structure et la construction du squelette de cette molécule ont été l'objet de nombreuses recherches. 1. Structure du (+)-occidentale]. La formule du (+)--occidentalol est la suivante : 1- Indiquer, parmi les atomes de carbone 5, 6, 7, 8, 9 et 10, ceux qui sont asymétriques. Justifier la réponse. Donner leur configuration. La synthèse proposée par E.J . Corey en 1972 utilise une a-pyrone A et une cétone B (Tetrahedron Lett., 1972, 4651.) /O \ 0 A B 0 2 Me H. Synthèse de la cétone B. 2-- À partir du toluène, proposer en une ou plusieurs étapes, une synthèse de la 4--méthylaniline C. Préciser lorsque cela est possible les mécanismes des réactions rencontrées et justifier les régiosélectivités observées au cours de la synthèse. 3-- Comment transformer le groupe amino de la molécule C en groupe hydroxyle pour obtenir le composé D ? Donner les équation-bilan des réactions mises en jeu. Nommer le composé D. 4-- Le composé D est traité par de l'hydroxyde de sodium et donne un anion qui réagit avec l'iodométhane pour donner le composé E. Donner la formule de E. Expliquer le rôle de l'hydroxyde de sodium. Donner le mécanisme de la réaction faisant intervenir l'iodométhane. 5-- Le spectre RMN du proton 1H du composé E est donné sur la figure 1. lnterpréter l'allure du spectre, et montrer qu'il correspond bien à E. (Voir données de RMN en fin de sujet) Page 6/12 Chimie 2002 Filière - PC 1 1 10 9 8 7 8 5 4 3 2 1 0 5 (ppm) Figure 1. La fréquence de l'appareil est de 89,56 MHz. 6-- E est placé dans de l'ammoniac liquide. On ajoute du lithium et de l'éthanol. Le composé F est obtenu selon la réaction d'équation-bîlan : E+ 2Li+2EtOH=F+2EtOLi F 0/ Pourquoi n'a--t-on pas fait une hydrogénation catalytique du composé E pour obtenir directement le composé F '? L'éthanol agit comme acide dans l'ammoniac liquide, quel est le rôle du lithium '? 7-- L'hydrolyse de F par de l'acide sulfurique à 10 % dans un mélange eau--méthane] conduit à l'obtention du composé B. Proposer un mécanisme permettant d'expliquer la formation de B. Quel est l'énol le plus stable formé à partir de B ? III. Synthèse de l'a--pyrone A. 8-- Proposer un mécanisme pour la réaction suivante, en milieu acide : o o / CH3-C/\ + EtOH = CH3--C// + CH30H O--CH_--, \O--Et 9-- Un court chauffage du 3-éthoxyallylidènemalonate de diméthyle en milieu acide (acide formique) produit l'a- pyrone--3-carboxylate de méthyle A. En s'inspirant de la question précédente, interpréter cette réaction, et proposer un mécanisme. Page 7/12 Tournez la page S.V.P. Chimie 2002 Filière - PC 3--éthoxyallylidèncmalonate de diméther IV. Formation du squelette. L'a-pyrone A réagit avec la cétone B à 150°C pendant 24 heures sous courant d'azote pour donner finalement le cétoester H. L'intermédiaire réactionnel G, non isolé provient de la réaction directe entre A et B. () Acone B G H 02CH3 @. --» + 0 G H H H 0 C02CH3 COZCH3 Orbitales moléculaires du système % de la cétone B. Les orbitales moléculaires sont calculées par la méthode de Hückel simple. Le groupe méthyle est assimilé à un groupe mésomère donneur et apporte ainsi 2 électrons n. Les paramètres de Huckel utilisés dans ce problème sont les suivants : Oxygène un électron: deux électrons : La cétone B contient deux systèmes 1: non conjugués. La cétone B peut être modélisée par la somme de deux fragments qui donnent les niveaux d'énergie des systèmes n. Les fragments utilisés pour la modélisation sont l'acétone (propanone) I et le 2--méthylbut--2-ène J. ] @@ Le tableau suivant donne l'énergie et les coefficients des orbitales moléculaires de la propanone. Par exemple, la valeur 0,29 correspondant à l'Orbitale Moléculaire n° la (OM N° la) et l'atome 4 est le coefficient de l'orbitale atomique de l'atome 4 dans la combinaison linéaire donnant l'orbitale moléculaire la. Page 8/12 Chimie 2002 Filière - PC atome 1 atome 2 atome 3 atome 4 0,60 -- 0,71 ---- 0,32 --- 0,21 Energie et + 2,52 B a + 2,00 B a + 1,35 B a --- 0,87 B Le tableau suivant donne l'énergie et les coefficients des orbitales moléculaires du 2-méthylbut--2-ène. atome 1 atome 2 atome 3 0,56 -- 0,30 -- 0,71 -- 0,27 -- 0,16 Energie et + 2,5 B a + 2,19 B a+2,00 B a+ 0,52 B a-- 1,23 B La numérotation des atomes dans ces deux fragments est la suivante : 1 5 1 2 2 Y 3 40 4 10-- Classer l'ensemble des orbitales moléculaires 1c précédentes par ordre d'énergie croissante. Parmi l'ensemble de ces orbitales, quelle est la plus haute occupée (HO), quelle est la plus basse vacante (BV) ? Justifier. Orbitales moléculaires du système n de l'énol issu de la cétone B. Cet énol est modélisé par le 5-méthylhexa--2,4-dîén--2--o], avec la numérotation suivante : 1 7 Hâ--<_>ê--6
\ /
2 3 4
Le tableau suivant donne l'énergie et les coefficients des orbitales
moléculaires de l'énol K.
Energie atome 1 atome 2 atome 3 atome 4 atome 5 atome 6 atome 7 atome 8
a+2,56 B
a+2,47B
a+2,00B
a+2,00 B
a+1,34B
a+0,22 B
a--0,89B
a---- 1,71 B
1
2
3
4
5
6
7
8
0,50
-- 0,27
-- 0,11
-- 0,74
-- 0,21
0,19
0,14
-- 0,08
0,41
--0,18
0,00
0,00
0,19
--- 0,49
---- 0,60
0,4 1
0,22
--- 0,01
0,00
0,00
0,59
-- 0,42
0,30
--- 0,58
0,20
0,38
0,00
0,00
0,21
0,5 1
---- 0,59
-- 0,39
0,25
0,56
---- 0,70
0,1 1
-- 0,23
-- 0,20
0,14
0,07
0,25
0,56
0,70
--- 0,11
- 0,23
- 0,20
0,14
0,07
11-- Quelle est l'orbitale la plus haute occupée, quelle est l'orbitale la plus
basse vacante '? Justifier.
Orbitales moléculaires du système n de l'a-pyrone A.
L'a--pyrone--3-carboxylate de méthyle A est modélisée par l'a-pyrone L sans le
groupe carbométhoxy
(COZCH3) avec la numérotation suivante :
Page 9/12
0,58
-- 0,31
0,10
0,65
-- 0,24
0,22
0,17
--- 0,09
Tournez la page S.V.P.
Chimie 2002 Filière -- PC
5
4/06
L
3\2107
Le tableau suivant donne l'énergie et les coefficients des orbitales
moléculaires de l'a-pyrone L :
_ Energie atome 1 atome 2 atome 3 atome 4 atome 5 atome 6 atome 7
0,19 0,13 0,16 0,29 0,79 0,23
0,41 0,28 0,06 - 0,19 - 0,46 0,60
0,25 0,55 0,57 0,30 _ 0,17 - 0,39
-- 0,52 -- 0,17 0,41 0,44 -- 0,15 0,53
0,31 -- 0,54 --- 0,04 0,56 -- 0,30 -- 0,26
-- 0,35 -- 0,16 0,53 -- 0,44 --- 0,03 -- 0,26
-- 0,50 0,51 -- 0,44 0,30 --- 0,15 -- 0,15
12-- Établir le déterminant séculaire de la molécule. La numérotation des
atomes doit être rigoureusement
respectée.
13- Quelle est l'orbitale la plus haute occupée, quelle est l'orbitale la plus
basse vacante ? Justifier.
Réaction.
14-- L'a--pyrone L peut réagir avec la cétone B ou l'énol K selon une réaction
que l'on nommera. Préciser dans
chaque cas quel est l'électrophile et que] est le nucléophile. En admettant que
la liaison carbone--carbone qui se
forme de façon privilégiée fait intervenir les atomes qui ont les plus gros
coefficients dans chacune des orbitales
interagissantes, déterminer quels sont les produits majoritaires obtenus dans
chaque cas (seule la régiosélectivité
de la réaction sera prise en compte pour cette question).
15-- Quel est de la cétone B ou de l'énol K le composé le plus réactif vis à
vis de l'a--pyrone A ? Conclure.
16-- À quel(s) stéréoisomère(s) doit--on s'attendre lors de la formation de G ?
Expliquer.
Dans la suite du problème les raisonnements sont faits sur le seul
stéréoisomère :
0
O
H,C0,C
17-- Proposer un mécanisme pour le passage de G à H.
V. Transformation du groupe carbométhoxy en groupe méthyle.
Un mélange équimolaire d'éthane--l,2-diol et de H en solution dans le benzène
est chauffé en présence d'acide
paratoluène sulfonique. Un composé M est obtenu.
18- Donner la formule de M et le mécanisme de sa formation. Quel est le rôle de
l'acide paratoluène
sulfonique '?
M est traité par le tétrahydruroaluminate de lithium (LiAIH4) dans l'éther et
donne un composé N après
hydrolyse.
Page 10/12
Chimie 2002 Filière -- PC
19-- Peut-on utiliser le tétrahydruroaluminate de lithium dans un solvant
protique tel que l'eau ou l'alcool ?
Pourquoi '?
20-- Rappeler le schéma mécanistique simple d'action d'un organomagnésien mixte
sur un ester.
21-- Par analogie, proposer un mécanisme pour la formation de N et donner sa
formule développée.
L'alcool N noté RCHZOH est mis en réaction avec un mélange équimoléculaire de
trioxyde de soufre et de
pyridine en solution dans le tétrahydr0furane (THF) à 0°C pendant 5 heures. Il
se forme un sulfonate de
pyridinium O.
@ @
RCHz--O--SO3 ON--H
O
Le groupe sulfonate de pyridinium est un très bon nucléofi1ge.
O est traité par le tétrahydruroaluminate de lithium dans le THF et donne P de
formule C14H2002.
22- Interpréter cette dernière réaction. De quel type de réaction s'agit-il ?
Donner la formule de P.
P chauffé en présence d'une solution d'acide chlorhydrique molaire donne Q.
23-- Donner la formule de Q. Quel est l'intérêt du groupe protecteur utilisé
ici ?
VI. Transformation du groupe carbonyle.
Q est traité par le composé R en présence d'une base organique dans le
diméthyléther à 62 °C. Le composé S est
obtenu.
l
\ R \ SMe S
|| H
24-- Montrer que le composé R possède un atome d'hydrogène labile. Que donne
l'action de la base organique
sur ce composé ?
25-- Expliquer la formation de S en remarquant la similitude avec une réaction
que l'on précisera.
Le groupe méthylthio SMe est transformé en groupe hydroxy OH. La
tautomérisation qui s'ensuit donne
finalement un couple de diastéréoîsomères T1 et T2. Les proportions obtenues
sont dans le rapport [T1]/ [T2] =
1/2,9. T1 est éliminé par chromatographie sur gel de silice.
«& @
Page 11/12 Tournez la page S.V.P.
Chimie 2002 Filière -- PC
26-- De quelle tautomérie s'agit-il dans la transformation précédente ? (La
stéréosélectivîté n'est pas à expliquer).
27--Expliquer en quatre lignes au maximum le principe de la chromatographie.
28-- Le composé T2 est transformé en (+}occidentalol par l'action du
méthyllithium MeLi dans l'éther %. 70°C
suivie d'une hydrolyse. Proposer un mécanisme pour cette réaction.
Données de R.M.N. :
Tre de oroton
Alker RCH3
Al.ker RCHZR
Benzyüque C6H5
Éther ROCH2R
Aromafique C6H5H
Phénofique CÔH5OH
Déplacements chimiques des protons.
L'atome d'hydrogène concerné est indiqué avec une taille plus grosse et en
caractère gras.
FIN DE L'ENONCE
FIN DE L'EPREUVE.
Page 12/12
---- D'après documents fournis.
IMPRIMERIE NATIONALE.