Mines Chimie PC 2014
| Thème de l'épreuve | Étude de quelques composés du cuivre. Étude d'une synthèse de la (+)-bakkenolide A. |
| Principaux outils utilisés | chimie organique, cinétique chimique, mélanges binaires, cristallographie, oxydoréduction |
| Mots clefs | cuivre, bakkenolide |
Corrigé
:👈 gratuite pour tous les corrigés si tu crées un compte
👈 l'accès aux indications de tous les corrigés ne coûte que 1 € ⬅ clique ici
👈 gratuite pour tous les corrigés si tu crées un compte
- - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - -
👈 gratuite pour ce corrigé si tu crées un compte
- - -
Énoncé complet
(télécharger le PDF)















Rapport du jury
(télécharger le PDF)





Énoncé obtenu par reconnaissance optique des caractères
A 2014 Chimie PC
ECOLE DES PONTS PARISTECH,
SUPAERO (ISAE), ENSTA PARISTECH,
TELECOM PARISTECH, MINES PARISTECH,
MINES DE SAINT-ETIENNE, MINES DE NANCY,
TELECOM BRETAGNE, ENSAE PARISTECH (FILIERE MP)
ECOLE POLYTECHNIQUE (FILIÈRE TSI)
CONCOURS D'ADMISSION 2014
EPREUVE DE CHIMIE
Filière : PC
Durée de l'épreuve : 4 heures
Sujet mis à disposition des concours :
Cycle International, ENSTIM, TELECOM INT, TPE-EIVP
Les candidats sont priés de mentionner de façon apparente sur la première page
de la copie
CHIMIE 2014 - Filière PC
L'usage d'ordinateur ou de calculette est interdit.
L 'e'nonce' de cette épreuve, particulière aux candidats de la filière PC,
comporte 19 pages.
' Les candidats pourront admettre tout résultat fourni dans l'énoncé, qu'ils
n'auraient pas
établi, mais qui serait utile dans la poursuite de l'épreuve.
' Les candidats ne devront pas hésiter à formuler des commentaires succincts
qui leur
sembleront pertinents, même si l'énoncé ne le demande pas explicitement, à
condition
qu'ils s'inscrivent dans le programme du concours et soient en rapport avec le
problème
posé.
' Le barème tiendra compte de la longueur de l'énoncé.
' Si, au cours de l'épreuve, le candidat repère ce qui lui semble être une
erreur d'énoncé, il
le signale sur sa copie et poursuit sa composition en expliquant les raisons
des initiatives
qu'il est amené à prendre.
Page 1/19 Tournez la page S.V.P.
Chimie 2014 Filière PC
DEBUT DE L'ENONCE
Des données utiles a la résolution du problème sont fournies a la fin de l
énoncé.
Cette épreuve est constituée de deux parties indépendantes.
ETUDE DE QUELQUES COMPOSES DU CUIVRE
Ce problème est constitué de 2 sous--parties indépendantes. La première est
consacrée au
cuivre métallique et a ses alliages, la seconde au cuivre(l) dans les oxydes,
en solution et
dans des complexes mimant une activité biologique.
Le cuivre et ses alliages.
1- Sachant que le cuivre possède deux isotopes stables de nombre de masse
respectifs 63
et 65, calculer l'abondance relative naturelle de chacun d'entre eux.
La structure électronique de l'atome de cuivre a l 'état fondamental est [Ar ]
3d104s1.
2- Expliquer la signification de cette notation. Est-ce la configuration
attendue selon les
règles de remplissage ? Justifier.
3- Sachant que la structure du cuivre métallique est de type cubique à faces
centrées,
calculer sa masse volumique. Pour simplifier les calculs, on prendra la masse
d'un atome de
cuivre égale à 1,0.10'22 g.
Les laitons sont des alliages de cuivre et de zinc, contenant éventuellement d
'autres métaux a
l 'état de traces. Ils renferment de 5% a 45% (en masse) de zinc. On note pc"
le pourcentage
massique du cuivre et pzn le pourcentage massique du zinc dans le laiton.
On cherche a déterminer la composition d 'un laiton.
On attaque 10 g d 'un alliage en laiton par une solution d'acide sulfurique
diluée utilisée en
excès. On observe un dégagement gazeux et il reste du métal une fois la
réaction complète.
4- Quelle réaction a lieu ? Quel est le gaz formé ? Quel est le métal restant ?
Justifier.
On souhaite réaliser un premier dosage en mesurant la quantité de gaz obtenue.
5- Quelle(s) hypothèse(s) doit-on faire pour que le dosage soit valide ? En
déduire pzn si
on récupère 900 mL de gaz pour 10g de laiton à 300 K. On considèrera que le
volume
molaire des gaz parfaits est de 25L à cette température.
6- Expliquer pourquoi il faudra utiliser de l'acide nitrique si on veut obtenir
une mise en
solution complète du laiton.
Page 2/19
Chimie 2014 Filière PC
On veut maintenant doser la solution S obtenue par dissolution de 10 g de
laiton par l 'acide
nitrique selon un protocole permettant d 'obtenir 500 mL de solution. On
réalise le titrage des
ions cuivriques Cu2+ de cette solution de la façon suivante.
On ajoute à cette solution un excès d'iodure de potassium. On obtient du cuivre
au degré
d 'oxydation (1) sous forme de précipite d 'iodure cuivreux selon la réaction :
Cu2+ + 2 1' = 1/2 12 + Cul(s)
Le diiode libéré est alors dosé par une solution titrée de thiosulfate de
sodium Na 2S 203 selon
la réaction : [2 + 2 S2032-- = 2 l_ + S406 _
A 25 mL de la solution S, on ajoute environ 10 mL de solution d 'iodure de
potassium K] a
20 %. On titre par une solution de thiosulfate de sodium de concentration
C = 5, 0.101 mol.L'l. Le volume équivalent obtenu est de 12,0 mL. La couleur
brune de l 'iode
apparaît ainsi qu'un précipite beige de Cul.
7- Montrer par un calcul que la réaction entre les ions iodure et cuivrique est
quantitative.
8- Le zinc dissous est-il susceptible de perturber le dosage du cuivre ?
Justifier.
9- Expliquer pourquoi il n'est pas nécessaire de mesurer exactement la quantité
de KI.
Quelle est la seule contrainte sur la quantité de KI ajoutée ?
10- Calculer la concentration en mol.L'1 de cuivre de la solution S. En déduire
le
pourcentage massique en cuivre dans le laiton.
Dans le cas du mélange argent-cuivre, on observe une solubilité partielle a l
etat solide.
On donne les points caractéristiques du diagramme binaire isobare ( P = P°)
argent-cuivre,
x(Cu) représente la fraction atomique en cuivre du mélange.
Ag Cu
1400 _
.
1300 f _
È- .
1200 f . -
EUR 1100 * o o o
2 f o o 0
3 :
E 1000 _ .
.... *
°-- ,
E _
Q 900 f . .
800: -
700 :- -
600 *
0 0,1 0,2 0,3 0,4 0,5 0,6 0,7 0,8 0,9
x (Cu)
Page 3/19 Tournez la page S.V.P.
Chimie 2014 Filière PC
11- Reproduire schématiquement le diagramme en reliant les points de façon
appropriée.
Préciser les espèces (nature et état physique) présentes dans les différents
domaines du
diagramme ainsi définis et préciser les coordonnées du point eutectique.
On laisse refroidir lentement un mélange argent--cuivre avec x(Cu) = 0,2 de
1400 K a 800 K.
12- Tracer l'allure de la courbe donnant la température du système en fonction
du temps
(courbe d'analyse thermique) et préciser la variance du système au cours de la
transformation.
13- Déterminer la composition du système à 1100 K.
On considère un barreau d 'argent contenant 10% de cuivre considéré comme une
impureté.
14- En vous aidant du diagramme, proposer une méthode de purification du barreau
d' argent.
Le cuivre au degré d'oxydation +I.
On s'intéresse tout d'abord a la stabilité de l 'oxyde de cuivre(I) a 900K. On
considère le
tableau de données thermodynamiques situé enfin d 'énoncé.
15- Donner la définition de AfH° et expliquer pourquoi cette valeur est nulle
pour Cu(s) et
O2(g)-
16- Donner le nom de la grandeur SO et expliquer pourquoi cette valeur n'est
pas nulle
pour Cu(s) et Og(g).
17- Montrer que Cu20(s) est stable à 900 K sous pression atmosphérique.
On s'intéresse a présent a la stabilité de Cu(I) en phase aqueuse. Trois degrés
d'oxydation
sont envisageables pour le cuivre : Cu"), Cu+(aq) et Cu2+(aq). Les deux cations
précipitent en
présence d'ions hydroxydes.
18- Discuter la stabilité de Cu+ en phase aqueuse à pH = 0. On donnera la
réaction
considérée et on déterminera si elle est quantitative.
19- Discuter la stabilité de Cu(l) en milieu basique. On donnera la réaction
considérée et
on déterminera si elle est quantitative.
Page 4/19
Chimie 2014 Filière PC
Le cation cuivre(l) forme, dans les systèmes d intérêt biologique, des
complexes avec le
dioxygène.
20- Construire le diagramme d'orbitales moléculaires du dioxygène en rappelant
les
règles utilisées. Expliquer en quoi ce diagramme permet de déterminer
correctement l'état de
spin fondamental du dioxygène, ce que ne permettait pas de faire la simple
structure de Lewis
de la molécule. Représenter les deux orbitales semi-remplies de plus haute
énergie.
La coordination se fait par interaction d 'une des orbitales d du cation
cuivre(l) avec ces deux
orbitales semi-remplies.
21- Considérant le remplissage des orbitales d de Cu+, en déduire le sens du
transfert
électronique entre le cation Cu+ et le dioxygène.
Certains complexes du cuivre(l) forment par addition avec le dioxygène des
composés dont la
réactivité se rapproche de celle de systèmes biologiques. C 'est le cas par
exemple pour les
complexes de tris[ (2--piridyl)méthylj amine, noté T MPA dans la suite.
/ \ _
_N N N
TMPA
Dans le cas particulier du complexe formé entre ce ligand et le cuivre(l), sa
réaction avec un
excès de 02 dans l 'acétonitrile ( CH 3CN) conduit a la formation d'un complexe
a deux cations
cuivre [ {( TMPA}Cu};(Û;}ÏÏ considéré comme un modèle du centre actif de la
tyrosinase.
La formation de ce complexe se fait selon le schéma cinétique suivant, dont
toutes les étapes
sont supposées élémentaires (on considérera que toutes les espèces sont
dissoutes dans
l 'acétonitrile) :
k
[(TIVIPA)CU]+ + 0 --1 [(TIVIPA)CU(02)]+ (1)
2--
k-1
k
[(TIVIPA)CU]+ + [(TIVIPA)CU(02)]+ --2 [{(TI\/IPA)CU}Z(OZ)]2+ (2)
_
k-2
Page 5/19 Tournez la page S.V.P.
Chimie 2014 Filière PC
22- Que signifie le terme « étape élémentaire»? Quelles en sont les
conséquences sur
l'expression de la vitesse des différentes réactions ci-dessus ?
Dans tous les cas, la valeur de k.; est beaucoup plus faible que celle des
autres constantes de
vitesse. Dans ces conditions, l 'étape (2) pourra être considérée comme non
renversable pour
la résolution de la loi de vitesse.
23- Déterminer la relation entre la concentration initiale Cc,o en complexe
[(TMPA)Cu]+
et la concentration Cp,in au bout d'un temps infini en produit
[{(TMPA)Cub(OÛ]2+ .
I er cas: à haute température, les constantes k; et k. 1 sont beaucoup plus
grandes que kg et k.;
et on peut considérer à tout instant que l équilibre ( l ) est atteint.
24- Montrer que l'on peut alors considérer que les deux étapes du schéma
précédent
peuvent être décrites en une seule étape, dont on exprimera la constante de
vitesse k3 en
fonction de de lq, kg et k-]:
k
2[(TMPA)Cu]*+OZ _3> [{(TMPA)CU}Z(OZ)]Z+
25- En faisant l'hypothèse que l'excès de dioxygéne par rapport au complexe est
trés
grand, en déduire l'expression de la concentration en [{(TMPA)Cu}z(Oz)]2+ en
fonction du
temps.
2ème cas: à basse température, on peut considérer que la concentration de l
'espèce
[ ( T MPA) Cu( 02) ] + varie très faiblement, et peut être considérée comme
stationnaire. On peut
alors considérer que la dérivée de cette concentration est nulle : c 'est l
'approximation des
états quasi--stationnaires.
26- En déduire l'expression de la loi de vitesse dans ces conditions.
Page 6/19
Chimie 2014 Filière PC
L 'origine de cette différence de comportement provient a' 'une forte variation
de la constante
k.] avec la température. La valeur de celle--ci a 200 K est de 8 s'] alors qu
'elle est de 2.108 s']
a 300 K.
27- Evaluer la valeur de l'énergie d'activation correspondante et expliquer
pourquoi la
réaction considérée est très sensible à la température.
\ ETUDE D'UNE SYNTHESE DE LA (+)-BAKKENOLIDE A
Isole'e pour la première fois en 1968 de la rhubarbe des tourbières (Petasites
japonicus), la
( +)-bakkenolide A, est une substance qui possède des propriétés antitumorales
et
insecticides. Dans cette partie, on se propose d'étudier une partie de la
synthèse totale de
cette molécule (Carneiro et al., ]. Org. Chem. 2010, 75, 2877-2882).
Structure de la molécule de (+)-bakkenolide A
La formule de la ( +)-bakkenolide A est la suivante :
28- Que signifie le symbole (+) dans (+)-bakkenolide A ? Quels sont les atomes
de
carbone asymétriques dans la molécule de (+)-bakkenolide A ? Combien peut-on
avoir au
maximum de stéréoisomères de configuration ?
29- Déterminer, en le justifiant, le descripteur stéréochimique R ou S des
atomes de
carbone 5 et 7 de la molécule de (+)--bakkenolide A.
Page 7/ 19 Tournez la page S.V.P.
Chimie 2014 Filière PC
30- Recopier la structure oi-dessous et la compléter en dessinant les deux
groupements
méthyle manquants. Ces groupements méthyle sont--ils en position axiale ou
équatoriale ?
O
O --H
lA
La molécule de départ de la synthèse est la cyclohexane-1,3-dione A qui est
ajoutée a une
solution aqueuse concentrée d'hydroxyde de sodium, on ajoute ensuite 2,3
équivalents
d'iodométhane a cette solution, ce qui signifie qu'on introduit dans le milieu
réactionnel
n(CHJ) : 2,3 "mum/À)-
O O 1. NaOH 5M/H20 0 0
Ü 2. CH3I (2,3 éq.)
A reflux 17h B
59 %
31- Donner la formule de Lewis de l'anion formé à l'étape 1 et expliquer sa
formation. Le
mécanisme le plus plausible pour l'étape 2 est-il de type SN2 ou SNI? Justifier.
32- Quel autre produit B1 , de formule brute CgH1202, est formé lors de cette
réaction?
Pourquoi ajoute-t-on alors un excès d'iodométhane par rapport à la dione A?
Pourquoi le
produit B est-il majoritaire ?
Le composé B est ensuite mis en milieu acide en présence de but--3-èn-Z-one (ou
méthylvinylcétone} C : on observe la formation du composé D .
Page 8/19
Chimie 2014 Filière PC
o o
0 0 o CH3COOH 0,01M/H20
+ )V :
75°C -1h
B (: D 0
Dans les conditions de cette réaction, en milieu acide, la dione B s'isomérise
rapidement
pour donner la 3-lzydroxy-Z-me'tlzylcyclohex-Z-e'n-1-one B ' selon la réaction
renversable
suivante:
0 o H+ HO 0
-->
<--. B B' 33- Comment appelle-t-on la relation d'isomérie entre la dione B et B' ? Montrer que pour le com osé B' l'atome de carbone C2 ossède un caractère nucléo bile. ? A l 'équilibre chimique entre B et B', le produit B' est majoritaire dans l 'eau (K 1°(298K) =20) et minoritaire dans le dichlorométlzane (K 2°(298K)=0, 5 ). 34- Proposer une explication à cette observation. En milieu acide, la but--3-èn-Z-one C peut être protonée. 35- Montrer que l'acide conjugué de C, noté CH+, possède 2 centres électrophiles que l'on précisera. 36- Déduire des questions précédentes un mécanisme qui rende compte de la formation de la trione D à partir des composés B' et C en milieu acide (on ne cherchera pas à justifier la régiosélectivité de cette réaction). Page 9/19 Tournez la page S.V.P. Chimie 2014 Filière PC Pour étudier la régiosélectivité de la formation de la trione D, on suppose que cette réaction est sous contrôle orbitalaire. Les orbitales moléculaires J'L' sont calculées par la méthode de Hiickel simple. Le groupement méthyle est assimilé a un groupe mésomère donneur qui apporte 2 électrons J'L'. Le composé B ' est modélisé par le composé B " dont la formule est la suivante : 637 8 H0/ o 2 4 1B"5 Le tableau suivant donne l'énergie et les coefficients des orbitales moléculaires JT du composé B ". Energie C1 C2 C3 C4 C5 05 C7 08 \... u + 2,630 0,39 0,35 0,36 0,31 0,35 0,43 0,40 0,20 \|;2 u + 2,380 --0,41 --0,22 0,09 0,32 0,59 --0,50 0,17 0,24 \|;3 u + 2,170 0,13 0,03 --0,19 0,11 0,47 0,26 --0,80 0,00 \|;4 u + 2,040 --0,75 --0,05 0,00 0,00 --0,01 0,65 0,08 0,00 \|;5 u + 1,510 --0,07 0,05 0,16 0,36 --0,52 --0,06 --0,23 0,71 \Il6 u + 0,630 --0,24 0,47 0,60 0,14 --0,07 --0,21 --0,31 --0,44 \|;7 0t -- 0,610 --0,17 0,64 --0,17 --0,57 0,16 --0,16 0,05 0,38 \|18 0t -- 1,700 0,08 --0,44 0,64 --0,56 0,11 0,08 --0,12 0,22 37- quelle est la plus basse vacante (BV)? Justifier. Page 10/19 Parmi les orbitales moléculaires fl: précédentes, quelle est la plus haute occupée (HO), Chimie 2014 Filière PC Le tableau suivant donne l 'e'nergie et les coefficient des orbitales moléculaires JT de l 'e'none C. Energie C'1 C'2 C'3 C'4 0'5 qu a + 2,43 0 0,77 0,47 0,23 0,10 0,34 0 5' (p2 @ + 1,600 0,60 0,34 0,36 0,22 0,58 )ÿ4, % a + 0,990 0,01 0,01 --0,58 0,59 0,56 1' 3' (... 0t -- 0,440 0,15 --0,53 --0,30 0,67 0,40 EUR (|)5 0t -- 1,600 0,12 --0,61 0,63 --0,39 0,25 38- Parmi les orbitales moléculaires 71: précédentes, quelle est la plus haute occupée (HO), quelle est la plus basse vacante (BV)? Justifier. Lorsque l'énone C se protone, l'énergie de ses orbitales frontières diminue (assistance électrophile). On suppose que les orbitales frontières de CH + ont les mêmes coefficients que les orbitales frontières de C et que EBV( CH + ) > oc.
39- Dans le cadre de l'approximation des orbitales frontières, indiquer quelles
sont les
orbitales qui interviennent lors de la réaction entre B" et CH+. Quel est le
produit majoritaire
obtenu ? Conclure quant àla régiosélectivité de la formation de D.
Le composé D est mis a réagir dans du DMSO anhydre en présence de S--proline en
quantité
catalytique. On obtient le composé H (cétone de Wieland--Miesher) avec un
rendement de
5 7%.
N
H O
S--proline
O
H
cétone de Wieland--Miesher
Page 11/19 Tournez la page S.V.P.
Chimie 2014 Filière PC
Pour expliquer la formation préférentielle de H, des études ont montré que la
S--proline et le
composé D réagissent pour former le composé E dont la formule et la conformation
privilégiée sont données ei-dessous :
O
MO
.Z & N /
HOOC"" N %o-"'H
O
O
E
O
conformation
privilégiée de E
40- Que représente le trait pointillé dans la conformation privilégiée de E ?
Quel est
l'ordre de grandeur de l'énergie de ce type d'interaction ?
Lorsque le composé E est dans sa conformation privilégiée, il peut réagir de
manière
intramoléculaire pour donner le composé zwitterionique F, représenté
ci-dessous. Ensuite, F
se décompose pour donner G, représenté ci-dessous, et de la S--proline. Enfin,
G subit une
déshydratation intramoléculaire pour donner quantitativement H.
O O
"DOC '
+/ -
N 0
OH
F G
41- Dans la molécule de E, l'atome d'azote a-t-il un effet mésomère donneur ou
accepteur
(justifier) ? En déduire un mécanisme pour expliquer la formation de F.
42- Pourquoi la déshydratation intramoléculaire de G est-elle quantitative ?
Page 12/19
Chimie 2014 Filière PC
43- Donner la formule semi-développée du produit minoritaire H' formé à partir
de D en
même temps que H. Comment peut-on qualifier cette réaction et ce type de
catalyse ?
1 \
eta
44- Le spectre infra-rouge de H présente deux bandes d'absorption fortes à 1670
cm"
1740 cm'1. A quelles liaisons peut-on attribuer ces bandes d'absorption?
Comment expliquer
la différence observée entre les valeurs de ces deux nombres d'onde ?
La suite de la synthèse est la suivante :
» -- K
0 p-TsOH / CH3COOH KBA / THF H20
H
NaBH4 MSC1 1-LÏAIH4/ EÎ2O déprotection
: L _) M : N ... - ... ...... .)
MeOH / THF Et3N /CH2C12 2- H20 0
0
Un mélange e'quimolaire d'éthane-1,Z-dithiol et de H en solution dans l 'acide
acétique est
mis a réagir en présence d ' acide paratolue'nesulfonique On obtient le composé
I, représenté
ci-dessous, avec un rendement de 99%. On précise que la formation du
dithioce'tal cyclique I
est analogue a la réaction entre H et l 'éthane-1,Z-diol
O
8 Q.
3] (HI -- H3)
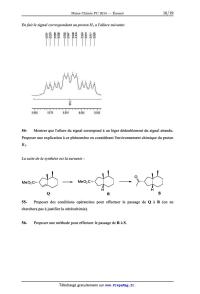
53- Quelle est l'allure du signal attendu pour ce proton ?
Page 15/19 Tournez la page S.V.P.
Chimie 2014 Filière PC
En fait le signal correspondant au proton H1 a l'allure suivante:
%
|
"' ?: Ê :
- -'- '--'-"-'. '-L=Î-' '-Û
m m m mm mm 03
ËËËII
TT
--3
%
3-ËÜÛ 3 .5?5 3 .55Ü 3525 3.5 ÛÛ
54- Montrer que l'allure du signal correspond à un léger dédoublement du signal
attendu.
Proposer une explication à ce phénomène en considérant l'environnement chimique
du proton
H1.
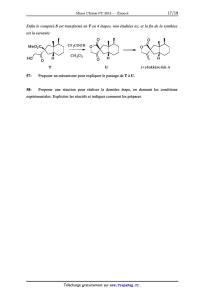
La suite de la synthèse est la suivante :
H
S
55- Proposer des conditions opératoires pour effectuer le passage de Q à R (on
ne
cherchera pas à justifier la stéréochimie).
56- Proposer une méthode pour effectuer le passage de R à S.
Page 16/19
Chimie 2014 Filière PC
Enfin le composé S est transformé en T en 4 étapes, non étudiées ici, et la fin
de la synthèse
est la suivante:
M e 02 C CF 3COO H O
\. _-- EUR.
/\\'\ CH2C12 K\\
HO O H O
T U (+)--b akkéno lide A
57- Proposer un mécanisme pour expliquer le passage de T à U.
58- Proposer une réaction pour réaliser la dernière étape, en donnant les
conditions
expérimentales. Expliciter les réactifs et indiquer comment les préparer.
Page 17/19 Tournez la page S.V.P.
Chimie 2014 Filière PC
Données:
Constante d'Avogadro : NA= 6,01023 mol"1
Constante des gaz parfaits :R= 8,3 J.K'1.mol'1
Constante de Nernst à 298 K : %ln10 = 0,06V
Z(Cu)=29
M(Cu)=63,5 g.mol'l
rayon atomique du cuivre: 128 pm
Potentiels standard à pH = 0 et 25°C :
EO (NO{/NO) = 0,96 V ; EO (Zn2+/Zn) = -0,76 V
EO (M") = 0,53 V; EO (s4062'/ s2032') = 0,09 V
EO (Cu2+/Cu) = 0,34 V ; EO(Cu2+/cu+) = 0,17 V ; E°(CuÛCu) = 0,52 V
Constantes thermodynamiques à 25°C :
Constantes de solubilité :
pKS(Cu(OH)2 )= 18,6 ; pKS(Cu(OH)) = 14,0 ; pKS(CuI)= 12,0
Données thermodynamiques à 900 K :
\ Cu(s) 02(g) Cu20(s) CuO(s)
Aan (kJ.mol'l) 0 0 -168 -155
S°(J.mol'l.K'l) 33 205 93 43
Masses molaires :
H: 1 g.mol'1 ; N: 14 g.mol'1 ; O: 16 g.mol'1 K : 39 g.mol'1 ; Zn : 65,5 g.mol'1
; I : 127
-1
g.mol
Déplacements chimiques des protons :
Type de proton 6 (en ppm)
Alkyle R-CH3 0,8 -- 1,0
Alkyle R-CH2-C-C=C 1,8-2,1
Ester R-COOCH3 3,7
L'atome d'hydrogène concerné est indiqué en caractère gras.
Page 18/19
Chimie 2014 Filière PC
. . . 1
Approx1maüons numér1ques : x/î z 70 & z --
Fin de l'énoncé
Fin de l'épreuve
Page 19/19 Tournez la page S.V.P.