Mines Chimie PC 2018
| Thème de l'épreuve | Synthèse du fragment C1-C13 du Leucascandrolide A. L'iodure d'argent. |
| Principaux outils utilisés | chimie organique, thermodynamique, cristallographie, solutions aqueuses, oxydoréduction, diagrammes E-pH |
| Mots clefs | Leucascandrolide A, spiro, conformation, effet anomère, pyrone, iodure d'argent, électrolyte solide, conduction ionique, nanoparticule |
Corrigé
:page de présentation 👈 gratuite pour tous les corrigés si tu crées un compte
indications 👈 l'accès aux indications de tous les corrigés ne coûte que 1 € ⬅ clique ici
1 👈 gratuite pour tous les corrigés si tu crées un compte
2 - 3 - 4 - 5 - 6 - 7 - 8 - 9 - 10 - 11 - 12 - 13 - 14 - 15 - 16 - 17 - 18 - 19 - 20 - 21 - 22 - 23 - 24 - 25 - 26 - 27 - 28 - 29 - 30 - 31 - 32 - 33 - 34 - 35 - 36 - 37 - 38 - 39 - 40 - 41 - 42 - 43 - 44 - 45 - 46 - 47 - 48 - 49 - 50 - 51 - 52 -
53 👈 gratuite pour ce corrigé si tu crées un compte
- 54 - 55 - 56
Énoncé complet
(télécharger le PDF)















Rapport du jury
(télécharger le PDF)








Énoncé obtenu par reconnaissance optique des caractères
A2018 CHIMIE PC
ÉCOLE DES PONTS PARISTECH,
ISAE-SUPAERO, ENSTA PARISTECH,
TELECOM PARISTECH, MINES PARISTECH,
MINES SAINT-ÉTIENNE, MINES NANCY,
IMT Atlantique, ENSAE PARISTECH.
Concours Centrale-Supélec (Cycle International),
Concours Mines-Télécom, Concours Commun TPE/EIVP.
CONCOURS 2018
ÉPREUVE DE CHIMIE
Durée de l'épreuve : 4 heures
L'usage de la calculatrice et de tout dispositif électronique est interdit.
Les candidats sont priés de mentionner de façon apparente
sur la première page de la copie :
CHIMIE - PC
L'énoncé de cette épreuve comporte 19 pages de texte.
Si, au cours de l'épreuve, un candidat repère ce qui lui semble être une erreur
d'énoncé, il le signale sur sa copie et poursuit sa composition en expliquant
les
raisons des initiatives qu'il est amené à prendre.
A 2018 Chimie PC
DEBUT DE L'ENONCE
Des données utiles à la résolution du problème sont fournies à la fin de
l'énoncé.
Cette épreuve est constituée de deux parties indépendantes.
Synthèse du fragment C1C13 du Leucascandrolide A
Le Leucascandrolide A, noté par la suite 1, est un composé naturel isolé de
l'éponge calcaire
Leucascandra caveolata collectée en 1989 dans la mer de Corail en bordure de
côte Est de la
Nouvelle Calédonie. Ce macrolide est un puissant inhibiteur de la prolifération
de cellules
cancéreuses humaines de plusieurs souches (1 est cytotoxique à partir de 50
ng.mL-1). C'est
aussi un antifongique très efficace contre la levure Candida albicans, un
pathogène qui
infecte notamment les patients immunodéprimés. Pour ces raisons, et comme 1
n'est
actuellement plus biodisponible, de nombreuses équipes scientifiques se sont
intéressées à sa
synthèse totale ou partielle dans les quinze dernières années. L'élucidation de
sa structure, en
particulier celle de la stéréochimie de ses centres stéréogènes, a résulté de
l'emploi de
nombreuses techniques spectroscopiques de pointe. La structure de 1 et son nom
IUPAC sans
indication de stéréochimie sont rapportés sur la figure 1.
H
O
H 3C
H
H
O
H
MeO
O
O
H
3
O
11
O
N
7
H
O
MeO
N
H
Leucascandrolide A 1
O
5-(2-{3-[(Méthoxycarbonyl)amino]-1-propén-1-yl}-1,3-oxazol-4-yl)pent-2-énoate
de
3-méthoxy-18-méthyl-13-[4-méthylpent-1-én-1-yl]11-oxo-12,19,20-trioxatricyclo[13.3.1.1 5,9]icos-7-yle
Figure 1 : représentation dans l'espace de la molécule de leucascandrolide A
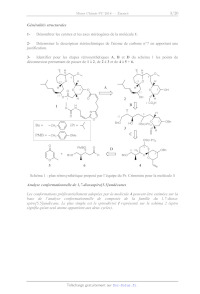
L'équipe du Pr. Crimmins a publié au cours de l'année 2000 une synthèse
partielle du
Leucascandrolide A qui décrit la préparation du fragment C1-C13. Les auteurs
proposent
également une analyse rétrosynthétique complète, représentée sur le schéma 1,
dans laquelle
le fragment C1-C13 correspond au composé 3. Les numéros des atomes qui figurent
sur
chaque fragment sont ceux classiquement utilisés, et sont différents de ceux
précédemment
employés pour la nomenclature. Cette analyse met en évidence le rôle clé joué
par
l'intermédiaire 4 dont la réactivité est liée à l'existence de conformations
privilégiées. Une
première partie du problème aborde l'analyse conformationnelle de deux composés
modèles
de la molécule 4, puis dans la seconde sa synthèse est étudiée en détail.
Page 1 sur 19
A 2018 Chimie PC
Généralités structurales
1-
Dénombrer les centres et les axes stéréogènes de la molécule 1.
2Déterminer le descripteur stéréochimique de l'atome de carbone n°7 en
apportant une
justification.
3Identifier pour les étapes rétrosynthétiques A, B et D du schéma 1 les points
de
déconnexion permettant de passer de 1 à 2, de 2 à 3 et de 4 à 5 + 6.
H
H
O
O
9
9
O
15
H
17
H
O O
H
O
H
N
PMB =
BnO
iPr =
CH2
H
13
O
Bn =
H
9
O
HO
O
OSi(i-Pr)3
3
5
OBn
H
C
OMe
CH2
OH
1 CO2H
B
H
N
O
OH
2
5
O
17
O 1
1
A
O
5
H
O
15
OSi(i-Pr)3
O
PMBO
+
BnO
O
9
D
H
OBn
13 H
BnO
O
O
5
6
5
O
4
Schéma 1 : plan rétrosynthétique proposé par l'équipe du Pr. Crimmins pour la
molécule 1
Analyse conformationnelle de 1,7-dioxaspiro[5.5]undécanes
Les conformations préférentiellement adoptées par la molécule 4 peuvent être
estimées sur la
base de l'analyse conformationnelle de composés de la famille du
1,7-dioxaspiro[5.5]undécane. Le plus simple est le spirodérivé I représenté sur
le schéma 2 (spiro
signifie qu'un seul atome appartient aux deux cycles).
Page 2 sur 19
A 2018 Chimie PC
O O
A
B
A
O
Inversion
O A
B
cycle A
ou B
B O
I
Ia
O
Inversion
cycle B
ou A
O
A
O
Ib
B
Ic
Schéma 2 : conformations possibles pour le 1,7-dioxa-spiro[5.5]undécane I
Il a été montré que la stabilité relative des conformations adoptées par la
molécule I, notées
Ia, Ib, et Ic, est dictée par l'influence antagoniste de deux groupes d'effets
: (i) des effets
stériques liés à l'encombrement des atomes et des liaisons, (ii) des effets
stéréoélectroniques,
appelés aussi effets anomères, dus aux interactions entre un doublet libre de
l'atome
d'oxygène du cycle et une liaison CO positionnée en axial du cycle. Le doublet
libre
concerné et la liaison C-O sont alors antipériplanaires. Ces dernières
interactions sont mises
en évidence sur le schéma 2 pour les conformations Ia et Ib de la molécule I,
dans lesquelles
les liaisons et les doublets concernés sont respectivement représentés en
pointillés et en grisé.
On admet dans la suite que les cycles tétrahydropyranes A et B sont
majoritairement en
conformation chaise.
Le décompte de la contribution respective de chacun des effets à l'énergie
totale pour les 3
conformations de I permet d'obtenir leur classement par énergie croissante.
Ainsi, dans la
conformation Ia, les deux atomes d'oxygène sont en position axiale par rapport
à l'autre
cycle, ce qui correspond pour chaque oxygène à deux interactions propyléther
gauche (IPG),
évaluées à 1,7 kJ·mol1 chacune. Dans la conformation Ic, deux groupes
méthylène -CH2sont orientés en position axiale, l'un par rapport au cycle A et
l'autre par rapport au cycle B,
ce qui correspond pour chacun à deux interactions butane gauche (IBG), évaluées
chacune à
3,8 kJ·mol1. Pour le conformère Ia qui possède 2 effets anomères
contrairement au
conformère Ic qui n'en a pas la contribution anomère par rapport à l'énergie
totale est
estimée à -5,9 kJ·mol1 par interaction. L'utilisation de ces valeurs permet de
calculer la
contribution globale de tous les effets par rapport à l'énergie totale pour ces
deux
conformations de la molécule I.
Conformations
Effet anomère
(kJ·mol1)
Effet stérique
(kJ·mol1)
Total (kJ·mol1)
Ia
11,8
6,8
5
Ic
-
15,2
15,2
Tableau 1 : contributions des effets stériques et électroniques pour les
conformations Ia et Ic
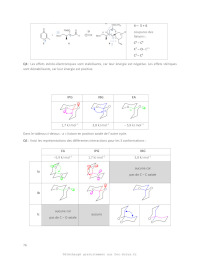
4Indiquer la nature stabilisante ou déstabilisante des effets stériques et
stéréoélectroniques décrits ci-dessus. Représenter clairement sur un schéma les
deux types
d'interactions rencontrées pour la conformation Ib.
Page 3 sur 19
A 2018 Chimie PC
5Evaluer pour la conformation Ib la somme de tous les effets, et déduire le
classement
par énergie croissante des trois conformations Ia, Ib, Ic, puis la conformation
majoritairement
adoptée par I.
Les calculs peuvent se compliquer si le dérivé spiro comporte un ou plusieurs
substituants sur
ses cycles, cas justement du composé 4. À titre de second modèle du spiranne 4,
le (2R,8S)2,8-diméthyl-1,7-dioxaspiro[5.5]undécane, noté II, est représenté sur
le schéma 3 ainsi que
ses 4 conformations possibles. Aux effets précédemment décrits pour I
s'ajoutent de nouveaux
effets stériques : les contributions des interactions 1,3-diaxiales dont les
valeurs sont
indiquées sur le schéma 3, exprimées en kJ·mol1. Les interactions butane
gauche (IBG)
résultant de la position axiale des substituants y sont aussi indiquées.
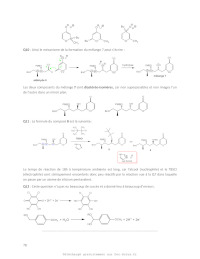
6En faisant une analyse comparable à celle réalisée pour le composé I, déduire
la (les)
conformation(s) majoritaire(s) pour la molécule II.
O
A
O
O
II
O
IIa
B
In
ve
rs
io
cy
n
cl
e
A
cy
A
IIb
O
B
In
ve
rs
cy
io
n
cl
e
A
IId
O
A
In
ve
rs
cy
io
n
cl
e
B
O
In
ve
rs
io
n
cl
e
B
O
16,7 CH 3
A
B O
IIc
O
10,0
CH 3
IBG
O B
Schéma 3 : conformations adoptées par le
2,8-diméthyl-1,7-dioxaspiro[5.5]undécane II
Synthèse de l'intermédiaire spirannique 4
Une des séquences clés de la synthèse du leucascandrolide A est la préparation
du composé 4
à partir de la méthylpyrone 5 et du pentanal fonctionnalisé 6 comme proposé sur
le schéma
rétrosynthétique (la stéréochimie de certains atomes de carbone a été omise
dans la
représentation des composés 1 à 4). Les transformations engagées pour effectuer
cette
séquence contiennent des étapes de protection/déprotection de la fonction
alcool avec des
groupements spécifiquement choisis par les auteurs, notamment silylés. Une brève
description des conditions utilisées pour préparer, puis retirer ces
groupements protecteurs
est détaillée dans le document 1.
Page 4 sur 19
A 2018 Chimie PC
Document 1 : les groupements silylés comme groupes protecteurs des alcools
Outre la protection par formation d'éthers d'alkyle, d'acétals, ou encore
d'esters, les
chimistes disposent de toute une palette de groupes protecteurs silylés afin
d'effectuer la
protection mais aussi la déprotection de fonctions alcool de manière ciblée.
L'équation
générale de formation des éthers silylés trialkylés est la suivante :
ROH + ClSiR' 3
B
CH2Cl2
B : Et 3N, imidazole
ROSiR' 3 + Cl + HB
R' : groupe alkyle
(Me, Et, i-Pr...)
HN
N
imidazole
L'élément moteur de cette réaction est la grande énergie de la liaison SiO
formée. La
déprotection de l'éther ROSiR'3 est généralement effectuée par action des ions
fluorures sur
le silicium avec un réactif comme le fluorure de tétra-n-butylammonium (TBAF)
dans le THF,
ou bien par action de l'acide fluorhydrique dans un solvant approprié :
THF
ROSiR' 3 + F
H 2O
FSiR' 3 + RO
- HO
FSiR' 3 + ROH
Elle peut aussi être réalisée en conditions aqueuses acides. L'augmentation de
l'encombrement du groupement R' permet de protéger sélectivement la fonction
alcool la
moins encombrée, et renforce également la stabilité de l'éther silylé obtenu.
La protection
résiste aux bases, aux oxydants et aux réducteurs, ainsi qu'aux
organomagnésiens.
7Indiquer le type de la réaction de protection qui a servi à introduire les
groupes benzyle
Bn et p-méthoxybenzyle PMB présents dans le pentanal 6. Détailler le mécanisme
de
formation du composé protégé noté R1OPMB à partir de l'alcool correspondant
R1OH en
précisant les réactifs utilisés. Sachant que par addition d'un nucléophile
l'atome de silicium
peut accommoder 5 liaisons, proposer un mécanisme traduisant la formation de
ROSiR'3 à
partir de l'alcool ROH comme indiqué dans le document 1.
La 2-méthyl-4H-pyran-4-one 5 peut être métallée par action d'une base forte non
nucléophile
comme le bis(triméthylsilyl)amidure de lithium LiN(Si(CH3)3)2 dans le THF à 78
°C.
8Identifier les protons de 5 possédant un caractère acide en justifiant cette
propriété, puis
donner le mécanisme conduisant à la formation de l'énolate de lithium qui
résulte de l'action
de l'amidure sur la pyrone 5.
9Donner la structure du (des) autre(s) composé(s) qui pourrai(en)t se former si
une base
comme le butyllithium BuLi était utilisée à la place de LiN(Si(CH3)3)2 .
La pyrone métallée réagit avec l'aldéhyde 6 pour fournir après hydrolyse, un
mélange
équimoléculaire de deux alcools stéréoisomères, noté 7.
10- Expliciter le mécanisme de cette réaction, puis donner la structure
topologique des
composants du mélange 7, en précisant si les alcools obtenus sont énantiomères
ou
diastéréoisomères.
Le mélange 7 est séparé, l'alcool conservé pour la suite étant celui dont le
descripteur
stéréochimique du centre stéréogène juste créé est R. Cet alcool est mis en
réaction avec du
Page 5 sur 19
A 2018 Chimie PC
chlorure de tert-butyldiméthylsilyle (t-BuMe2SiCl, noté TBSCl) en présence
d'imidazole dans
un solvant aprotique polaire à température ambiante pendant 18 h. Après un
traitement
approprié, le composé 8 est obtenu avec un rendement de 90 %.
11- En s'aidant du document 1, proposer une structure pour le produit 8 et pour
le sel formé
simultanément au cours de la réaction décrite ci-dessus. Justifier sa durée de
18 h.
La mise en réaction du composé 8 avec la
2,3-dichloro-5,6-dicyano-1,4-benzoquinone, notée
DDQ, en milieu diphasique H2O-CH2Cl2 tamponné à pH 7, permet de retirer le
groupement
protecteur PMB dans des conditions douces, conduisant ainsi à la molécule 9
(ci-dessous,
sans stéréochimie).
Cl
Cl
O
Cl
O
NC
CN
DDQ
HO
O
Cl
OH
BnO
NC
CN
2,3-dichloro-5,6-dicyanohydroquinone
OH OTBS
O
9
12- Établir l'équation de cette réaction d'oxydo-réduction sachant qu'il se
forme également
de la 2,3-dichloro-5,6-dicyanohydroquinone, et qu'au cours de cette
transformation une
fonction éther-oxyde benzylique du groupe PMB de 8 est transformée en une
fonction
hémiacétal. Donner ensuite la structure de 9, en précisant la stéréochimie, qui
résulte de
l'hydrolyse de cet hémiacétal.
13- Préciser parmi les réactifs lequel joue le rôle d'oxydant, et lequel joue
le rôle de
réducteur. Commenter l'utilisation de la DDQ plutôt que le passage par une
réaction
d'hydrogénation pour se défaire de la protection.
Agité dans le benzène en présence d'acide trifluoroéthanoïque
(CF3COOH, de pKa égal à 0,3) pendant 4 jours, le composé 9 BnO
conduit avec un taux de conversion de 50 % très majoritairement
à la spiroénone 10 représentée en perspective ci-contre.
H
O
H
O
TBSO
O
10
14- Donner le nom de la fonction chimique nouvellement créée au niveau de
l'atome de
carbone spirannique du produit 10. Rappeler dans le cas général quelles
conditions
opératoires et quels composés sont utilisés pour obtenir cette fonction à
partir d'une molécule
contenant un groupement carbonylé type cétone ou aldéhyde.
15- Indiquer les sites de protonation possibles du cycle pyrone de la molécule
9 en
expliquant lequel est le plus probable. Déduire un mécanisme plausible pour la
formation de
la spiroénone 10.
16- Indiquer en justifiant si la réaction de cyclisation décrite ci-dessus se
fait sous contrôle
cinétique ou thermodynamique. Indiquer la structure du produit 10',
stéréoisomère de 10, qui
Page 6 sur 19
A 2018 Chimie PC
peut aussi se former dans ces conditions, et proposer une explication au fait
qu'il soit
minoritaire en utilisant les données de l'analyse conformationnelle de la
deuxième partie.
17- Proposer un protocole simple permettant d'augmenter la quantité de
spiroénone 10
disponible pour la suite de la synthèse.
Du bromure de vinylmagnésium (CH2=CHMgBr) est mis en réaction avec le spiranne
10 en
présence d'iodure cuivreux CuI dans le THF. Le produit résultant, après
hydrolyse du milieu
réactionnel puis extraction, correspond à la structure 11 ci-après, dans
laquelle seuls
certains atomes d'hydrogène (atomes clairs) sont représentés. Les atomes
d'oxygène sont en
foncé et ceux de carbone et de silicium en gris.
Figure 2: représentation du produit 11
18- En utilisant la vue fournie ci-dessus, donner en représentation de Cram la
structure du
produit 11 qui est formé majoritairement à partir de la spiroénone 10.
19- En s'appuyant sur les résultats présentés sur la figure 3 suivante pour une
molécule
utilisée comme modèle de la spiroénone 10, indiquer si la précédente attaque
nucléophile a
lieu sous contrôle orbitalaire, ou sous contrôle de charges. Préciser la
structure du (des)
produit(s) qui aurai(en)t pu être obtenu(s) en l'absence de sel de cuivre.
H(0.226)
O(-0.490)
O(-0.565)
H(0.331)
C(-0.576)
H(0.192)
C(0.623)
C(0.645)
H(0.206)
C(-0.597)
H(0.190)
H(0.189)
C(-0.571)
O(-0.465)
H(0.216)
C(0.291)
H(0.155)
Figure 3 : charges partielles (à gauche) et représentation de la plus basse
orbitale vacante (à droite) pour la
2hydroxy-2-méthyl-2,3-dihydro-4H-pyran-4-one modélisant le composé 10. Ces
résultats proviennent de calculs
analogues à ceux réalisés avec le logiciel Orbimol.
Page 7 sur 19
A 2018 Chimie PC
La mise en place des deux fonctions hydroxyles protégées présentes dans la
molécule cible 4
en positions 5 et 9 (cf. schéma 1) avec les groupes protecteurs adéquats est
réalisée grâce aux
étapes résumées sur le schéma 4.
11
KH, BnBr
12
THF, 76 % obtenu THF, 98 %
pur
L-Sélectride
n-Bu4NF
?
14
13
4
(TBAF)
Schéma 4 : fin de la synthèse du spiranne 4
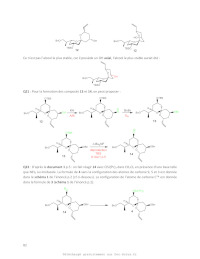
Dans la séquence du schéma 4, le composé 11 est d'abord soumis à l'attaque du
tri-secbutylborohydrure de lithium de formule semi-développée
Li[CH(CH3)CH2CH3]3BH (LSélectride®), pour conduire de manière complètement
sélective après hydrolyse au produit 12.
20- Par analogie avec l'attaque du tétrahydroaluminate de lithium (LiAlH4) sur
un groupe
carbonylé, proposer un schéma simplifié qui illustre le mode d'attaque du
L-Sélectride® sur la
cétone 11 et permet d'expliquer l'obtention d'un composé unique. Donner la
structure de 12
et indiquer s'il correspond à l'alcool le plus stable. Il peut être utile
d'utiliser une
conformation représentée sur le schéma 3.
21- Donner les structures en représentation de Cram des composés 13 et 14, en
expliquant
succinctement les réactions qui ont permis de les obtenir.
22- Proposer des conditions de réaction solvant et réactifs pour former le
spiranne 4 à
partir du composé 14. Donner la structure topologique complète du spiranne 4.
Le fragment C1-C13 recherché est obtenu dans une ultime étape décrite par les
auteurs de la
publication de la manière suivante : « Une fois le composé 14 protégé pour
conduire au
spiranne 4, il ne reste plus qu'à finaliser l'obtention du centre stéréogène du
carbone 7. Pour
cela, l'ouverture réductrice contrôlée par la chélation du dérivé spirannique a
été étudiée. La
réaction du spiranne 4 avec un équivalent de triéthylsilane SiH(CH2CH3)3,
source d'hydrure,
en présence de chlorure d'aluminium AlCl3 à 78 °C dans le dichlorométhane a
permis
d'obtenir le tétrahydropyrane cis-2,6-disubstitué 3 sous forme d'un seul
isomère détectable,
avec un rendement de 73 %. La chélation du centre métallique avec les atomes
d'oxygène du
benzyle en C13 et du carbone C11 permet l'activation sélective de la liaison
entre l'atome
d'oxygène en C11 et l'atome de carbone anomère. La réduction ultérieure du
cation
oxacarbénium formé procède par approche axiale de l'hydrure pour aboutir au
tétrahydropyrane 3. »
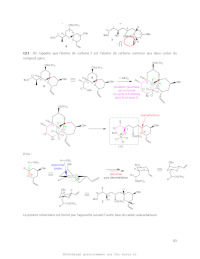
23- À la lumière de la description faite par les auteurs, expliquer le rôle de
tous les réactifs
utilisés pour effectuer la mise en place du centre stéréogène du
tétrahydropyrane 3, en
particulier la chélation et l'approche axiale. Préciser la nature de la
réaction dont il s'agit, puis
indiquer la structure du produit minoritaire qui aurait aussi pu se former au
cours de cette
étape.
Page 8 sur 19
A 2018 Chimie PC
24- Proposer une série de transformations permettant d'introduire la fonction
acide
carboxylique en position 1 du tétrahydropyrane 3 (cf. schéma 1), en donnant les
conditions
expérimentales utilisées pour chaque étape.
Synthèse et caractérisation de la pyrone de départ
La pyrone de départ 5 n'est pas un composé naturel, et les auteurs ont choisi
de la préparer
de manière fort astucieuse à partir de l'acide de Meldrum, obtenu facilement
par chauffage
d'un mélange de propanone, d'acide malonique (HO2CCH2CO2H) et d'anhydride
éthanoïque
en milieu acide. Le schéma réactionnel utilisé pour préparer le composé 5 est
le suivant :
O
OH O
O
O
O
CH 3COCl
pyridine
acide de Meldrum
OH O
O
O
O
O
toluène, 85 °C
On-Bu
16
THF, H 2O
O
O
17
On-Bu
APTS, reflux
O
5, rendement
global : 60 %
Le composé 16 obtenu aisément par acylation de l'acide de Meldrum est
transformé en composé 17 par une réaction qui se produit en deux étapes à O
85 °C. Il se forme intermédiairement le composé 16' représenté ci-contre H O
qui est converti in situ en la molécule 17 (n-Bu correspond à CH3(CH2)3).
O
C
16'
O
25- Donner le nom de la réaction qui s'apparente à la cyclisation qui a lieu
lors du
chauffage de l'intermédiaire 16' avec le butoxyéthène pour former la molécule
17. Ecrire les
étapes permettant de retrouver la structure de 17 en partant de ce même
intermédiaire 16'.
26- Proposer un mécanisme acido-catalysé plausible en plusieurs étapes
expliquant la
transformation du composé 17 en la pyrone recherchée 5. On indique qu'il se
forme
également du n-BuOH et un produit gazeux que l'on précisera.
Le spectre RMN proton de la pyrone 5 enregistré à 250 MHz dans le chloroforme
deutéré
montre les déplacements chimiques ( en ppm) et les couplages (en Hz) suivants :
2,27 (3 H, J = 1,75) ; 6,15 (1 H, J = 1,75) ; 6,27 (1 H, J = 6) ; 7,68 (1 H, J
= 6), tous les pics
apparaissant sous forme de doublets.
Dans son spectre infra-rouge, ont été notamment relevées les bandes
d'absorption de
nombres d'onde (en cm1) : 3007 (intensité moyenne), 1667 (intensité forte), et
1615 (intensité
moyenne).
27- En interprétant toutes les données spectroscopiques enregistrées pour la
pyrone 5,
montrer que la structure proposée est adéquate. Une table de nombres d'onde des
vibrations de
valence et de déformation est disponible en annexe.
Page 9 sur 19
A 2018 Chimie PC
l'iodure d'argent
L'iodure d'argent fut autrefois utilisé en photographie et de nos jours il sert
à l'occasion de
déclencheur de pluie par projection dans les nuages. Mais ce sont surtout les
excellentes
propriétés de conduction ionique d'une de ses phases, malheureusement instable à
température et pression ambiantes, qui ont attiré l'attention de la communauté
scientifique
depuis des décennies.
Après quelques généralités sur la précipitation de l'iodure d'argent, le
problème s'attarde sur
cette phase superionique et les stratégies pour la stabiliser à température
ambiante.
28- En expliquant la démarche, donner la configuration électronique de l'ion
Ag+ sachant
qu'il n'a pas de couches électroniques remplies partiellement.
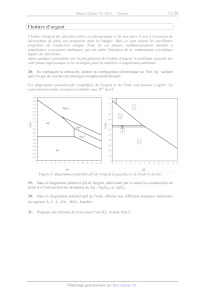
Les diagrammes potentiel-pH (simplifiés) de l'argent et de l'iode sont fournis
ci-après. La
concentration totale en espèces solubles vaut 10-2 mol/L.
$#+"
$#%"
,"
$#*"
$#$"
$#)"
)*,-.&
$#("
!"
$"
$#'"
!#,"
$#&"
-"
!#+"
$#$"
)*+&
$"
%&'()"
!"#$%&
$#%"
)*-&
!#,"
!#*"
!#)"
#"
!#+"
!#("
)*,-&
!#*"
!#)"
!#'"
$"
!#("
!#&"
!#'"
)*&
!#&"
!#%"
!#%"
!#$"
!#$"
!"
!"
!"
$"
%"
&"
'"
("
)"
*"
+"
,"
$!"
$$"
$%"
$&"
$'"
!"
$"
%"
&"
'"
("
)"
*"
+"
,"
$!"
$$"
$%"
$&"
*+"
'(&
Figure 4: diagrammes potentiel-pH de l'argent (à gauche) et de l'iode (à droite)
29- Dans le diagramme potentiel-pH de l'argent, déterminer par le calcul les
coordonnées du
point A à l'intersection des domaines de Ag+, Ag2O3(s) et AgO(s).
30- Dans le diagramme potentiel-pH de l'iode, affecter aux différents domaines
numérotés
- les espèces: I2, I , I3 , IO3 , HIO3. Justifier.
31-
-
-
Proposer une formule de Lewis pour l'ion IO3 et pour l'ion I3 .
Page 10 sur 19
$'"
A 2018 Chimie PC
On ajoute une solution de nitrate d'argent en excès dans une solution de diiode
I2(aq).
32- Qu'observe-t-on lors de l'ajout de nitrate d'argent ? Indiquer les
réactions impliquées et
évaluer la constante de la réaction bilan à pH=3.
Nous allons à présent considérer la précipitation de AgI à des fins de dosage
d'une solution
d'iodure I dont la concentration est proche de 10-2 mol/L. On négligera tout
effet de dilution
lors de l'ajout de la solution d'argent (supposée beaucoup plus concentrée que
la solution
d'iodure) et on notera a la concentration en iodure et x la concentration
virtuelle en Ag+
ajouté, autrement dit la concentration qui serait observée s'il n'y avait pas
de précipitation,
correspondant donc à la quantité d'argent ajoutée divisée par le volume dosé.
33- Justifier qu'il n'y a pas de réactions d'oxydo-réduction en compétition
avec la
précipitation. Montrer qu'on peut estimer que la précipitation de AgI commence
dès la
première goutte de la solution de nitrate d'argent versée (volume d'une goutte:
environ 0,05
mL). Quelle est la valeur de x (notée x1) en fin de précipitation ?
34- Exprimer la concentration réelle c en ions Ag+ en fonction de x dans les
domaines xx1.
35- Proposer un montage permettant de mesurer la concentration en ions Ag+ en
solution à
l'aide d'une électrode qu'on précisera.
36- Représenter schématiquement l'évolution du signal mesuré par l'électrode
précédente en
fonction de x, on expliquera comment le signal obtenu permet de doser les ions
I .
37- Dans le cas a=10-2 mol/L, calculer le potentiel de l'électrode pour x=x1,
x=0,99x1 et
x=1,01x1. Conclure quant à la sensibilité du dosage.
38- Est-il possible par cette méthode de doser séparément les ions iodure et
bromure ?
Justifier.
L'iodure d'argent AgI se présente à température ambiante sous deux formes: une
phase
cubique de type zinc-blende (phase ) et une phase hexagonale de type würtzite
(phase )
-
dont nous ferons abstraction pour simplifier le problème. Au-dessus de 147°C,
les ions I
forment une structure cubique centrée tandis que les ions Ag+ sont relativement
délocalisés.
Cette dernière phase nommée est particulièrement intéressante car elle
présente une forte
conductivité (de l'ordre de 1 Ohm-1cm-1) liée à la mobilité des ions Ag+ dans
le réseau.
Page 11 sur 19
A 2018 Chimie PC
Figure 5: structure de -AgI: les ions Ag+ (en blanc) forment un réseau cubique
à faces
centrées, les ions I (en noir) occupent un site tétraédrique sur deux.
39- Calculer la distance Ag-I dans la phase . Conclure quant au caractère
ionique ou
covalent de la liaison Ag-I dans cette structure.
40-
Vérifier la validité du modèle ionique pour la phase .
-
Figure 6: structure de -AgI où seuls les ions I sont représentés, les ions Ag+
étant
délocalisés.
41- Reproduire et compléter la structure de la phase (figure 6) de sorte à
faire apparaître
un site tétraédrique interstitiel. Evaluer la distance moyenne Ag-I dans la
phase en
supposant que les ions Ag+ occupent le plus souvent des sites tétraédriques
interstitiels. Ce
résultat permet-il de comprendre la forte mobilité des ions Ag+ dans le réseau
? Justifier.
De nombreuses recherches ont cherché à stabiliser la phase de AgI à la
température
ambiante. Nous allons voir différentes stratégies.
Une première possibilité consiste à augmenter la pression.
Page 12 sur 19
A 2018 Chimie PC
42-
Calculer les volumes molaires Vm, et Vm, des phases et .
43- En écrivant l'égalité des potentiels chimiques à l'équilibre et en
considérant un
déplacement élémentaire sur la courbe d'équilibre entre les deux phases
considérées, montrer
que la condition d'équilibre (à une pression P et une température T) entre les
deux phases peut
s'écrire, avec Sm entropie molaire des phases correspondantes:
Vm,dP - Sm,dT= Vm,dP - Sm,dT
44- A l'équilibre, quelle est la relation entre la différence des entropies
molaires de chaque
phase et l'enthalpie de la transformation de la phase en phase ?
A pression atmosphérique et à =147°C, la transformation de phase en phase
absorbe
une quantité de chaleur Q de 6,7 kJ/mol.
45- A l'aide des relations des questions précédentes, évaluer la pression à
partir de laquelle
la phase est stable à température ambiante. On expliquera la démarche et les
approximations éventuelles.
Une deuxième possibilité est de synthétiser à chaud des petits cristaux de
phase dans des
matrices de type verre puis de refroidir.
46- Expliquer succinctement pourquoi la recristallisation de la phase en phase
plus stable
est inhibée par cette méthode.
Une troisième possibilité est de limiter les dimensions des cristaux à
l'échelle nanométrique.
On admet que le coût énergétique pour créer une surface A (en m2) peut s'écrire
Esurf=A,
avec tension de surface (en J.m-2) qu'on supposera constante pour une phase
donnée. On
assimilera les cristaux à des sphères ayant une tension de surface uniforme.
47- Donner l'expression du coût énergétique Esurf lors de la formation d'une
particule
sphérique de rayon r.
48- En admettant que ce terme d'énergie surfacique constitue un terme
supplémentaire dans
l'expression des enthalpies libres de formation, montrer que l'enthalpie libre
standard de
formation d'iodure d'argent d'une phase donnée sous la forme d'une population
de cristaux
sphériques de rayon r peut s'écrire (à une température T):
!!! !!!!
!!
avec Vm volume molaire de la phase considérée, le symbole ! faisant référence
au cristal
supposé infini et donc aux grandeurs thermodynamiques des tables habituelles.
!
!
!! !!! ! !!!!
!! !!! !
!!!!
On considère le changement de phase d'une population de nanocristaux
identiques, chaque
nanocristal conservant sa quantité de matière.
Page 13 sur 19
A 2018 Chimie PC
49- Exprimer à une température T la différence d'enthalpie libre entre un
système constitué
de nanocristaux de phase et un système de nanocristaux de phase en fonction
des
!
grandeurs thermodynamiques !!!!
!! !!! pour le cristal infini et des tensions de surface,
volumes molaires et rayons respectifs (qu'on notera avec l'indice de la phase
correspondante).
En écrivant que les volumes molaires des phases et sont reliés par
l'expression:
!!!! ! !!!! !! ! !!, donner alors la condition reliant et les tensions de
surface pour que le
changement de phase soit déplacé vers les basses températures avec des
nanocristaux.
Enfin, une possibilité de compromis est offerte par certaines solutions solides
qui permettent,
au prix d'une baisse de conductivité ionique par rapport à -AgI pur, de
conserver la
structure de type à température ambiante.
Par exemple Ag3SI ayant une très bonne conductivité ionique et une très faible
conductivité
électronique peut être utilisé comme électrolyte solide. Nous considérons ici
la pile
Ag/Ag3SI/I2. L'équation bilan s'écrit:
Ag(s) +1/2 I2(g) = AgI(s)
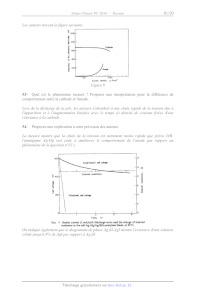
Le schéma ci-après montre le premier prototype de cette pile d'après T.
Takahashi et O.
Yamamoto, Electrochimica Acta, 1966, Vol.11, pp 779-789. On rappelle que l'iode
solide se
sublime, il est dans le dispositif en équilibre avec sa vapeur.
Figure 7: prototype de la pile Ag/Ag3SI/I2.
50- Proposer un schéma de cette pile en fonctionnement, on indiquera les
demi-équations
aux électrodes et les mouvements de charges.
51-
Calculer la tension à vide de la pile à 25°C.
52- Comment peut-on expérimentalement vérifier de façon simple que la
conductivité
électronique de Ag3SI est très faible par rapport à sa conductivité ionique ?
Page 14 sur 19
A 2018 Chimie PC
Les auteurs tracent la figure suivante:
Figure 8
53- Quel est le phénomène mesuré ? Proposer une interprétation pour la
différence de
comportement entre la cathode et l'anode.
Lors de la décharge de la pile, les auteurs s'attendent à une chute rapide de
la tension due à
l'apparition et à l'augmentation linéaire avec le temps (à densité de courant
fixée) d'une
résistance à la cathode.
54-
Proposez une explication à cette prévision des auteurs.
La mesure montre que la chute de la tension est nettement moins rapide que
prévu (NB:
l'amalgame Ag-Hg sert juste à améliorer le comportement de l'anode par rapport
au
phénomène de la question n°53 ).
!
On indique également que le diagramme de phase Ag3SI-AgI montre l'existence
d'une solution
solide jusqu'à 8% de AgI par rapport à Ag3SI.
Page 15 sur 19
A 2018 Chimie PC
55- Proposez une explication au fait que la chute de tension expérimentale soit
beaucoup
plus faible que celle prévue dans la question précédente.
56- Quels sont les avantages et les inconvénients de chacune des 4 stratégies
précédentes
(application de pression, dispersion de particules dans une matrice de type
verre, utilisation de
nanoparticules et solutions solides) pour les applications visant à exploiter
la conductivité
ionique de l'iodure d'argent ?
Fin de l'énoncé
Page 16 sur 19
A 2018 Chimie PC
Données:
table de nombre d'ondes de vibrations de valence et de déformation:
"#$
(1)
tétr = tétragonal ; trig = trigonal ; dig = digonal
F = fort ; m = moyen ; f = faible
(3)
Abaissement de 20 à 30 cm1 si conjugaison
(2)
Page 17 sur 19
A 2018 Chimie PC
Constante d'Avogadro : NA= 6,0.1023 mol-1
Constante des gaz parfaits :R= 8,3 J.K-1.mol-1
RT
ln10 = 0,06V
Constante de Nernst à 298 K :
F
Constante de Faraday : 96500 C.mol-1
Numéros atomiques : Z(Ag)= 47, Z(I)=53
Masses molaires en g.mol-1 : Ag: 108; I:127
Masses volumiques: -AgI: 5710 kg.m-3
paramètre de maille de -AgI: a=504pm
rayons ionique et covalent:
r(Ag+)=100 pm; r(Ag)=145pm
r(I )= 216 pm; r(I)=139pm
Produit ionique de l'eau à 298 K: Ke = 10-14
Produits de solubilité:
pKs(AgI)= 16,1; pKs(AgBr)=12,3; pKs(AgIO3)= 7,5
Données thermodynamiques dans l'état standard à 298K:
composé
fH°/kJ.mol-1
fG°/kJ.mol-1
-61,8
-66,2
-AgI(s)
I2(s)
0
0
I2(g)
62
19
Ag(s)
0
0
S°/J.mol-1.K-1
115
116
261
42
Potentiels standard par rapport à l'électrode standard à hydrogène, à 25°C et
pH = 0, en Volt:
E°(Ag+/Ag)= 0,80 V; E°(Ag2O3/AgO)= 1,57 V; E°(AgO/Ag2O)=1,40 V;
E°(Ag2O/Ag)= 1,17 V; E°(AgO/Ag+)=1,77 V; E°(I2(aq)/I-)=0,62 V
Page 18 sur 19
A 2018 Chimie PC
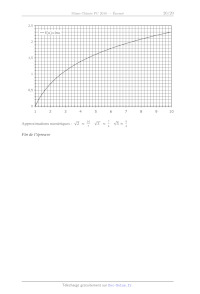
2,5
f(x)=lnx
2
1,5
1
0,5
0
1
2
3
Approximations numériques :
4
!!!!
5
!"
!
6
!
!! ! ! ! !
Fin de l'épreuve
Page 19 sur 19
7
!
! !!!
8
9
10