Mines Chimie PC 2021
| Thème de l'épreuve | Le zoapatanol. Le zinc: de l'ion en solution au matériau. |
| Principaux outils utilisés | chimie organique, solutions aqueuses, diagramme E-pH, oxydoréduction, cinétique chimique, orbitales moléculaires, cristallographie, thermodynamique, mélange binaire |
| Mots clefs | zoapatanol, zinc, oxyde de zinc, électrodéposition, couche mince |
Corrigé
:👈 gratuite pour tous les corrigés si tu crées un compte
👈 l'accès aux indications de tous les corrigés ne coûte que 1 € ⬅ clique ici
👈 gratuite pour tous les corrigés si tu crées un compte
- - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - -
👈 gratuite pour ce corrigé si tu crées un compte
- - - - - - - - - - - - - - - - - - - - - - - - -
Énoncé complet
(télécharger le PDF)













Rapport du jury
(télécharger le PDF)



Énoncé obtenu par reconnaissance optique des caractères
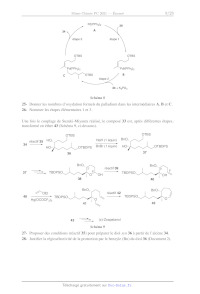
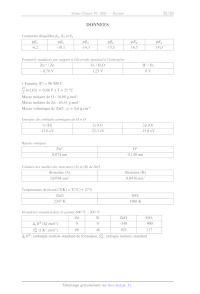
A2021 --- CHIMIE PC Cm Concours commun Mines-Ponts ÉCOLE DES PONTS PARISTECH, ISAE-SUPAERO, ENSTA PARIS, TÉLÉCOM PARIS, MINES PARIS, MINES SAINT-ÉTIENNE, MINES NANCY, IMT ATLANTIQUE, ENSAE PARIS, CHIMIE PARISTECH - PSL. Concours Mines-Télécom, Concours Centrale-Supélec (Cycle International). CONCOURS 2021 ÉPREUVE DE CHIMIE Durée de l'épreuve : 4 heures L'usage de la calculatrice et de tout dispositif électronique est interdit. Les candidats sont priés de mentionner de façon apparente sur la première page de la copie : CHIMIE - PC L'énoncé de cette épreuve comporte 22 pages de texte. Si, au cours de l'épreuve, un candidat repère ce qui lui semble être une erreur d'énontcé, il le signale sur sa copie et poursuit sa composition en expliquant les raisons des initiatives qu'il est amené à prendre. Les sujets sont la propriété du GIP CCMEP. Ils sont publiés sous les termes de la licence Creative Commons Attribution - Pas d'Utilisation Commerciale - Pas de Modification 3.0 France. Tout autre usage est soumis à une autorisation préalable du Concours commun Mines Ponts. Cette épreuve est constituée de deux parties indépendantes en pages I et 10. Le candidat est libre de les traiter dans l'ordre qu'il le souhaite. Pour l'écriture des mécanismes, le candidat pourra utiliser des notations simplifiées des molécules, lui permettant de se concentrer sur les groupes caractéristiques interagissant. Des données utiles à la résolution du problème sont fournies à la fin de l'énoncé en pages 9 pour la première partie et 21 et 22 pour la deuxième. Le Zoapatanol Le (+)-zoapatanol est un oxépane diterpénoïde isolé des feuilles de la plante mexicaine zoapatle (Montanoa tomentosa), que les femmes mexicaines utilisent depuis des siècles en décoction pour provoquer les règles, faciliter l'accouchement ou mettre fin à une grossesse précoce. Des études récentes confirment que le zoapatanol et ses métabolites pourraient être responsables de l'activité antifertile observée. En 1979, l'isolement et la structure (ci-dessous) du (+)-zoapatanol ont été décrits. (+)-Zoapatanol En raison de son profil biologique et de sa structure complexe, plusieurs approches synthétiques ont été envisagées pour sa préparation. Au total, sept synthèses du zoapatanol ont été publiées parmi lesquelles deux sont énantiosélectives. La première partie de ce problème se focalise sur une synthèse racémique décrite par l'équipe de R. Chen.! La deuxième partie aborde une synthèse plus récente, également racémique, décrite par l'équipe de J. Cossy? Questions préliminaires 1- Donner la configuration absolue des centres stéréogènes 2' et 3° du (+)-zoapatanol en justifiant votre réponse. Le spectre de résonance magnétique nucléaire du proton (RMN 'H) à 300 MHz dans le chloroforme deutéré (CDCL,) du (+)-zoapatanol comporte, entre autres, les signaux suivants : G(ppm) Intégration Multiplicité : S (ppm) Intégration Multiplicité 5,30 1 t, J = 7.0 Hz 3,16 2 d, J = 7,0 Hz 5 47 l t, J = 7,0 Hz 1,73 3 S 4,20 2 d, °J = 7,0 Hz 1,63 3 S 2- Attribuer les différents signaux du tableau à un ou des atomes d'hydrogène caractéristiques du (+)-zoapatanol en justifiant les multiplicités observées (voir les données RMN en page 9). ! Chen, R.; Rowand, D. A. J. Am. Chem. Soc. 1980, 102, 6609-6611. 2 Taillier, C.; Gille, B.; Bellosta, V.; Cossy, J., J. Org. Chem. 2005, 70, 2097-2108. Synthèse de R. Chen (1980) La première synthèse totale du (+)-zoapatanol, décrite par l'équipe de R. Chen, nécessite de préparer à la fois l'époxy-diol 1 et le bromure aliphatique 2, comme le suggère le plan rétrosynthétique du Schéma 1. Une fois ces deux précurseurs obtenus, ils sont assemblés, puis quelques transformations supplémentaires permettent d'aboutir à la molécule de (+)- zoapatanol. OH TO. _K OH rHPo._ XL O7 3 1' * 6 Br 1 2 Schéma 1 (+)-Zoapatanol L'époxy-diol 1 a été préparé à partir du myrcène, un monoterpène naturel, selon la séquence du Schéma 2. KL 22/0107 eLek réactif 4 eh k Br = Br2 (1 équiv) | Br KOAc (10 équiv) TsCI (1,1 équiv) > 7 > 8 CH;Cb, O°C OO 6 acétone, reflux EN (1,1 équiv) HO 8 K2COs TsO OH H,0/MeOH O J Schéma 2 3- Proposer un réactif 4 permettant la formation de l'époxy-alcool 5 à partir de l'alcool allylique 3. Justifier la régiosélectivité observée lors de cette réaction. Montrer qu'il s'agit d'une réaction d'oxydation. 4- A l'aide du Document Î, en page 3, proposer un mécanisme justifiant la formation du composé dibromé 6 à partir de l'époxy-alcool 5 (la stéréochimie de la double liaison du composé dibromé ne sera pas discutée). Pourquoi est-1l important de n'utiliser qu'un équivalent de dibrome dans cette réaction ? 5- Donner la structure du composé 7 obtenu par traitement du dibromé 6 par un excès d'éthanoate de potassium (KOAc soit KOC(=0)CH:). 6- Donner la structure du composé 8 obtenu par traitement du composé 7 par du chlorure de tosyle (TsCT) en présence de triéthylamine. Quel est l'intérêt de cette étape ? En raisonnant par analogie avec la réaction d'un alcool et d'un chlorure d'acide, proposer un mécanisme pour cette réaction. 7- Quel type de réaction a lieu lors de la formation de l'époxy-diol 1 à partir du composé 8 ? Proposer un mécanisme pour cette réaction. Document I : Bromation des alcènes La réaction de bromation des alcènes permet d'accéder à des alcanes 1,2-dibromés (ces derniers pouvant, entre autres, être utilisés pour la formation d'alcynes). La réaction s'effectue par traitement d'un alcène par du dibrome, dans un solvant inerte et à l'abri de la lumière pour éviter des réactions radicalaires parasites. RS Te, is D'un point de vue mécanistique, il y a, dans une première étape, formation d'un 1on bromonium ponté, issu de l'attaque de la double liaison sur le dibrome. Il s'ensuit une attaque nucléophile du bromure formé (Br) sur l'ion bromonium via un mécanisme Sx2. ... fe .©O SN2 a 8 (Br: ------ Do : Br: UN, De NY Le bromure aliphatique 2, dont la fonction alcool est protégée par un groupement tétrahydropyrane (THP), a été synthétisé à partir du bromure allylique 9 (Schéma 3). O () 1) Mg, EtO (DHP) SRB & THPO S © 2) HC=0 APTS 8) hydrolyse 10 11 1) réactif 12 OH réactif 15 15 6 Br gjréacurs PO TT OT 2 OO R R-OTHP = Schéma 3 8- Le traitement du bromure allylique 9 par du magnésium, suivi de l'addition de méthanal (H,C=0O) conduit après hydrolyse à la formation de l'alcool 10. A l'aide d'un modèle approprié, expliquer la formation de l'alcoo!l 10 à partir du bromure allylique 9. 9- Proposer un mécanisme réactionnel pour la protection de l'alcool 10 en présence de dihydropyrane (DHP) et d'acide 4-toluènesulfonique (APTS). Justifier la régiosélectivité de la réaction. 10- En deux étapes, l'alcène 11 est transformé en alcool primaire 14. Indiquer les conditions réactionnelles pour ces deux réactions : réactif 12 et réactif 13. 11- Le dérivé bromé attendu 2 est finalement obtenu par traitement de l'alcool 14 par un réactif approprié. Proposer des conditions réactionnelles pour effectuer cette réaction (réactif 15). Quel autre produit peut être formé lors de cette étape ? Dans la suite de la synthèse les fragments 1 et 2 sont assemblés, puis après quelques fonctionnalisations, le cycle à 7 chaînons est créé pour finalement conduire au (+)-zoapatanol (Schéma À). Mg 1 (0,3 équiv) no | THPOT Br 16 -- THPO OH Et,O Li)CuCI, cat. O 2 puis 17 hydrolyse Y 1) CF3CO-H (0,1 équiv) AcO». OAc CH,Cl, 0°C -- 2) AC:O, Pyridine = 18 OAc KR ÈS L; (excès) réactif 20 Ho > (+)-Zoapatanol THE, Et,O puis hydrolyse THE : tétrahydrofurane. Schéma 4 12- Donner la structure du composé 16 et indiquer les principales conditions à respecter (en les justifiant) pour réaliser sa préparation avec succès. 13- Dans la formation de l'époxy-diol 17, pourquoi est-1l nécessaire d'utiliser un excès de composé 16 ! Proposer une alternative qui aurait pu permettre d'éviter l'utilisation d'un tel excès. 14- L'époxy-diol 17 est ensuite cyclisé en présence d'une quantité catalytique d'acide 2,2,2- trifluoroéthanoïque (CF;CO:H). Quel est le rôle de cet acide ? Comparer son pK\ à celui de l'acide éthanoïque (CH:;CO:H). Justifier votre réponse. 15- A côté du produit attendu 18 se forme un autre composé cyclique à six chaînons, 19. Proposer une structure pour ce composé (on ne s'intéressera pas à la stéréochimie du composé 19). Proposer une méthode pour séparer les composés 18 et 19. 16- Sachant que le groupement THPO se déprotège facilement en milieu acide aqueux , proposer des conditions réactionnelles (réactif 20) pour préparer le précurseur 21 directement à partir du composé 18. 17- Lors de la dernière étape qui aboutit à la formation du zoapatanol, les auteurs utilisent un excès d'organolithien (dont la réactivité est proche de celle de l'organomagnésien correspondant). Proposer une explication. Synthèse de J. Cossy (2005)? Une autre synthèse racémique du zoapatanol décrite par l'équipe de J. Cossy fait intervenir une réaction de cyclisation efficace pour la formation du cycle à sept chainons / La synthèse débute avec la préparation des deux précurseurs 26 et 32 (Schéma 5 et Schéma 6 en page 6), qui sont ensuite assemblés. 1) TBSCI, EtÿN réactif 25 po TO 24 Re SAT TE 2) réactif 23 22 26 Schéma 5 Une des fonctions alcool du diol 22 est protégée via la formation d'un éther silylé (Document 2) avec le chlorure de tert-butyldiméthylsilyle (TBSCT), puis la fonction alcool restante est mise à réagir avec le réactif 23 pour conduire au composé 24. L'analyse du composé 24 par spectroscopie infrarouge (IR) et par spectroscopie de résonance magnétique nucléaire du proton (RMN 'H) à 300 MHz dans le chloroforme deutéré (CDCL) fournit des spectres qui présentent, entre autres les caractéristiques suivantes : ° IR : bande d'absorption intense à 1730 cm''; ° RMN 'H : un triplet à 9,78 ppm intégrant pour un hydrogène dont la constante de couplage "J a pour valeur 1,8 Hz. 18- À l'aide de ces données spectroscopiques, proposer, en justifiant votre réponse, une structure pour le composé 24 (voir les données RMN et IR en page 9). Proposer un réactif (réactif 23) permettant de former le produit 24. Document 2 : Protection de la fonction alcool via la formation d'éthers Dans une synthèse, les groupements hydroxyles sont très souvent protégés. Les groupements protecteurs couramment utilisés pour réaliser ces protections sont les éthers de benzyle (R-- OBn) et/ou les éthers silylés (R-OS1R'R°R>). Les conditions correspondant à leur formation via des réactions de substitution, ainsi que celles de leur déprotection, sont décrites ci- dessous. CT * rK ) Pd/C cat. R-O ------ R-OH H NaH _ R-OBn 2 éther de benzyle R! \ 1 R?-Si-CI R R2 L TT R$ Si 3 F R-OH R-O R° ---- R-0OH Et;N | Lo éther silylé Les éthers de benzyle sont facilement déprotégés par hydrogénolyse (H;, Pd/C cat.), alors que les éthers silylés sont coupés en présence d'ions fluorures. Les éthers silylés fréquemment utilisés sont ceux comportant un groupement fert-butyldiméthylsilyle (R' = Bu, R° = R*° = Me) abrégé TBS, ou un groupement fert-butyldiphénylsilyle (R' = 'Bu, R° = R° = CH) abrégé TBDPS. 19- Proposer un réactif (réactif 25) permettant la formation de l'iodure vinylique 26 à partir du composé 24. Ecrire l'équation bilan de cette réaction et en donner le nom. La synthèse du deuxième fragment (composé 31) débute par le traitement de l'acide carboxylique 27 par deux équivalents de diisopropylamidure de lithium (LDA, iPr,NLi) pour conduire à l'intermédiaire 28 (Schéma 6). LDA (2 équiv) réactif 29 LiAI4, THF 31 Le 28 + . 27 hydrolyse 30 hydrolyse TBDPSCI EtN, DME THE : tétrahydrofurane. DMF : N,N-diméthylformamide Schéma 6 20- Proposer une structure pour l'intermédiaire 28. Pourquoi utilise-t-on deux équivalents de diisopropylamidure de lithium (LDA) ? 21- Proposer un réactif (réactif 29) permettant la formation de l'acide 30 à partir de l'intermédiaire 28. 22- Proposer une structure pour le composé 31, obtenu par réaction de l'acide carboxylique 30 avec LiAÏH.. 23- A l'aide du Document 2 en page 5, proposer une structure pour le composé 32 obtenu à partir du composé 31 par traitement avec du chlorure de tert-butyldiphénylsilyle (TBDPSCI) en milieu basique. Par la suite, le composé 32 est traité par du 9-BBN pour conduire au composé 33. Ce dernier est engagé dans une réaction de couplage de Suzuki-Miyaura en présence de l'iodure vinylique 26 et d'une quantité catalytique de palladium en milieu basique (K;:PO,, Schéma 7). H B OTBS 9-BBN Pd(PPh3)4 2,5% 32 UT. 33 -- k OTBDPS 26, K3PO; (1,5 équiv) 1,4-dioxane, 85°C 34 | JON 1,4-dioxane = O O \__/ Schéma 7 24- Proposer une structure pour le composé 33. La réaction de couplage de Suzuki-Miyaura, dont l'un des auteurs a obtenu le prix Nobel de chimie en 2010, est une réaction très utilisée dans l'industrie pharmaceutique. Le mécanisme simplifié de la réaction fait intervenir trois étapes élémentaires (Schéma 8). Pd(PPh3) 26 34 A étape 3 étape 1 OTBS OTBS | | Pd(PPh3)o Pdi(PPh3)o C ST os B étape 2 33 + K3PO4 Schéma S 25- Donner les nombres d'oxydation formels du palladium dans les intermédiaires A, B et C. 26- Nommer les étapes élémentaires 1 et 3. Une fois le couplage de Suzuki-Miyaura réalisé, le composé 33 est, après différentes étapes, transformé en éther 43 (Schéma 9, ci-dessous). OTBS OTBS NaH (1 équiv) BnO,, - 2 réactif 35 HO. ------------------+- HO: oTBDPs BnBr(1 équiv) HO 36 37 BnO,. BnO,, CLÉ réactif 39 LL + TBDP KE -- 37 SO É O OH TBDPSO où à 38 40 BnO,. BnO.. ZVOEt réactif 42 / 40 > TBDPSO | K 7777 IBDPSO 41 K 43 43 Ts (+)-Zoapatanol Schéma 9 27- Proposer des conditions (réactif 35) pour préparer le diol syn 36 à partir de l'alcène 34. 28- Justifier la régiosélectivité de la protection par le benzyle (Bn) du diol 36 (Document 2). Par départ du groupe fert-butyldiméthylsilyle (TBS), oxydation de l'alcool libéré en acide carboxylique, puis semi-réduction de la lactone résultante par l'hydrure de duisobutyl- aluminium, l'alcool 37 est transformé en lactol 38 en trois étapes. 29- Quel est le nom de la fonction chimique portée par l'atome de carbone fonctionnel C4: du lactol 38 ? Cette molécule est en équilibre avec une forme minoritaire ouverte. Proposer une structure pour cette forme ouverte du lactol 38. 30- Proposer un réactif 39 permettant de former l'alcène 40 à partir de la forme ouverte précédente. Donner une synthèse en deux étapes du réactif 39. 31- Proposer un catalyseur (réactif 42) permettant d'effectuer la cyclisation de l'éther 41 en éther 43. Quel est le nom de cette réaction ? Finalement, le (+)-zoapatanol est obtenu en quelques étapes non étudiées 1c1 à partir du composé 43. DONNEES RMN 'H (gamme de déplacements chimiques) Proton Ô (ppm) 4--/ 1,524 H a 23-29 HOONT 2,3-3,1 HT 07 3,442 A 4,5-72 H \ 65-90 O X 9,0-10,5 R H IR (gamme de fréquences de vibration) Liaison v (cm!) Intensité O-H alcool 3650-3200 forte, large C=0O ester aliphatique 1750-1730 forte C=0O ester conjugué 1730-1715 forte C=0O aldéhyde aliphatique 1740-1720 forte C=0O cétone aliphatique 1725-1705 forte C=0O aldéhyde conjugué 1705-1680 forte C=O cétone conjuguée 1705-1680 forte C=C alcène 1675-1645 moyenne C=C alcène conjugué 1650-1635 moyenne PK'\ de quelques acides dans l'eau. Couple pKaA CF:CO:H/CP;:CO; -- 0,8 CH:CO:H/CH:CO; 4,8 HCO;/CO;7 10,3 EGNH'/EtN 10,8 ROH/RO° 16 (alcool primaire) 16,5 (alcool secondaire) 17 (alcool tertiaire) (Pr) NH/(GPr), N° 36 R-H/R° -- 50 + Prestsch, E.; Bühlmann, P.; Badertscher, M., Structure Determination of Organic Compounds. 4th ed.; Springer- Verlag: Berlin, Heidelberg, 2009. Le zinc : de l'ion en solution au matériau Toutes les réponses doivent être justifiées par un raisonnement ou un calcul approprié. Lorsqu'ils sont nécessaires pour répondre aux questions, les calculs numériques peuvent être effectués « à la main », parfois en s'en tenant aux ordres de grandeurs avec la précision. L'oxyde de zinc ZnO est un matériau qui connaît à l'heure actuelle un fort intérêt pour des applications potentielles en optoélectronique (électrodes transparentes, diodes électroluminescentes, etc.). Le problème porte sur la chimie du zinc en milieu aqueux avec comme applications le dépôt de couches minces de ZnO par une méthode électrochimique (partie I en page 10 et partie IT en page 15) et la réalisation de jonctions oxyde de zinc / silicium (partie III en page 15). I. Chimie du zinc en milieu aqueux L.1. Espèces en solution aqueuse Le zinc peut se présenter en solution aqueuse sous les formes solubles suivantes : In, [Zn(OH)l Zn(OH); (aq) » [Zn(OH):] 0 et [Zn(OH) On notera f, les constantes des équilibres : 2% + nOH° 2 [Zn(OH}; la) où n = 1,2,3,4. Le complexe Zn(OH), peut aussi précipiter sous forme solide Zn(OH); (s,. On notera K, la constante de l'équilibre : Zn(OH); (5 2 Zn) + 20H" 32- Donner l'expression générale d'une constante f, et son expression dans l'approximation des solutions diluées. 1.2 , (a) 4 (b) (e) © C0 © B \ PK 0 2 4 6 8 10 12 14 pH Figure 1 : Quantités relatives des différentes espèces de zinc en solution aqueuse. © D Quantités relatives en solution ©O OO O 10 33- La figure 1 représente les courbes de prédominance des espèces en solution. Indiquer pour chaque courbe l'espèce correspondante. 34- On note [Zn|- la concentration totale en zinc en solution à la limite de solubilité de Zn(OH),. Déterminer l'expression littérale de [Zn], en fonction du pH, des constantes B,,, de K, et du produit ionique de l'eau K,. La figure 2 représente la courbe log([Zn]-/co), où [Zn]- est la concentration totale en zinc en solution aqueuse et © = 1 mol.L'", en fonction du pH. log([Zn]r/Co) ù & & D + o | O | NN 4 5 6 7 8 9 10 11 12 13 14 pH Figure 2 : Logarithme de [Zn]-/co. 35- Pour quelle raison cette courbe présente-t-elle un minimum ? 36- A partir du résultat de la question 34 déterminer des approximations affines de la fonction log([Zn]r/co) = f (pH) dans un domaine de pH proche du minimum et retrouver la valeur du pH au minimum de [Zn]-. 1.2. Diagramme potentiel-pH du zinc La figure 3 montre le diagramme potentiel-pH du zinc, établi pour une concentration [Zn]r = 1072 mol.L:, à la limite de solubilité. 37- Sous quelle forme est le zinc dans le domaine D (justifier la réponse) ? 38- A l'aide des figures 1 et 2, déterminer les valeurs de pH correspondant aux frontières A-B et B-C et les formes prédominantes du zinc dans les domaines A, B et C. 39- En considérant les formes prédominantes du zinc dans les domaines À, B ou C, déterminer par le calcul les équations des droites aux frontières A-D, B-D et C-D. 40- Que représentent les droites en pointillés d, et d, sur la figure 3 ? Donner les demi- équations rédox correspondantes. 11 Fe --_-- --_ TS nn TS ._ Te TS ._ TS Te 7 7 ._ Te nn. Te ._ Fe --_ TS _-- LS _S _ 5 --_ TS . LS 5 Te TS 5 -- © O1 LS 7 _-- LS 7 -- nn. -- nn. LS 1 LL nn. _-- LS ml --_ -- | _-- Potentiel E par rapport à l'ESH (V) O | --L O1 Figure 3 : Diagramme potentiel-pH du zinc en milieu aqueux à 25 °C (les potentiels sont relatifs à l'électrode standard à hydrogène, ESH). L.3. Electrodépôt de ZnO L'oxyde de zinc, ZnO, peut être déposé sous forme de film mince sur un substrat plan par une méthode électrochimique en milieu aqueux, appelée électrodépôt (Document 3). Document 3 : Procédé d'électrodépôt de ZnO L'électrodépôt s'effectue dans une cellule électrochimique contenant un substrat plan sur lequel sera déposé le film de ZnO (typiquement une lame de verre recouverte d'une couche mince d'un matériau conducteur électrique) et constituant l'électrode de travail, une contre-électrode (de Pt ou de Zn) et une électrode de référence. La cellule contient une solution aqueuse dans laquelle on a dissous un sel de zinc, typiquement ZnCb, en concentration 1072 mol.L. A l'électrode de travail se produit une réduction du dioxygène dissous : 1 _ _ 7 O2 (aq) + H,0 + 2e -- 20H (1) Zn(OH); se dépose alors sur l'électrode de travail selon la réaction : Zn) + 2OH -- Zn(OH)265) (2) L'hydroxyde de zinc formé se déshydrate ensuite pour former ZnO selon la réaction : Zn(OH 265) > ZnO(s, + H,0 (3) Zn(OH), H,0 Zn0 Zn ae O3 jagyr HO Y k substrat es substrat + substrat Schéma simplifié du procédé d'électrodépôt de ZnO 41- Dans quelle partie du diagramme potentiel-pH (figure 3) doit-on se placer pour former Zn(OH), solide sur le substrat selon le procédé décrit dans le Document 3 ? 12 42- Quel est l'intérêt d'utiliser la réaction électrochimique (1) du Document 3 pour réaliser le dépôt d'une couche mince de ZnO sur le substrat, plutôt que d'ajuster le pH en ajoutant un acide ou une base ? 43- A l'aide des informations fournies par la figure 4, montrer que la couche mince finale déposée sur le substrat est bien constituée de ZnO et non de Zn(OH); A: ER TT 250 L - 150 & - C pente : 0,39 mg.C1 100 | J m / microg.cm * © sgh sn is hi is dis Ni dé à hi ji jo) Ô 100 200 300 400 500 600 q/ mC.cm * Figure 4 : Masse de ZnO déposée par unité de surface sur le substrat en fonction de la charge électrique par unité de surface échangée 44- Estimer l'épaisseur de la couche de ZnO formée pour une charge électrique échangée de 600 mC.cm". 45- A partir du bilan des équations (1), (2) et (3) du Document 3, établir la relation littérale entre la vitesse de formation de ZnO, exprimée en masse par unité de surface et unité de temps et la densité de courant électrique (intensité par unité de surface). 46- A l'aide de la figure 5, déterminer l'ordre de la cinétique de formation de ZnO pour des temps supérieurs à 500 s. Quelle grandeur caractéristique de la cinétique pourrait-on déterminer à partir des courbes à différentes températures des figures 5a ou 5b, pour des temps supérieurs à 500 5 ? 0 J 28°C 0?! | 5 À f 70°C x 04P É | 80°C -- -0.6L à -0.8/ (a) à 0 1000 2000 3000 4000 Time (s) # D'après A. Goux ef al., Electrochimica Acta 50, 2239-2248 (2005). 13 2 « «00 80°C : (b) À nl 400 oc = > 300 60°C - . 3 20 100 3 28°C : 0 0 1000 2000 3000 4000 Time (s) Figure 5 : (a) Densité de courant et (b) masse par unité de surface de ZnO déposé en fonction du temps lors de l'électrodépôt de ZnO à différentes températures. La concentration en O, est fixée." IT- Le complexe [Zn(OH), |?" 47- Quelles sont les orbitales de H et de O susceptibles de se combiner pour former la liaison entre H et O dans l'ion hydroxo (OH ) ? Pour l'oxygène, on se limitera aux orbitales de valence 2s et 2p. On notera z l'axe internucléaire de l'ion (OH). 48- Tracer le diagramme d'énergie des orbitales moléculaires de l'ion (OH). Ces orbitales moléculaires devront être positionnées de manière cohérente par rapport aux orbitales atomiques de H et de ©. 49- Pour chaque orbitale moléculaire, donner les orbitales atomiques qui la composent et discuter les poids relatifs des orbitales atomiques constitutives. 50- Indiquer sur ce diagramme, en le justifiant, le nombre d'électrons occupant chacune des orbitales moléculaires de l'ion (OH ). 51- Donner, en les justifiant, les configurations électroniques de l'atome de zinc Zn° et de l'ion Zn*. 52- A l'aide de la théorie VSEPR, déterminer la géométrie du complexe [Zn(OH),]*". ® D'après S. Peulon et D. Lincot, J. Electrochem. Soc. 145, 864 (1998). 14 III- L'oxyde de zinc : un matériau technologique III.1. Les variétés cristallines de ZnO L'oxyde de zinc ZnO peut se présenter sous deux formes cristallines notées (A) et (B) (figure 6) selon la pression et la température. Énssius seen arec 2eme a ee aie nome ee Ou 008 nt ' PA = Structure (A) Structure (B Éscsasssvmdiersse + Figure 6 : Mailles des structures (A) et (B) de ZnO. La maille de la structure (B) est présentée sous deux angles différents. 53- A quel type de réseau cristallin correspond la structure (A) ? 54- Sans utiliser le volume de la maille, déterminer le(s) paramètre(s) de maille de la structure (A). 55- Dans quels types de polyèdre de coordination se situent les 1ons (cations et anions) dans la structure (A) ? 56- Déterminer le nombre de cations et le nombre d'anions par maille pour les structures (A) et (B). En déduire le rapport des compacités pour les structures (A) et (B). 57- Dans le diagramme de phase pression-température de la figure 7, indiquer, en le justifiant, lesquels des domaines (1) et (2) correspondent aux structures (A) et (B). 15 o e © © +" O f oO 5 fa à dl ° = 0 '; "oO = O/ 0 (2) " | * À O = | = rs; Fo O © O TEMPERATURE Ci Figure 7 : Diagramme de phase pression-température de ZnO 6 D'après C. H. Bates er al., Science 137, 993 (1962). 16 III.2. Réalisation d'une jonction ZnO sur Silicium Document 4 : Description d'une jonction ZnO sur silicium Une jonction est un dispositif constitué de l'association de deux matériaux ayant des propriétés électriques de natures différentes. Les jonctions interviennent au coeur de nombreux composants électroniques ou optoélectroniques. Dans une jonction, au moins un des deux matériaux est déposé sous forme de couche mince (épaisseur inférieure au micromètre) sur l'autre matériau, l'interface entre les deux matériaux étant plane. Les couches minces de ZnO peuvent être déposées sur un substrat par différentes méthodes « physiques » ou « chimiques ». La technique Pulsed Electron Deposition (PED) compte parmi les méthodes physiques. Elle consiste à bombarder une cible, 1c1 de ZnO , avec un faisceau pulsé d'électrons. L'impact du faisceau sur la cible provoque l'éjection d'atomes ou d'ions qui vont ensuite se redéposer sur le substrat, dans le cas présent un wafer de silicium, pour former une couche mince de ZnO. L'ensemble est placé dans une enceinte sous vide. substrat (Si) enceinte sous vide pu faisceau pulse --7 d'électrons - Cible (Zn0) Schéma simplifié d'une enceinte de dépôt de couche mince par PED Le substrat de silicium avant dépôt est naturellement recouvert d'une fine couche de silice S10; de quelques nanomètres d'épaisseur. Cette couche persiste après dépôt de ZnO sur le substrat entre ZnO et Si. Après dépôt, on peut être amené à effectuer un traitement thermique, appelé recuit, de la Jonction afin d'améliorer la qualité cristalline de la couche mince de ZnO déposée. Les températures de recuit peuvent être suffisamment élevées pour induire des réactions entre les différentes phases solides présentes. 17 da Cr TN LA NIIELE nn FAITE Interfacial laver Figure 8 : Images en microscopie électronique à transmission (MET) d'une couche mince de ZnO déposée sur un substrat de silicium. (a) Sans recuit après le dépôt, (b) après un recuit à 600 °C après le dépôt, (c) après un recuit à 900°C, (d) vue agrandie d'une partie de la couche « /nterfacial layer » 58- La figure 8b montre qu'après un recuit à 600 °C de la jonction, il s'est produit une augmentation de l'épaisseur de la couche de S10, entre la couche de ZnO et le substrat de silicium. Quelle réaction pourrait expliquer la croissance de cette couche ? 59- Montrer que la réaction proposée est possible (on pourra choisir les conditions de la figure 8b). 7 D'après Q. Xie et al. , Journal of Alloys and Compounds 642, 131-135 (2015). 18 2500 2400! (a) 2300 | ÿy 2200 | (1) $ 2100! = ci à 2000 L Ù . 5 1900} Y (2) 1800 r és is 1700 1600 + (3) T 1500 2 0 0.1 0.2 0.3 0.4 0.5 0.6 0.7 0.8 0.9 1.0 S10; Mole fraction of ZnO ZnO 1900 1880 ( D ) 1860 1840 1820 1800 1780 Temperature/K Point 1 1760 Point 2 1740 1720 % LS F 700 | I i i i 0.50 0.55 0.60 0.65 0.70 0.75 0.80 Mole fraction of ZnO Figure 9 : Diagramme de phase du système ZnO-S10, à pression ordinaire À (a) Diagramme complet, (b) agrandissement de la partie centrale du diagramme. Important : en dessous de 1700 K, les phases sont inchangées. Lorsqu'on recuit la jonction à plus haute température (typiquement 900 °C), en plus de Îa croissance de la couche de S10,;, on observe à l'intérieur de cette couche (« /nterfacial layer » sur la figure 8c), la formation de nano-cristaux d'un autre composé, noté composé C (zones entourées sur la figure 8d). 8 D'après I. Isomäki et al. Trans. Nonferrous Met. Soc. China 28, 1869-1877 (2018) 19 60- Identifier le composé C et déterminer sa température de fusion. 61- Proposer une hypothèse pour expliquer pourquoi le composé C n'est pas observé dans les Jonctions recuites à 600 °C. 62- Indiquer l'état, liquide ou solide et les constituants des phases présentes dans les domaines (1), (2) et (3) du diagramme de phases du système ZnO-S10, (figure 9a). 63- Comment nomme-t-on les points notés « Point 1 » et « Point 2 » sur le diagramme de phases (figure 9b) ? On considère un mélange ZnO-Si0,, dans les proportions représentées par la ligne pointillée verticale sur le diagramme de phases (figure 9b). 64- Déterminer la composition des phases présentes et leurs proportions molaires au point A:. 65- Représenter, en l'expliquant, la courbe d'analyse thermique lorsqu'on chauffe le mélange à partir du point À, jusqu'au point À, (figure 9b). Fin de l'épreuve 20 Constantes d'équilibre 6, K$ et K, DONNEES pb: Pb2 Pb: Pa PKs PKe -6,2 -10,1 -14,3 -15,5 16,5 14,0 Potentiels standards par rapport à l'électrode standard à l'hydrogène Zn* / Zn O; / H,0 H* / H; - 0,76 V 1,23 V 0 V 1 Faraday (F) = 96 500 C --In(10) = 0,06 V à T = 25 °C Masse molaire de O : 16,00 g.mol! Masse molaire de Zn : 65,41 g.mol! Masse volumique de ZnO : p = 5,6 g.cm" Energies des orbitales atomiques de H et O 1s (H) 25 (O) 2p (0) -13,6 eV -32,3 eV -15,8 eV Rayons ioniques Zn°* O7 0,074 nm 0,140 nm Volumes des mailles des structures (À) et (B) de ZnO Structure (A) Structure (B) 00784 nm° 00476 nm° Températures de fusion (T(K) = T(°C) + 273) /ZnO S10; 2247 K 1986 K Grandeurs standard dans la gamme 600 °C -- 900 °C Zn S1 ZnO S10; À;H 0 (kJ.mol!) 0 0 -340 -900 SK !mol!) 86 48 103 117 ÀA;H 1: enthalpie molaire standard de formation, S£ : entropie molaire standard 21 UWNIOUDIME"T UNIOJON UUNIA9TO PUOTA UNIULIO TUNIUTOFSULEI TUNIUIOFI[RC) UNIOHIOS tn) WNIOTIQUI NIUOINI twnrunydoN URL] ununoeIoLT TRHOUL uno TON o[oquiÂs IT oN PI UT sa 30 Ya wo uv nd aN fn Ed UL | °V c9G £OT | 66 &OT | S8GT TOT | 2GG OOT | &GG 66 | IST 86 | 2ÿc 26 | Zÿc 96 | ET GG | ÿyc V6 | 2£c £6 | £SO'SEc GG | POTEC IG | F0 7Ec 06 | 22 6S PSSEUT Z TUNDONUT TNI4197} X TNIAU TL, NII UNTUTOH tnISOIASA(] TUNIQIOT, TUNTIUTIOPEE) wunIdoinA TUNIIRUIRS UNIT AUOI au Apo9 N OULAPOISEI d UNI) aueuqJUr'T NT OEX | ML | JA OH | ÀG | AL | P9 na US | Ma | PN Id 99 CT LG VLT TLZ | PO'ET OZ | 6897 69 | 9729 89 | E6VOT 29 | 057 99 | £68ST G9 | ST ZST F9 | 96TST g9 | 9E0ST &G9 | SI T9 | Fc yrI 09 | T6'0FI 6G | STOT QG | IG'SET 2,G UOssoUur8() OUISSUU], TWNLIOULIOATT TUNTAODSOTA] UWNIAOIO A TUNIUOUIN WNOIUIOO) WNIUOBNU, M uNI}PeJSUIE( UNHIOUFOTN TUNISSEET uMHUOT tun810q80S wnIuqn UNIPIOHIOUJNY SoprUTV UnIpe4 WNDUBIT .e 30 SL AT AT LT UN uo SU sa TN SH ua 36 aa FE V | C4 A V6G SIT | G6& LIT | £6G 9OTT | 88c STI | 68c VIT | ÿ8c STI | G8c GIT | O8G LIT | ISC OTT | 89c 60OT | ZLC 80T | ÿ9c LOT | 99& 9O0T | CIC GOT | T9G POT COI-68 9GG SS | EC LS UOPeY 978$ Y TUNIUOIOX YJNTUSIA quoïd UT L 2IMOIO TN 10 out}eId UNIPIIT TUNITUS() NIUOUY ous, OTEJUET, UNIUFEFI SOpPIUEUqUE"T unÂTeg UNIS9) .e vx 3V 0d a dd LL SH | nv 3d 1] SO d'A M EL JH ET va SO CCC O8 | OTG G8 | 608 PS | 86808 £8e | c20c &8 | SE v0c IS | 65008 OS | 26967 GZ, | 80'G6T 81 | CCI 2,2, | £T06T OZ, | IC98T GJ, | YS'EST 72 | S6OST CZ | 67 82T GAL T2-2G EELET 9G | I6 CET GG UOU9YX 9pOT 9MIL OUIOUTJUY ureJ,, tNIPUT wNIUPE) JuoBIY umiIpeIled WNIPOUY UNITOUINY UNIJOUTIOT, OUQPAAJOIN WNIOIN UWNIUODITZ NII A tNIJUOIJS WNIPIQNY 9X Ï AL ds us UT PO SV Pad | 4 | 4 JL | ON | AN 1Z À 1S d'a 6T'TET pG | 690 gG | 9'ZCT GG | 9ZTCT TG | IZSIT 0G | SSPTIT GT | IFGIT SF | ZS'20I LP | 90 OF | IGGOT GF | 2OTOT FF | 96 CT | F6 C6 Gr | 906 EUR6 IF | FCCIG OF | 90688 G£ | CI28 S£ | 89768 LS uoydATST OUOI TUNIUY9S DIUOSIY UNIUBULIOL) UNITe) DUIZ OIAMO) IPPIN 318409 TO OSQUESUCIN OUOI) NIPEURA OUCLL NIPUEIS UNIES) wnisseJ04 1H 14 96 SV 99) | EI uZ no IN 09) 94 | UM | 19 A LL 26 Ee9 HA 8'EUR8 OG | F0662 G£ | 9681 PS | CCG yz gg | 79cL GE | 5269 TG | 6EUR09 OSG | 97S'E9 6G | £69 86 SG | £5EUR686 LG | S8SS OG | SE6'7S GG | 96671 PG | cr6 0 CG | 29827 Ga | 95677 TG | 82007 OG | 860°6EUR GI UOSIY 9IOTU) 9IFNOS e1oydsouq4 AUOITIS NTUTUNTY UNISOUSETA] TUNIPOS IV | ID | S d | IS | IV SIN | EN 876'6EUR SI EGy'Ge LT G90'CE OT 726 0EUR GT 980'8& AR &86 9G SI COS'FZ ZI 0GG'ZZ II UOYN JONTA OU98ÂKXO 9707Y auoqir) 9104 UNTAIOG NI ON vi O N D d 9 TT OST'08 OT | 286687 G | 666 ST @ | ZOUPI 2, | TTOGT 9 | IISOT G GGT0'6 7 | 1769 g UNHOH OU9801PÂTH °H onbiporiod nesjqe] H e e GC00°V G GLOO'T I 22