X Chimie PC 2007
| Thème de l'épreuve | Synthèse de l'arborone |
| Principaux outils utilisés | chimie organique, courbes intensité-potentiel, diagrammes E-pH, thermochimie |
| Mots clefs | cuprate, carbone asymétrique, O-alkylation, Diels-Alder, RMN, IR, conformation chaise, addition 1, 4, alliage à mémoire de forme, titane |
Corrigé
:👈 gratuite pour tous les corrigés si tu crées un compte
👈 l'accès aux indications de tous les corrigés ne coûte que 1 € ⬅ clique ici
👈 gratuite pour tous les corrigés si tu crées un compte
- - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - -
👈 gratuite pour ce corrigé si tu crées un compte
- - - - - - - - - - - - - - - - - - - - - - - - - -
Énoncé complet
(télécharger le PDF)








Rapport du jury
(télécharger le PDF)







Énoncé obtenu par reconnaissance optique des caractères
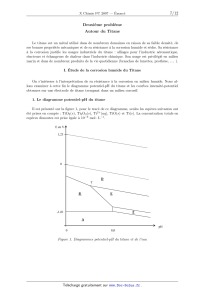
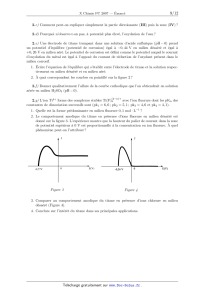
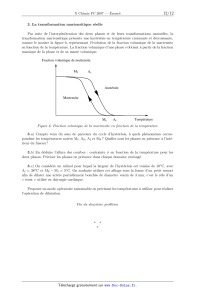
ECOLE POLYTECHNIQUE ÉCOLE SUPÉRIEURE DE PHYSIQUE ET DE CHIMIE INDUSTRIELLES CONCOURS D'ADMISSION 2007 FILIÈRE PC COMPOSITION DE CHIMIE (Durée : 4 heures) L'utilisation des calculatrices n'est pas autorisée. L'épreuve comporte deua: problèmes indépendants. *** Premier problème Synthèse de l'arborone L'iso E Super® est un mélange odorant d'origine synthétique qui a été utilisé dans la fabri-- cation de plusieurs parfums très connus, comme << Trésor >>, << Dolce Vita >> ou encore << Féminité du Bois >>. Il apporte aux créations parfumées une sensation boisée inédite, qui est en fait prin-- cipalement due a une molécule bicyclique appelée arborone --du latin arbor-- qui possède une odeur très intense. C'est ce qu'ont prouvé des chercheurs de l'entreprise Givaudan--Roure en ef-- fectuant la première synthèse de l'arborone. En 2006, E. J. Corey, prix Nobel de chimie 1990, a montré en synthétisant les deux antipodes de l'arborone (notée A), qu'uniquement l'un deux (la (+)--arborone), est capté par l'odorat humain a des seuils inférieurs à 1 pg-L_1. . : "'/7% O (+)--arborone Données en RMN du proton CH3-C- CH3-C=C- CH3-C-CO- -CH2-CO- -C=C-CH- 0,a1,0 1,6--2,0 1,0-1,2 2,223 2,025 CHg--O-- --CHOH-- --CH=CH--CO-- --CH=CH-- (cycle) R-CHO 3,4-3,s 3,6--4,0 6,8--7,1 5,2--6,0 9,a10,2 Déplacements chimiques 5 en ppm Données de spectrosc0pie infrarouge (LR) R--CHO R-COgMG : ; Ç>: <:0>= 1725 1730 1717 1685 1770 1730 Nombres d'onde des bandes d 'absorption du carbonyle en cm_1 (R groupe aliphatique saturé} --OH (alcool) 3650--3600 (libre) 3500--3250 (lié) Nombres d'onde des bandes d'absorption du OH en cm--1 I. Synthèse « GIVAUDAN » 1. Dans la première étape de l'approche Givaudan, un sesquiterpène d'origine naturelle, l'a--ionone racémique re-- présentée ci--contre, est traitée par le diméthylcuprate de lithium dans l'éther diéthylique (éthoxyéthane) anhydre. L'hydrolyse du mélange réactionnel permet d'isoler majori-- tairement un composé B, inactif optiquement, dont les deux \ atomes de carbone asymétriques ont la même configuration absolue. Un composé minoritaire B' , dont le spectre I.R. pré-- sente une bande au--delà de 3000 cm_1 a pu être isolé. o La ) Pourquoi peut--cn qualifier l'a--ionone de race"m7lque ? 1.b) De quel type de réaction avec le diméthylcuprate de lithium s'agit--il? Schématiser son mécanisme en faisant apparaître la configuration des atomes de carbone asymétriques. 1.0) Préciser pourquoi B n'a pas d'activité optique? À quelle sélectivité a--t--on affaire au cours de cette réaction ? 1.d) Expliquer la formation de B' . Dans la suite du problème, on raisonnera sur l'énantiomère (R, R) de B. 2. B (RCOCH3) est soumis a chaud au dibrome en milieu basique aqueux, ce qui génère la formation de bromoforme CHBr3, d'ions bromure et d'un anion carboxylate qui, après neutrali-- sation, conduit a C (RCOOH). Le chauffage au reflux de C dans un mélange benzène -- méthanol en présence d'acide paratoluènesulfonique donne D. 2.a) Écrire l'équation-bilan de formation de l'anion carboxylate. 2.b) Donner la structure de D. Comment rendre sa formation quantitative ? 3. À partir de D, une série de réactions permet d'obtenir le cétoester E, donné ci--dessous. L'action sur E du bromure d'éthynylmagnésium en quantité équimoléculaire dans le THF an-- hydre a 00EUR, puis a température ambiante, fournit après hydrolyse, F, qui est hydrogéné par un équivalent de dihydrogêne, en G sur catalyseur a base de palladium empoisonné. "ll/z, // . 3.a) Indiquer les sites de E sur lesquels le magnésien est susceptible de réagir. Quel est le plus réactif? 3.19) Écrire l'équation--bilan résultant de l'action du magnésien sur E. En déduire la structure du produit normalement attendu F' . 3.0) Montrer que l'anion intermédiaire résultant de l'addition du magnésien sur E peut évoluer pour conduire a F représenté ci--dessus, par une réaction que l'on détaillera. 3.d) L'addition du magnésien sur E a lieu avec une très bonne diastéré0sélectivité, discuter cette sélectivité en analysant les conformations chaises possibles du composé E. 3.6) Donner la formule développée de G, ainsi que la configuration absolue de ses atomes de carbone asymétriques. 4. G est ensuite opposé a du diisopropylamidure de lithium (LDA) dans le THF a basse température, puis un léger excès d'iodure de méthyle est ajouté, ce qui aboutit a la formation de H. Du LDA est alors ajouté (1,2 équivalent), en même temps qu'un large excès de chlorure de triméthylsilane, ClSi(CHg)g. Le produit résultant J de formule brute C18HggOgSi est chauffé au reflux du toluène 24 h, et K alors formé est traité par du méthyllithium en milieu éther diéthylique (éthoxyéthane) anhydre pour finalement aboutir a l'arborone A. 4.50 Écrire l'anion qui se forme par action du LDA sur G, en justifiant sa stabilité, puis la structure de H qui en découle après réaction avec Mel. Préciser la nature de cette dernière réaction. 4.19) Faire de même avec l'anion I issu de H. Proposer une formule semi--développée pour J , qui soit en accord avec l'absence d'une bande forte en I.R. vers 1730 cm_1, par ailleurs présente dans le spectre de G. On rappelle que le silicium possède une affinité plus grande pour l'oxygène que pour le carbone comme en témoigne la très forte valeur de l'énergie de la liaison Si--O (452 kJ -mol_1) et la plus faible énergie de la liaison Si--C (289 kJ -mol_1). 4.0) Le chauffage de J aboutissant a l'isolement de K représenté ci--dessous7 imaginer un mécanisme a 6 centres analogue a celui qui se produit dans l'équilibre suivant proposé en exemple, permettant d'expliquer le passage de J a K. 4.61) On obtient l'arborone A en transformant le groupement ester de K en cétone. Indiquer si elle est obtenue optiquement pure. Conclure quant a la sélectivité de la synthèse. II. Synthèse de Corey 1. EJ. Corey et ses collaborateurs mettent en oeuvre dans cette synthèse un type nouveau de catalyse avec un composé activé7 noté catalyseur 1, représenté ci--contre. À une solution du catalyseur 1 dans le dichlorométhane7 sont ajoutés successi-- vement du buta--1,3--diène et du (E)--2--méthylbut--2--énal. Après 24 h de réaction a température ambiante, l'aldéhyde L est obtenu avec un rendement de 84%. La) Quelle est la nature de la réaction qui a lieu entre le diène et l'énal ? Indiquer sur un schéma clair, le mouvement des doublets mis en jeu au cours de cette réaction. TfOe 1.19) En l'absence du catalyseur 1, combien de stéréoisomères se formeraient--ils ? Les dessiner en précisant la configuration ab-- solue de leurs atomes de carbone asymétriques. Observe--t--on une activité optique pour le produit obtenu dans ce cas ? Catalyseur 1 1.0) Le composé L dont les deux atomes de carbone asymétriques ont la configuration absolue R se forme majoritairement en présence du catalyseur 1. Préciser la configuration absolue des atomes asymétriques du catalyseur 1. Quel type de sélectivité permet de réaliser le catalyseur 1 ? 2. L'oxydation de L par l'anhydride chromique CÏ03 en présence d'acide sulfurique (réactif de Jones) dans la propanone entraîne la formation de M. Ce dernier est ensuite agité dans le THF avec une solution aqueuse d'hydrogénocarbonate de sodium, de diiode et d'iodure de potassium. Il se forme alors une iodolactone cyclique N dont la structure est donnée ci--après. Cette lactone chauffée pendant 12 h dans le THF avec un excès de DBU fournit le composé O. DBU 2.a) Donner la formule développée de M. Sous quelle forme M se trouve--t--il en présence d'hydrogénocarbonate ? 2.19) La réaction d'obtention de la lactone N débute par la génération d'un cation analogue a celui observé dans l'addition du dibrome sur un alcène. Proposer une structure pour le ca-- tion dérivant de l'action du diiode sur M. Conclure quant a la suite du mécanisme expliquant l'obtention de N. 2.0) Pourquoi ajoute--t--on des ions iodure au mélange réactionnel? 2.61) Le DBU joue le rôle d'une base encom-- brée dans l'étape suivante. Préciser le site par lequel elle réagit. Montrer, en analysant les diffé-- rents mécanismes possibles, qu'il ne peut se for-- mer que le seul produit 0. -Hl||llO 3. O est agité dans le méthanol en présence de 1,5 équivalents de méthan0late de sodium a température ambiante pour donner P après extraction. L'action du chlorochromate de pyridi-- nium (PCC) sur P dans le dichlorométhane anhydre engendre le composé Q de formule brute C10H1403. Le produit P présente les caractéristiques spectroscopiques suivantes : Nombres d'onde des bandes d'absorption en Infrarouge : 3377 et 1727 cm--1 Déplacements chimiques en RMN du proton (ppm) : 0,84 (doublet, 3H, J=7,2 Hz); 1,05 (singulet, 3H); 1,84 (doublet de doublet, 1H, J=7,0 et 13,2 Hz); 1,95 (doublet de doublet, 1H, J=5,6 et 12,8 Hz); 2,64--2,70 (multiplet, 1H); 3,00 (Singulet, 1H); 3,62 (singulet, 3H); 4710--4715 (multiplet, 1H)3 5,46--5,49 (multiplet, 1H); 5,58--5,62 (multiplet, 1H); 3.a) Proposer une formule développée pour P qui soit en accord avec ces données, en indi-- quant par quel mécanisme il est obtenu. Quel est l'élément moteur de cette réaction ? 3.19) Le chlorochromate de pyridinium (PCC) est préparé cristallisé par refroidissement a 00EUR d'un mélange d'anhydride chromique, de HCl de concentration 6 mol-L_1 et de pyridine (C5H5N). Donner la structure du PCC. On obtient ainsi un réactif oxydant plus doux que le réactif de Jones. En déduire la nature et la structure du composé Q. 4. L'action du cyanocuprate lithié R--Cu(CN)Li avec R : --C(CH3)2(CH2)2CHîCH2, qui se comporte comme un organocuprate lithié, sur Q dans le THF a basse température entraîne la formation de R, dont la configuration de l'atome de carbone asymétrique alors formé est S. Ce dernier est ensuite ozonolysé en présence de diméthylsulfure (milieu réducteur) pour donner l'aldéhyde S. 4.0.) Proposer des formules développées pour R et S, en indiquant de manière appropriée la position des substituants par rapport au cycle. 4.19) Donner l'équation bilan traduisant l'ozonolyse de R. 5. Au cours de l'étape clé, l'aldéhyde S, en présence d'une quantité catalytique d'acide para--toluène sulfonique, est chauffé 14 h au re-- flux du benzéne a l'aide d'un réfrigérant équipé d'un Dean--Stark, cet appareil permet d'éliminer l'eau au fur et a mesure de sa formation. Le pro-- duit T résultant présente la structure ci--contre : 5.0.) Indiquer les sites de protonation possibles de S en milieu acide. Quels sont les équilibres de tautomérie qui peuvent se produire dans ces conditions? Comment appelle--t--on la réaction de formation de T ? Proposer un mécanisme. 5.19) S possède également une autre fonction susceptible de réagir, pourquoi n'est--elle pas affectée? 6. Dans les étapes suivantes que l'on n'étudiera pas, T est transformé en V. La fonction ester méthylique de V est ensuite transformée en fonction aldéhyde. La molécule W ainsi obtenue, est agitée dans le THF anhydre a 00EUR avec un excès de bromure de méthylma-- gnésium. Après neutralisation, extraction et évaporation, le produit résultant X est finalement traité par le PCC dans le dichlorométhane, ce qui permet d'obtenir A, qui possède une très intense odeur, avec un bon rendement. 6.0.) Proposer une série de transforma-- tions pour préparer l'aldéhyde W a partir de V, en précisant les réactifs utilisés. 6.19) Schématiser les deux dernières réactions, puis représenter la molécule A en précisant bien sa stéréochimie. Est--elle obtenue optiquement pure? Comment qualifier la sélectivité de cette synthèse ? 6.0) E.J . Corey et ses collaborateurs ont effectivement préparé l'antipode de A, pour constater qu'il n'avait qu'une odeur très faible. Proposer une explication. Conclure quant a la forte odeur observée pour la molécule A préparée par le groupe Givaudan. F ... du premier problème Deuxième problème Autour du Titane Le titane est un métal utilisé dans de nombreux domaines en raison de sa faible densité, de ses bonnes propriétés mécaniques et de sa résistance a la corrosion humide et sèche. Sa résistance a la corrosion justifie les usages industriels du titane : alliages pour l'industrie aéronautique, réacteurs et échangeurs de chaleur dans l'industrie chimique. Son usage est privilégié en milieu marin et dans de nombreux produits de la vie quotidienne (branches de lunettes, prothèse, . . . ). I. Étude de la corrosion humide du Titane On s'intéresse a l'interprétation de sa résistance a la corrosion en milieu humide. Nous al-- lons examiner a cette fin le diagramme potentiel--pH du titane et les courbes intensité--potentiel obtenues sur une électrode de titane trempant dans un milieu corrosif. 1. Le diagramme potentiel--pH du titane Il est présenté sur la figure 1, pour le tracé de ce diagramme, seules les espèces suivantes ont été prises en compte : Tl02(8), Tl203(8), Ti2+(aq), TiO(s) et Ti(s). La concentration totale en espèces dissoutes est prise égale a 10_6 mol - L_1. EenV/\ 1,23 "* -1,81 \E l> V pH 0 8,0 F figure 1 . DZagmmme3 potentiel--pH du titane et de l'eau 1.a ) Attribuer a chaque espèce le domaine qui lui convient en précisant s'il s'agit d'un domaine de prédominance ou d'existence. 1.19) Connaissant les coordonnées du point T (pHT : 4,0; ET : --0,8 V), déterminer les potentiels standard E? et E8 des couples Q/fi et Q/E. On prendra RT/F Ln(10) : 0,06 V. 1.0) Quelle réaction peut se produire a priori lorsqu'une électrode de titane est plongée dans une solution aqueuse acide (pH=0) aérée ? Même question dans une solution désaérée ? La concentration en dioxygëne dissous dans une solution aqueuse en équilibre avec l'atmo-- sphère est de l'ordre de 10_4 mol - L_1. 2. Interprétation de la corrosion humide du titane à l'aide de la courbe intensité-- potentiel d'une électrode en titane Il s'agit de comprendre la corrosion humide du titane par analogie a celles du fer et du zinc en s'aidant des courbes intensité--potentiel et du diagramme potentiel--pH précédemment étudié. Aucune connaissance théorique sur les courbes intensité--potentiel n'est exigée. On demande sim-- plement d'expliquer les phénomènes chimiques intervenant dans le processus de corrosion. On rappelle que l'intensité par unité de surface d'électrode (la densité de courant) est proportionnelle a la vitesse des réactions électrochimiques mises en jeu et que, par convention, elle est positive pour les réactions d'oxydation se produisant a l'anode et négative pour les réactions de réduction se produisant a la cathode. La courbe intensité--potentiel (Figure 2) représente l'intensité par unité de surface de titane (densité de courant) J en fonction du potentiel E imposé a l'électrode et mesuré par rapport a l'électrode standard a hydrogène. L'électrode en titane plonge dans une solution désaérée (sans dioxygëne dissous) d'acide sulfurique de pH w 0. A J (11) (III) (IV) 0 2 V E(V) F figure 2. Courbe intensité--potentiel d'une électrode en titane 2.a) Quelle est la réaction correspondant a la courbe (I) ? 2.19) La vague anodique comporte une partie croissante (II). Relier sa formation a une zone du diagramme potentiel--pH précédent que l'on précisera. 2.c) Comment peut--on expliquer simplement la partie décroissante (III) puis la zone (IV) ? 2.d) Pourquoi n'observe--t--on pas, a potentiel plus élevé, l'oxydation de l'eau? 2.6) Une électrode de titane trempant dans une solution d'acide sulfurique (pH=O) prend un potentiel d'équilibre (potentiel de corrosion) égal a --0,44 V en milieu désaéré et égal a +0, 26 V en milieu aéré. Le potentiel de corrosion est défini comme le potentiel auquel le courant d'oxydation du métal est égal a l'opposé du courant de réduction de l'oxydant présent dans le milieu corrosif. 1. Écrire l'équation de l'équilibre qui s'établit entre l'électrode de titane et la solution respec-- tivement en milieu désaéré et en milieu aéré. 2. À quoi correspondent les courbes en pointillé sur la figure 2 ? 2. f ) Donner qualitativement l'allure de la courbe cathodique que l'on obtiendrait en solution aérée en milieu HgSO4 (pH : O). 2. g ) L'ion T i4+ forme des complexes stables T i(F)Ë'_H'+ avec l'ion fluorure dont les pKn des constantes de dissociation successifs sont (pk1 : 6, 6; pkg : 5,1 ; pkg : 4, 6 et pk4 : 4, 1). 1. Quelle est la forme prédominante en milieu fluorure O, 1 mol - L_1 ? 2. Le comportement anodique du titane en présence d'ions fluorure en milieu désaéré est donné sur la figure 3. L'expérience montre que la hauteur du palier de courant dans la zone de potentiel supérieur a 0 V est proportionnelle a la concentration en ion fluorure. À quel phénomène peut--on l'attribuer ? M J ,, J --0,77V 0 EN) -0,36 V 0 E(V) Figure 3 Figure 4 3. Comparer au comportement anodique du titane en présence d'ions chlorure en milieu désaéré (Figure 4). 4. Conclure sur l'intérêt du titane dans ses principales applications. II. Étude d'un alliage à mémoire de forme : le Nitinol Un alliage a mémoire de forme ou AMF présente la propriété singulière de pouvoir mémoriser une forme déterminée au préalable. Un AMF existe a basse température sous une structure martensite se transformant sous l'effet d'un réchauffement en une structure austénite et vice-- versa. On observe ainsi une transformation martensitique se produisant sans diffusion d'atomes, comme le montre le schéma suivant (Figure 5). Austénite (Haute température) Refroidissement Chauffage . .. .. . Martensite . .. .. . (Basse température) . . . . . . F 7Lgure 5. Transformation structurale austénite S martensite Le nitinol est un AMF de nickel et de titane de composition stoechiométrique NiT i. La phase austénite possède une structure cubique de type CsCl. La phase martinsite quant a elle adopte une structure cristalline, localement très proche de la phase austénite, ce qui assure la réversibilité de la transformation. Le problème s'intéresse aux propriétés thermodynamiques de l'alliage et non a sa structure cristallographique. Dans tout l'énoncé, les grandeurs relatives a la martensite et a l'austénite seront respective-- ment indicées M et A : par exemple, HM désigne l'enthalpie molaire de la martensite. Le nitinol, mis en une forme F A a température élevée est ensuite refroidi. La transformation martensitique a alors lieu et on peut donner au solide obtenu une nouvelle forme FM. On peut naturellement obtenir ensuite F A a partir de FM en appliquant une contrainte a température constante ou en augmentant la température a contrainte nulle (ou constante). 1. Mélange idéal sous contrainte nulle 1.a ) Exprimer l'enthalpie libre molaire de l'austénite et de la martensite en fonction de la température. 10 1.19) Représenter les deux fonctions G : f(T) pour l'austénite et la martensite, sachant que l'austénite est la phase la plus désordonnée. À quelle condition s'agit--il de droites? Cette condition sera supposée vérifiée par la suite. 1.0) Comment peut--on déterminer la température d'équilibre TO des deux phases. Préciser les phases stables selon le domaine de température. Le!) Quel est le signe de l'enthalpie de la transformation AA_,MH ? 1.6) Représenter l'entr0pie du système contenant initialement une mole d'austénite en fonc-- tion de la température. À la température T0, quelle est l'entropie du système en fonction de la fraction molaire x A ? 2. Transformation isotherme sous contrainte Pour tenir compte de la contrainte appliquée a l'échantillon, on ajoute a l'enthalpie libre molaire de chaque phase, un terme --VO - o - e dans lequel VO représente le volume molaire initial de la phase, 0 une contrainte provoquant la déformation totale élastique et cristallographique e, en traction ou en compression. Une contrainte s'exprime habituellement comme une force divisée par une surface et une déformation comme le rapport de la variation de la dimension de l'objet sur sa dimension initiale. V0 est supposé identique pour les deux phases. La nouvelle expression de l'enthalpie libre molaire s'écrit alors : G* = G -- VO - o - EUR, dont l'expression différentielle est : dG* = --SdT + Vdp -- Voedo. 2.0.) Quelle est l'unité du produit a - EUR? 2.19) Déduire de dG* l'expression du travail mécanique élémentaire fourni au cristal par l'application de la contrainte a. 2.0) En tenant compte de la faible influence de la pression sur les phases condensées, simplifier l'expression différentielle de G*. 2.d) Donner l'expression des fonctions G* : f(T, a) en utilisant pour les deux phases deux constantes d'intégration G% et Gï/I. 2.e) Dans un triédre direct (0,T,G*), quelle est l'allure des surfaces correspondant aux fonctions précédentes ? 2. f ) Comment se traduit alors l'équilibre entre les deux phases A et M ? 2. g ) À l'équilibre thermodynamique, quelle est la pente de la courbe représentant la contrainte o en fonction de la température de transition Tt ? À quelle relation classique vous fait--elle penser ? 2.h) Tracer, en précisant les hypothèses utilisées et le résultat de la question 1.61) la courbe représentant la contrainte o en fonction de la température de transition. 11 3. La transformation martensitique réelle Par suite de l'interpénétration des deux phases et de leurs transformations mutuelles, la transformation martensitique présente une hystérésis en température croissante et décroissante7 comme le montre la figure 6, représentant l'évolution de la fraction volumique de la martensite en fonction de la température. La fraction volumique d'une phase s'obtient a partir de la fraction massique de la phase et de sa masse volumique. Fraction volumique de martensite A Mf AS Austénite Martensite \ ' MS Af Température F igure 6. Fractiou volumique de la martensite en fonction de la température 3.a) Compte tenu du sens de parcours du cycle d'hystérésis, a quels phénomènes corres-- pondent les températures notées Mf, Ag, Af et Ms ? Quelles sont les phases en présence a l'inté-- rieur du fuseau ? 3.19) En déduire l'allure des courbes : contrainte o en fonction de la température pour les deux phases. Préciser les phases en présence dans chaque domaine envisagé. 3.0) On considère un nitinol pour lequel la largeur de l'hystérésis est voisine de 10°C) avec Af : 38°C et Ms -- Mf : 5°C. On souhaite utiliser cet alliage sous la forme d'un petit ressort afin de dilater une artère partiellement bouchée de diamètre voisin de 3 mm, c'est le rôle d'un << stent >> utilisé en chirurgie cardiaque. Proposer un mode opératoire raisonnable en précisant les températures a utiliser pour réaliser l'opération de dilatation. Fin du deuæième problème 12