e3a Physique et Chimie PC 2022
| Thème de l'épreuve | Un modèle simplifié de sismographe. Un modèle simplifié de tornade. Synthèse du (-)-aromadendrène. Échange de ligands dans un complexe de coordination. |
| Principaux outils utilisés | mécanique, mécanique des fluides, chimie organique, cinétique chimique, orbitales moléculaires |
| Mots clefs | sismographe, tornade, résonance, tremblement de terre, forces d'inertie, Bernoulli, dépression, vecteur tourbillon, séisme, (-)-aromadendrène, phen, orthophénantroline, dissociation |
Corrigé
:👈 gratuite pour tous les corrigés si tu crées un compte
👈 l'accès aux indications de tous les corrigés ne coûte que 1 € ⬅ clique ici
👈 gratuite pour tous les corrigés si tu crées un compte
- - - - - - - - - - - - - - - - - - - - - - - -
👈 gratuite pour ce corrigé si tu crées un compte
- - - - - - - - - - - - - - - - - -
Énoncé complet
(télécharger le PDF)










Rapport du jury
(télécharger le PDF)




Énoncé obtenu par reconnaissance optique des caractères
SESSION 2022 EUR y PC9PC
NES
e3a
POLYTECH
ÉPREUVE SPÉCIFIQUE - FILIÈRE PC
PHYSIQUE ET CHIMIE
Durée : 4 heures
N.B. : le candidat attachera la plus grande importance à la clarté, à la
précision et à la concision de la rédaction.
Si un candidat est amené à repérer ce qui peut lui sembler être une erreur
d'énoncé, il le signalera sur sa copie
et devra poursuivre sa composition en expliquant les raisons des initiatives
qu'il a été amené à prendre.
RAPPEL DES CONSIGNES
-_ Utiliser uniquement un Stylo noir ou bleu foncé non effaçable pour la
rédaction de votre composition ; d'autres
couleurs, excepté le vert, peuvent être utilisées, mais exclusivement pour les
schémas et la mise en
évidence des résultats.
- Ne pas utiliser de correcteur.
-_ Écrire le mot FIN à la fin de votre composition.
Les calculatrices sont autorisées.
Le sujet est composé de quatre problèmes indépendants, deux de physique deux de
chimie.
e_Jout résultat donné dans l'énoncé peut être admis et utilisé par la suite,
même s'il n'a
pas été démontré par le ou la candidat(e).
e Les explications des phénomènes étudiés interviennent dans l'évaluation au
même
titre que les développements analytiques et les applications numériques.
e Les résultats numériques exprimés sans unité ou avec une unité fausse ne sont
pas
comptabilisés.
1/15
PROBLÈME 1
Un modèle simplifié de sismographe
Le sismographe est un instrument chargé d'enregistrer les mouvements de
l'écorce terrestre
par rapport au référentiel du laboratoire supposé galiléen.
Il peut être modélisé par un ressort de constante de raideur k dont l'extrémité
supérieure est
solidaire d'un boîtier posé sur le sol.(Voir Figure 1)
Une masse m de centre d'inertie G, attachée à l'autre extrémité du ressort est
reliée à un
. , y À --
amortisseur exerçant une force de frottement visqueux que l'on écrira f = ---AV.
Une partie non représentée permet d'enregistrer les mouvements de la masse.
Lorsque l'appareil détecte un tremblement de terre, le boîtier est animé d'un
mouvement de
translation rectiligne par rapport au référentiel du laboratoire.
O
ü, Y
k
-->
_0 Lurereree +G| m 8
u, Y
À
SOL
Z\z
Figure 1 - Modèle du sismographe
L'axe (Oz) est un axe fixe lié au référentiel du laboratoire R.
L'axe (0'z') est un axe mobile lié au référentiel boîtier R'.
La cote de l'origine O' du repère R' représentée sur le schéma correspond à la
position
d'équilibre du centre d'inertie de la masse lorsque le boîtier est immobile,
c'est-à-dire en
absence de mouvement de l'écorce terrestre.
2115
Q1.
Q2.
QS.
Q4.
QS.
Q6.
Q7.
Q8.
= = 3 = > = #
Que représente le coefficient 1 dans l'expression de f ? Quelle est son unité ?
La longueur à vide du ressort est notée {,. On considère dans cette question
que le
sol ne vibre pas.
Appliquer la seconde loi de Newton à la masse m dans le référentiel R' lié au
boîtier
qui est alors galiléen.
Quelle est la longueur à l'équilibre £, du ressort en fonction des données ?
Lorsque le sol vibre, le référentiel lié au boîtier n'est plus galiléen.
Rappeler les expressions des forces d'inertie à prendre alors en compte et
donner
leurs expressions dans le cas du sismographe étudié.
Effectuer le bilan des forces s'exerçant sur la masse dans R' et les
représenter en
supposant que les valeurs de l'allongement du ressort, de la vitesse du point G
et de
l'accélération d'entraînement sont positives.
Appliquer la seconde loi de Newton à la masse dans le référentiel R' lié au
boîtier.
On notera z, la cote du point G dans le repère R".
Projeter cette relation sur l'axe vertical.
On supposera que l'expression de Z;s(f) décrivant le mouvement du sol est :
Zs(t) = Emcos(wt + ).
On écrit cette relation sous la forme suivante :
dz! az'
2 + Ca + WÉZ, = Enw°cos(wt + b).
Comment appelle-t-on «9 et Q? Donner leurs expressions littérales.
Pour un sismographe, le facteur de qualité est toujours très élevé.
Quelle est alors l'équation obtenue en simplifiant la relation précédente si on
se place
dans le cas idéal où le facteur de qualité est infini"?
En régime permanent, la solution de cette équation s'écrit ZA(t) = Zmcos(wt+")
avec
Zm > 0.
Quelle est l'expression de Zmh ?
3/15
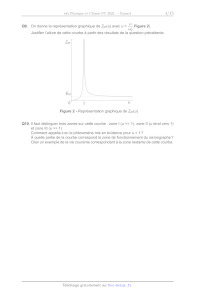
Q9. On donne la représentation graphique de Zh{(u) avec u = © Figure 2)
Q
Justifier l'allure de cette courbe à partir des résultats de la question
précédente.
Zm
' ; u
Figure 2 - Représentation graphique de Zm(u)
Q10. |! faut distinguer trois zones sur cette courbe : zone Î (u << 1), zone II (u tend vers 1) et zone Ill (u >> 1)
Comment appelle-t-on le phénomène mis en évidence pour u = 17?
À quelle partie de la courbe correspond la zone de fonctionnement du
sismographe ?
Citer un exemple de la vie courante correspondant à la zone restante de cette
courbe.
45
PROBLÈME 2
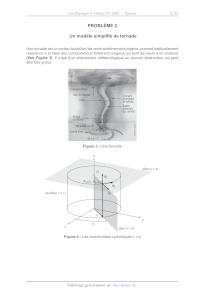
Un modèle simplifié de tornade
Une tornade est un vortex (tourbillon) de vents extrêmement violents, prenant
habituellement
naissance à la base des cumulonimbus fortement orageux qui sont les seuls à en
produire
(Voir Figure 3). Il s'agit d'un phénomène météorologique au pouvoir destructeur
qui peut
être très grand.
- Courant
my ascendant
en spirale
_ Basses
ressions
(au centre)
GRAPHIES F38240
[an z=2Z
surface r=r
r
plan 0 = 9:
Figure 4 - Les coordonnées cylindriques r, 6,z
5/15
Dans ce problème la tornade est modélisée par un vortex cylindrique de rayon R
et d'axe
Oz.(Voir Figure 4)
L'écoulement d'air sera considéré comme parfait, incompressible, homogène et
stationnaire.
Le champ de vitesse est décrit par la relation V = vo(r)es et un vecteur
tourbillon o tel que
--
Go = Qpez pour0Rk.
Les effets de la pesanteur seront négligés et la masse volumique de l'air sera
notée w.
Q11. Quelle est l'expression du vecteur tourbillon ? Que représente
qualitativement ce vec-
teur au niveau local"?
Dans quel cas ce vecteur est-il nul? Comment est alors caractérisé l'écoulement
cor-
respondant ?
Q12. Définir les expressions suivantes figurant dans l'énoncé : écoulement
parfait, écoule-
ment homogène et incompressible, écoulement stationnaire.
Q13. Rappeler la définition d'une ligne de courant. Quelle est la nature de ces
lignes de
courant dans la cas du modèle de la tornade adopté ? Représenter quelques unes
de
ces lignes de façon lisible.
Q14. Établir les expressions de la vitesse v,(r) dans les deux domaines
considérés.
On précise que la vitesse est continue dans le domaine dans lequel elle est
définie de
même qu'en r=k, que vg(r = 0) = 0 et que va(r) -- 0 lorsque r -- +oo.
Q15. Représenter graphiquement ses variations en fonction de r. Proposer une
analogie
magnétique.
Q16. On s'intéresse au champ de pression dans le domaine r > R.
On suppose que la pression loin de la tornade est égale à la pression
atmosphérique
P(r -- co) -- Pa.
Que peut-on dire de l'écoulement pour ces valeurs de r?
Que peut-on en déduire pour la relation de Bernoulli? Préciser son champ
d'applica-
tion dans ce cas.
Q17. Établir alors l'expression de Pf(r) pour r> R.
Q18. On s'intéresse au champ de pression dans le domaine 0 , 1 00e) | 0 >>
r 0Zz ôr r
or 00
00 OZ
Accélération convective
D > LL ? v£ >
--|+rotv À V
(V - grad) Vv = grad 5
7A5
PROBLÈME 3
Synthèse du (-)-aromadendrène
Présentation générale
L''aromadendrène 13 (figure 5) est un sesquiterpène tricyclique comportant 3
unités
isoprènes (2-méthylbuta-1,3-diène), qui est présent dans les huiles
essentielles d'arbre à
thé ou d'eucalyptus. Il confère aux huiles essentielles précitées une odeur
caractéristique
mentholée.
H te
13
FIGURE 5 - (-)-aromadendrène 13
On se propose d'étudier la synthèse du (-)-aromadendrène à partir du
(--)-périllaldéhyde (1) d'origine naturelle. Le document 1 décrit le schéma de
synthèse
associé.
Abréviation Nom Formule
Me Méthyle --CH3
BuOK Tertiobutanolate de À Oo ©
potassium O K
Ph Phényle ---CsHs
PPh3 Triphénylphosphine |
O
DMSO Diméthylsulfoxyde &
Ve
Et0 Diéthyléther he de
Ms Mésvle (méthanesulfonvle Ve
ve \ ve) MeSO; = "°°.
Ts Tosyle S.
(paratoluènesulfonyle) Y
CH;SO> --
TABLEAU 1 - Liste des abréviations
8/15
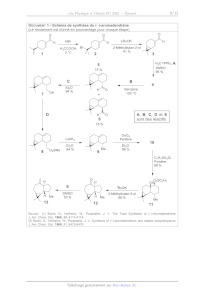
DOCUMENT 1 - Schéma de synthèse du (-)-aromadendrène
(Le rendement est donné en pourcentage _T chaque étape)
O O
| H t-BuOK : H
H C000H Br 2-Méthylbutan-2-0l
41 %
1 0 3
5 H,C=PPh; À
| DMSO
15% 95 %
C B
< < 4 eo H7 So Benzène ° + 100 °C D Ç A, B,C,DetE 6 sont des réactifs 15 % Y OsO;, LiAIH4 Pyridine > > 10
84 % Me 86 %
9
CH/SO,CI
Pyridine
89 %
Y
O Oo P3SC7H7
. _- » tBuOK
H DMSO = 2-Méthylbutan-2-0l
Me 53 % H Me 88 =
Me
13 12 1
Source : (1) Büchi, G.; Hofheinz, W.; Paukstelis, J. V. The Total Synthesis of
(-)-Aromadendrene.
J. Am. Chem. Soc. 1966, 88, 4113-4114.
(2) Büchi, G.; Hofheinz, W.; Paukstelis, J. V. Synthesis of (-)-aromadendrene
and related sesquiterpenes.
J. Am. Chem. Soc. 1969, 97, 6473-6478.
9/15
Q21. Que signifie le "(-)" dans l'écriture du (-)-périllaldéhyde 1 ? Combien
existe-il de
stéréoisomères de configuration pour le composé 1? Donner le descripteur
stéréochimique de l'atome de carbone asymétrique du composé 1.
Q22. Le produit 2 est obtenu par addition régiosélective d'un équivalent de HBr
sur le
(---)-périllaldéhyde (1) selon le mécanisme décrit dans le document 2. Sachant
que
la première étape (formation du carbocation) respecte la règle de Markovnikov,
proposer une explication quant à la régiosélectivité de formation du carbocation
intermédiaire.
DOCUMENT 2 - Mécanisme d'addition de HBr sur l'alcène 1
Les hydrogènes en position y d'une énone ont un caractère suffisamment acide
pour que
le carbone en position y puisse être déprotonné par un alcoolate tel que t-BUOK
(document 3).
DOCUMENT 3 - Formation d'un carbanion sur une a-énone
fe _
t-BuO|
IIS -- HSE
H H
Q23. Sachant que l'attaque nucléophile conduit directement à 3 sans
intermédiaire
réactionnel, proposer un mécanisme de formation de 3.
À quel mécanisme connu l'étape d'attaque nucléophile s'apparente-t-elle ? Quelle
différence constatez-vous ?
Justifier la stabilité particulière du carbanion intermédiairement formé lors
de la
réaction de formation de 3.
Q24. La réaction du composé bicyclique 3 avec le méthylènetriphénylphosphorane A
permet de former le produit 4.
Donner la structure de 4.
Donner le nom de la réaction.
Q25. La réaction à haute température du composé 4 en présence du réactif B,
génère par
une réaction régiosélective et stéréosélective un mélange de seulement deux
stéréoisomères 5 et 6, l'isomère 5 étant majoritaire.
Quelle est la relation d'isomérie entre 5 et 6 ?
De quelle réaction s'agit-il ?
Donner la structure du réactif B.
Le mélange brut de 5 et 6 issu de la réaction étudiée à la question précédente
est mis en
réaction en conditions d'épimérisation (conditions permettant l'inversion de
configuration
d'un centre stéréogène). Les proportions des deux aldéhydes 5 et 6 sont alors
inversées
pour atteindre à l'équilibre les proportions respectives de 17 % et 83 %.
10/15
Q26. Expliquer en quoi l'expérience décrite dans le paragraphe précédent permet
de
confirmer que la transformation de 4 en mélange de 5 et 6 est sous contrôle
cinétique.
Q27. Après séparation des stéréoisomères 5 et 6, le composé 5 est transformé en
7 par
action d'un réactif C. Identifier le couple d'oxydoréduction composé des
molécules 5
et 7. En déduire la nature de la réaction.
Proposer un réactif pour C.
Q28. Proposer des conditions opératoires permettant de transformer 7 en 8.
Le composé 8 réagit avec LiAIH4. Ce dernier réactif est un donneur d'hydrure H°
qui peut
réagir en tant que nucléophile.
Q29. Quel type de réaction a lieu lors de la formation de 9 ?
Donner le mécanisme de formation de 9 et l'ordre global de la réaction.
Justifier le choix du mécanisme.
Donner l'allure du profil énergétique de la réaction. On précisera les natures
de
l'abscisse et de l'ordonnée.
Q30. Lorsque la réaction précédente s'effectue sur un atome de carbone
asymétrique,
expliquer comment est régie la stéréosélectivité de la réaction.
Q31. On considère désormais la formation de la molécule 10 par réaction du
tétraoxyde
d'osmium sur 9. En considérant le méthyle porté par le cycle à 6 chaïnons comme
le
plus encombrant, donner la structure du composé 10 majoritairement formé en
précisant la stéréochimie des centres stéréogènes formés.
Après fonctionnalisation d'une fonction alcool de 10 par un groupement tosyle
(Ts), un
réarrangement permet d'obtenir le composé tricyclique 12. Finalement, la
réaction du
composé 12 avec un réactif E permet de former le (-)-aromadendrène 13.
Q32. Donner le réactif E.
PROBLÈME 4
Échange de ligands dans un complexe de coordination
Présentation générale
Les réactions de substitution de ligands revêtent une importance particulière
dans la
synthèse de complexes de coordination porteurs de propriétés optiques ou
magnétiques.
La stabilité thermodynamique ou l'inertie cinétique de ces complexes sont des
prérequis
nécessaires afin d'assurer leur intégrité sur le long terme en vue
d'applications
technologiques. La compréhension de la cinétique de réactions d'échange de
ligands et
de leur mécanisme a motivé les chimistes du XX" siècle et a participé aux
fondations du
domaine de la chimie de coordination depuis les travaux d'Alfred Werner sur les
complexes de cobalt(||l).
11/15
Abréviation Nom Formule
Phen 1,10-Phénantroline JON N\
TABLEAU 2 - Abréviation
Partie 1 - Cinétique d'hydrolyse d'un complexe de fer : [Fe(Phen):]*
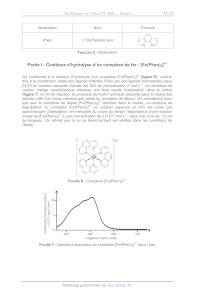
On s'intéresse à la réaction d'hydrolyse d'un complexe [Fe(Phen):]* (figure 6),
c'est-à-
dire à la substitution totale des ligands bidentes Phen par des ligands
monodentes aqua
(H20) en solution aqueuse d'acide fort HCI de concentration 2 mol-L'". Le
complexe de
couleur orange caractéristique présente une forte bande d'absorption dans le
visible
(figure 7). En fin de réaction, le complexe de Fe(il) hydrolysé présente dans
le visible des
bandes mille fois moins intenses que celles du complexe de départ. On
considérera donc
que seul le complexe de départ [Fe(Phen):]** absorbe dans le visible. La
cinétique de
dégradation du complexe [Fe(Phen):]* en solution aqueuse de HCI est suivie par
spectroscopie d'absorption, en mesurant au cours du temps l'absorbance d'une
solution
initiale de [Fe(Phen):]** à une concentration de 2,6:10* mol-L'", dans une cuve
de 1,0 cm
de longueur. On admet que la loi de Beer-Lambert est vérifiée dans les
conditions de
l'étude.
FIGURE 6 - Complexe [Fe(Phen):]°*
A
=
..--
GS
Ps
ss
RE
ss EUR
F --
E 9
-- mé
©Q
= =
oi ©
-- et
X © Sd)
D + -
e --
=
-- ame
st
_--
OE
=
9
4
--
D
© 0 I | Ï
NY
400 500 600 700
Longueur d'onde À (nm)
FIGURE 7 - Spectre d'absorption du complexe [Fe(Phen):]** dans l'eau
12/15
t (min) 3 6 9 12 15 18 21 24
Absorbance A | 0,93 0,80 0,72 0,65 0,58 0,51 0,46 0,41
TABLEAU 3 - Données de suivi spectrophotométrique de la cinétique de
décomposition du
complexe en solution aqueuse acide à 40 °C
Q33. À quelle longueur d'onde est-il judicieux d'enregistrer l'absorbance de la
solution ?
Justifier.
Q34. Donner l'équation bilan de la réaction de substitution de ligands étudiée
(sans tenir
compte des étapes mécanistiques impliquant H"°).
On suppose que la vitesse volumique de cette réaction de substitution de
ligands s'écrit :
v = k[H20]*[H*]F[[Fe(Phen):]?*]" (1)
Q35. En absence d'acide, la réaction est cinétiquement bloquée. Quel est le
rôle de l'acide
introduit ?
Q36. En tenant compte des conditions expérimentales, simplifier la loi de
vitesse (1) en
faisant apparaître une constante de vitesse apparente kapp.
Q37. Établir l'équation donnant la concentration en complexe [Fe(Phen):]** en
fonction du
temps, en supposant un ordre apparent de réaction de 1.
Q38. En modélisant les données du tableau 3 à l'aide d'une équation établie à
la question
précédente, vérifier que la réaction est d'ordre 1 par rapport au complexe
[Fe(Phen)3f* .
En déduire la valeur de la constante de vitesse apparente.
On donne dans le tableau 4 les constantes de vitesse apparentes déterminées
pour des
milieux réactionnels thermostatées à 25 °C, 30 °C et 35° C. On rappelle
T(K) = 273 + T(°C)
T (°C) 25 30 35 40
Kapp (S°) | 5,8:10° | 1,3:10* | 3,1:10* | Q38
TABLEAU 4 - Constantes de vitesse apparentes déterminées pour la réaction
d''hydrolyse
du complexe [Fe(Phen):]?* à 25 °C, 30 Cet 35° C
Q39. Calculer l'énergie d'activation de la réaction d'hydrolyse du complexe en
milieu
acide.
Partie Il - Diagramme énergétique d'un complexe de coordination
Les complexes de coordination de la 1% ligne du bloc d sont connus pour être
labiles avec
des réactions d'échange de ligands particulièrement rapides, de temps
caractéristique
inférieur à la seconde à 25 °C. Les ions Fe7* et Co" font figures d'exception
et se
distinguent par des complexes cinétiquement inertes. On se propose de
rationnaliser cette
particularité par l'étude de la structure électronique des complexes.
13/15
Q40. Établir la configuration électronique des ions Fe"* (Z = 26) et Co°* (Z =
27) dans leur
état fondamental.
On considère que le complexe [Fe(Phen):]* a une géométrie octaédrique. On
établit
désormais le diagramme d'orbitales frontalières d'un complexe modèle [FeLs]**,
avec L
ligand monodentate sigma donneur. On considèrera en première approximation les
seuls
recouvrements 6 entre les orbitales du métal et 6 orbitales de symétrie o des
ligands L. Le
diagramme d'orbitales est établi à partir des orbitales du métal 3d, 4s et 4p,
et des
orbitales de fragment Les (Y5, Po, Vs, Va, V5, Wé) en géométrie octaédrique
(document 4).
DOCUMENT 4 - Diagramme d'orbitales frontalières du complexe [FeLe]"* limité aux
recouvrements
*
-- Ag
*
-- -- -- |},
4p -- -- --
As --
Source : Les orbitales moléculaires dans les complexes, Yves Jean (2006,
éditions de l'école polytechnique)
Q41. À l'aide du document 4 identifier les orbitales de fragment (1, W2, Vs,
Va, Vs, Vo)
dont le recouvrement est non nul avec les orbitales 3d du métal. Pour ce faire,
recopier et compléter le tableau à double entrée suivant en indiquant dans
chaque
case "S" pour un recouvrement non nul et 0" pour un recouvrement nul.
14/15
Orbitales Orbitales Ligand
Métalliques | y, Po Ya Pa Pa Ye
d,y
dxz
dy
d,2
d,2_,2
Q42. Recopier la partie du diagramme d'orbitales frontalières (document 4) en
se limitant
aux orbitales 3d, aux orbitales de fragment (73, 2, Vs, Va, Vs, Vô) et aux
orbitales de
complexe t2 et ej", et ajouter les lignes de corrélations et le remplissage
électronique pour le complexe [FeLs]** dans l'hypothèse champ fort (bas spin).
Q43. En déduire la configuration électronique limitée aux orbitales
frontalières.
On considère désormais les recouvrements x au sein du complexe [Fe(Phen):]"*.
La Phen
étant un ligand x accepteur, l'interaction avec le système x des ligands est à
l'origine de la
stabilisation des orbitales t2,. Les orbitales t:,, qui sont non-liantes en ne
considérant que
le système 6, deviennent donc liantes en prenant en compte les recouvrements x.
Q44. Quel rôle joue le nombre d'électrons dans les orbitales t, dans la
stabilité du
complexe [Fe(Phen):]"* ?
En quoi la stabilité thermodynamique du complexe est à l'origine de son inertie
cinétique ?
ANNEXE 1
Donnée numérique
Constante des gaz parfaits : R = 8,31 J-mol'-K"
FIN
15/15