Mines Chimie PSI 2008
| Thème de l'épreuve | Le soufre |
| Principaux outils utilisés | thermochimie, cristallographie, structures de Lewis, solutions aqueuses, cinétique |
| Mots clefs | soufre, enthalpie de dissociation de liaison, blende, sulfure de carbone |
Corrigé
:👈 gratuite pour tous les corrigés si tu crées un compte
👈 l'accès aux indications de tous les corrigés ne coûte que 1 € ⬅ clique ici
👈 gratuite pour tous les corrigés si tu crées un compte
- - - - -
👈 gratuite pour ce corrigé si tu crées un compte
- - - - - - - - - - - - - - -
Énoncé complet
(télécharger le PDF)




Rapport du jury
(télécharger le PDF)
Énoncé obtenu par reconnaissance optique des caractères
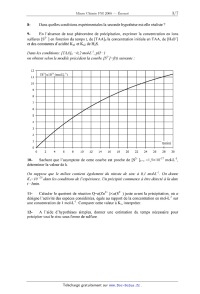
A 2008 Chimie PSI ECOLE NATIONALE DES PONTS ET CHAUSSEES. ECOLES NATIONALES SUPERIEURES DE L'AERONAUTIQUE ET DE L'ESPACE, DES TECHNIQUES AVANCEES, DES TELECOMMUNICATIONS, DES MINES DE PARIS, DES MINES DE SAINT-ETIENNE, DES MINES DE NANCY, DES TELECOMMUNICATIONS DE BRETAGNE. ECOLE POLYTECHNIQUE ( Filière TSI ). CONCOURS D'ADMISSION 2008 EPREUVE DE CHIMIE Filière : PSI Durée de l'épreuve : 1 heure 30 minutes L'usage d'ordinateur ou de calculatrice est interdit Sujet mis à la disposition des concours : Télécom SudParis (ex INT), ENSTIM, TPEEIVP. Les candidats sont priés de mentionner de façon apparente sur la première page de la copie : CHIMIE 2008-Filière PSI Cet énoncé comporte 7 pages de texte. Si au cours de l'épreuve, un candidat repère ce qui lui semble être une erreur d'énoncé, il le signale sur sa copie et poursuit sa composition en expliquant les raisons des initiatives qu'il est amené à prendre. DEBUT DE L'ENONCE LE SOUFRE Les données numériques nécessaires à la résolution du problème sont regroupées à la fin de l'énoncé. Le soufre est un élément chimique de la famille des chalcogènes, de symbole S et de numéro atomique 16. On le trouve dans beaucoup de minéraux (sulfures et sulfates) et même sous forme native, particulièrement dans les régions volcaniques. I. Structure électronique du soufre et de composés oxygénés du soufre. 1- Donner la structure électronique de l'atome de soufre dans l'état fondamental. On considère les espèces suivantes : SO3, SOCl2, SO42- , l'atome de soufre est l'atome central. 2- Proposer une structure électronique de Lewis pour chacune de ces trois espèces. Page 1/7 Tournez la page S.V.P. Chimie 2008 Filière PSI 3- Représenter leur géométrie d'après la méthode VSEPR. II. Structure cristalline de la blende. Le principal minerai de zinc est le sulfure de zinc ZnS de type blende. La blende, appelée aussi sphalérite, est la variété allotropique du sulfure de zinc qui cristallise dans le système cubique. 2+ 2Dans le cristal de blende ZnS, les ions Zn et S jouent des rôles symétriques. On peut ainsi décrire la maille de ce cristal comme constituée d'un réseau cubique à faces centrées d'ions S2- avec occupation de la moitié des sites tétraédriques par les ions Zn2+. 4- Dessiner la maille conventionnelle et donner la coordinence des ions Zn2+ et S2-. 5Donner la formule littérale de la masse volumique ! de la blende en fonction du paramètre a de la maille, de la constante d'Avogadro NA et des masses molaires du zinc M(Zn) et du soufre M(S). 6Calculer la plus petite distance entre les ions Zn2+ et S2- dans la structure blende en fonction du paramètre a de la maille. La comparer aux rayons ioniques donnés et interpréter ce résultat. III. Précipitation du sulfure de zinc. 2+ 2" Il est possible de précipiter ZnS dans l'eau selon la réaction Zn(aq ) + S(aq ) = ZnS( s) . On notera Ks la constante de solubilité correspondante. Afin de mieux contrôler la taille et la morphologie des particules de ZnS, on a recours à une précipitation dite homogène où l'on génère H2 S in-situ par décomposition à chaud de thioacétamide TAA en milieu acide selon la réaction globale: H3C C O H3O+ S + H3C H2O C + H2S NH2 NH2 La cinétique de décomposition suit une loi du type : " d [TAA] dt [ ] = k H 3O+ # [TAA] la constante cinétique k dépendant de la température selon une loi de type Arrhenius. Dans la suite nous ferons les hypothèses suivantes : - le milieu est chauffé instantanément à la date t=0 à la température de travail T0, qui reste fixe pendant toute l'expérience - [H3O+] peut être considéré comme constant pendant toute l'expérience. 7- A quoi sert la première hypothèse ? Dans quelle(s) condition(s) est-elle valide ? Page 2/7 Chimie 2008 -- Filière PSI 8- Dans quelles conditions expérimentales la seconde hypothèse est-elle réaliste ? 9- En l'absence de tout phénomène de précipitation, exprimer la concentration en ions sulfures [S2' ] en fonction du temps t, de [TAA]0 la concentration initiale en TAA, de [H30'] et des constantes d'acidité Ka1 et Kaz de HzS. Dans les conditions: [ TAA ]0 =0,2 mol--L'], pH =] on obtient selon le modèle précédent la courbe [S2' ] =f( t) suivante : ! . . . . . . . . . Â............" 0 2 4 6 8 1 0 1 2 14 16 1 8 20 22 24 26 30 10- Sachant que l'asymptote de cette courbe est proche de [S2' ]t:... =l,5><10'17 mol-L', déterminer la valeur de k. On suppose que le milieu contient également du nitrate de zinc 51 0,1 mol--L']. On donne KS=10 % dans les conditions de l'expérience. Un précipité commence à être détecté à la date t=3min. 11- Calculer le quotient de réaction Q=a(Zn2+ )>< a(Sz' ) juste avant la précipitation, où et désigne l'activité des espèces considérées, égale au rapport de la concentration en mol-L'1 sur . .1 \ - , une concentratmn de ] mol--L . Comparer cette valeur a KS, 1nterpreter. 12- A l'aide d'hypothèses simples, donner une estimation du temps nécessaire pour précipiter tout le zinc sous forme de sulfure. Page 3/7 Tournez la page S.V.P. Chimie 2008 Filière PSI IV. Détermination de grandeurs thermodynamiques relatives à des composés du soufre. A) On définit l'enthalpie standard de dissociation d'une liaison A-B comme étant l'enthalpie standard de la réaction :(A-B)gaz = Agaz + Bgaz , A et B représentant des atomes ou des groupes d'atomes. On peut alors relier les valeurs moyennes d'enthalpies standard de dissociation des liaisons à l'enthalpie standard d'une réaction en dissociant les molécules de réactifs en atomes dans une première étape puis en formant à partir de ces atomes les liaisons des molécules de produits dans une seconde étape. Nous nous proposons ici de calculer l'enthalpie standard de formation de COS à partir de données thermodynamiques sur CO2 et CS2. Le sulfure de carbone, de formule CS2, est un solvant chimique très toxique. C'est un liquide dense et volatil, avec un haut degré d'inflammabilité dans l'air et un point d'autoignition bas. 13Calculer l'enthalpie standard de formation du sulfure de carbone gazeux CS2, sachant que la chaleur latente massique de vaporisation de CS2 est de 360 J·g-1. 14Ecrire la formule de Lewis du sulfure de carbone et calculer l'enthalpie de dissociation de la liaison entre le carbone et le soufre dans cette molécule. 15Déterminer l'enthalpie de dissociation de la liaison entre le carbone et l'oxygène dans la molécule de dioxyde de carbone CO2. 16Déduire des résultats précédents l'enthalpie standard de formation de l'oxysulfure de carbone gazeux COS. B) Dans le schéma simplifié de la synthèse de l'acide sulfurique H2SO4, le réacteur catalytique est le siège de l'équilibre suivant : 2SO2 + O2 = 2SO3 Dans le domaine de température considéré, tous les composés sont gazeux et assimilés à des gaz parfaits. 17Calculer l'enthalpie et l'entropie standard de réaction à 298 K. Commenter les signes des deux valeurs obtenues. 18Exprimer l'enthalpie libre standard de réaction en fonction de la température, en supposant l'enthalpie et l'entropie standard de réaction indépendantes de la température. 19En déduire que la constante d'équilibre thermodynamique K° associée à l'équilibre étudié peut s'écrire sous la forme (avec T en Kelvin): lnK 0 = 2,38 "10 4 # 22,5 T 20Indiquer en les justifiant les conséquences respectives des actions suivantes sur l'équilibre étudié : - augmentation de la température à pression totale constante. Page 4/7 Chimie 2008 Filière PSI - augmentation de la pression totale à température constante introduction de diazote à température et pression constantes. V Teneur en SO2 d'un effluent gazeux. Le dioxyde de soufre (SO2) est un polluant atmosphérique. Pour lutter contre cette pollution on peut agir de manière préventive en diminuant la teneur en soufre des produits pétroliers mais aussi de manière curative en traitant les effluents (fumées et rejets industriels) avant leur libération dans l'atmosphère. On désire contrôler la teneur en SO2 dans l'effluent gazeux d'une cheminée. Le dioxyde de soufre étant très soluble dans l'eau, on fait barboter lentement un volume de 0,1 m3 d'air, prélevé à proximité de la sortie de la cheminée, dans 50 mL d'eau distillée de façon à obtenir 50 mL d'une solution aqueuse incolore de dioxyde de soufre. On réalise ensuite un dosage redox de cette préparation par une solution acidifiée de permanganate de potassium (K+, MnO4 ) de couleur violette et de concentration molaire volumique C1 = 2,5!10 3 mol·L-1. Le volume de la solution de permanganate de potassium versé pour obtenir l'équivalence est V1 = 12 mL. 21Ecrire les demi-équations pour les deux couples rédox concernés puis l'équation globale de la réaction intervenant lors du dosage. Comment repère-t-on l'équivalence ? 22Calculer le nombre de moles de SO2 par m3 de l'effluent gazeux analysé. Conclure en sachant que les normes européennes fixent une teneur maximale de 250 µg/m3. Page 5/7 Tournez la page S.V.P. Chimie 2008 -- Filière PSI Données : . . . 10 7 Approx1matmns numér1ques : «F % ? \/ä % Z \ \ \ __ _NN_NNN \ \ \ \ HHHHHHHHH \ \ O|--LwwAmm'u'oeîoææw'whmmuoeowæwwAw \ \ \ \ OOOOPOOOO \ _ , _ _ _ _ _ , _ _ _ _ _ _ _ _ _ _ _ ,-- m .] .. .. '. |- _ IIIIIIIÏEEI!IIIIIIIIIF llllllllllllfl!!lllll llllllllllllllhllll Numéros atomiques : Z(C) = 6, Z(C) = 8, Z(S) = 16 et Z(Cl) = 17 Masses molaires atomiques en g-mol'1 : M(C) = 12, M(C) = 16 et M(S) = 32 Constante des gaz parfaits : R = 8,31 J-K'l-mol'1 Page 6/7 ___--___-- ___--__-- f(X)=|...X ---------E _-------n-- ___--m--- ------_---- --VA------ "__---- ___---- Chimie 2008 Filière PSI Constante de Nernst à 298 K : ln10 ! RT = 0, 06 V F Structure de la blende : paramètre de maille a = 540 pm rayons ioniques r(Zn2+ ) = 74 pm et r(S2 ) = 184 pm Enthalpies molaires de formation en kJ·mol-1 à 298 K : CS2 (l) 88 C (g) 717 CO2 (g) - 393 O (g) 249 S (g) 277 Données thermodynamiques à 298 K : -1 "fH° (kJ.mol ) S° (J.K-1.mol-1) SO2 (g) - 297 248 O2 (g) 0 205 SO3 (g) - 396 257 Potentiels standards E° à 298 K (à pH = 0) : E°(MnO4 / Mn2+ ) = 1,51 V et E°(SO42 / SO2) = 0,17 V FIN DE L'ENONCE Page 7/7 Tournez la page S.V.P.