Mines Chimie PSI 2020
| Thème de l'épreuve | Le gadolinium |
| Principaux outils utilisés | cristallographie, solutions aqueuses, oxydoréduction, thermodynamique, mélanges binaires |
| Mots clefs | gadolinium, diagramme binaire, rendement faradique |
Corrigé
:👈 gratuite pour tous les corrigés si tu crées un compte
👈 l'accès aux indications de tous les corrigés ne coûte que 1 € ⬅ clique ici
👈 gratuite pour tous les corrigés si tu crées un compte
- - - - - - - - - - - - - - - - -
👈 gratuite pour ce corrigé si tu crées un compte
- - -
Énoncé complet
(télécharger le PDF)




Rapport du jury
(télécharger le PDF)

Énoncé obtenu par reconnaissance optique des caractères
A2020 --- CHIMIE PSI
Cm
Concours commun
Mines-Ponts
ÉCOLE DES PONTS PARISTECH,
ISAE-SUPAERO, ENSTA PARIS,
TÉLÉCOM PARIS. MINES PARISTECH.
MINES SAINT-ÉTIENNE, MINES NANCY,
IMT ATLANTIQUE, ENSAE PARIS, CHIMIE PARISTECH.
Concours Centrale-Supélec (Cycle International),
Concours Mines-Télécom, Concours Commun TPE/EIVP.
CONCOURS 2020
ÉPREUVE DE CHIMIE
Durée de l'épreuve : 1 heure 30 minutes
L'usage de la calculatrice et de tout dispositif électronique est interdit.
Les candidats sont priés de mentionner de façon apparente
sur la première page de la copie :
CHIMIE - PSI
L'énoncé de cette épreuve comporte 8 pages de texte.
Si, au cours de l'épreuve, un candidat repère ce qui lui semble être une erreur
d'énoncé, il le signale sur sa copie et poursuit sa composition en expliquant
les
raisons des initiatives qu'il est amené à prendre.
À 2020 CHIMIE PSI
DEBUT DE L'ENONCE
Le gadolinium
Des données utiles pour la résolution du problème sont fournies à la fin de
l'énoncé.
Le gadolinium est l'élément de numéro atomique Z(Gd)-64. Le gadolinium à l'état
métallique
et certains de ses alliages sont utilisables comme absorbants neutroniques dans
l'industrie
nucléaire et pour la réfrigération magnétique, tandis que Gd* est employé comme
agent de
contraste en IRM et dans la composition de matériaux pour les lasers ou les
piles à
combustible.
À) L'ion Gd',
La structure électronique de l'atome de gadolinium dans l'état fondamental est:
[Xe]4f"5d'6s°.
1- Indiquer quelle devrait être la configuration électronique de l'atome de
gadolinium
suivant les règles usuelles de remplissage des orbitales atomiques.
2- Justifier le fait que l'ion Gd*' soit le cation le plus fréquemment observé
du
gadolinium.
On considère la transformation chimique entre les ions Gd* et une espèce
chimique L
anionique ou neutre appelée ligand, qui peut être modélisée par une réaction
d'équation
xG#*+yL" =[GdL,]*"#. Cette réaction est dite "réaction de complexation" et
l'espèce
[GdL,]"# est appelée "complexe"!
Les ions G@* n'absorbent pas les photons du domaine UV-visible et ne peuvent
donc pas être
dosés directement par spectrophotométrie UV-visible. Toutefois il existe des
ligands, comme
le chrome azurol S, avec lesquels les ions Gd* forment des complexes colorés
dont le spectre
d'absorption UV-visible est très différent de celui des ligands seuls. La
réaction de
complexation avec le chrome azurol S permet ainsi le dosage des ions G#*.
Le chrome azurol S, qu'on notera H,Ch pour simplifier, est un tétra-acide. La
première
acidité est forte dans l'eau, les trois autres constantes d'acidité valent :
PKai = 2,2 ; PKa2 = 4,7 ; pKa3 = 11,6
3- Tracer le diagramme de prédominance des différentes espèces acido-basiques du
chrome azurol $S en fonction du pH.
On suit, par spectrophotométrie UV-visible, la formation d'un complexe
[Gd:{HCh),]*°? par
addition progressive de nitrate de gadolinium (HI) à une solution de chrome
azurol S
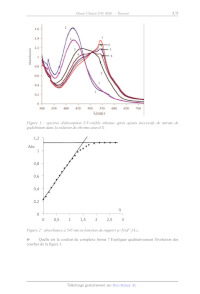
tamponnée à pH 5,9. La figure 1 donne une série de spectres enregistrés après
des additions
successives de nitrate de gadolinium, la courbe n°1 correspondant au chrome
azurol S seul.
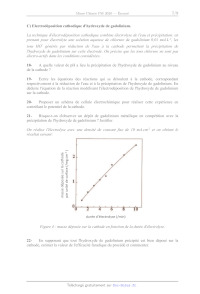
La figure 2 donne l'absorbance de la solution à 545nm en fonction du rapport
g3=[G#*]/Cx,
avec [G#*] concentration totale en gadolinium et C1 concentration totale en
chrome azurol S
sous toutes ses formes, soit la concentration initiale apportée en négligeant
les effets de
dilution.
Page 1/8
Chimie 2020 - Filière PSI
1.6 -
Absorbance
300 350 400 450 500 550 600 650 700
14nm )
Figure 1 : spectres d'absorption UV-visible obtenus après ajouts successifs de
nitrate de
gadolinium dans la solution de chrome azurol S.
1,2 = #
Abs x
0,4 -
0,2 -
O0 I I I I I |
0 0,5 1 1,5 2 2,5 3
Figure 2 : absorbance à 545 nm en fonction du rapport g9=[Gd#*]/Cr.
_ Quelle est la couleur du complexe formé ? Expliquer qualitativement
l'évolution des
courbes de la figure 1.
Page 2/8
Chimie 2020 - Filière PSI
On note &. le coefficient d'absorption molaire du ligand et & celui du
complexe, pour une
longueur d'onde de 545 nm. On considère que la réaction de formation du
complexe est
quantitative.
5- Ecrire l'équation de la réaction de formation du complexe [Gd;(HCh)},*".
Lorsque le
ligand est en excès, exprimer l'absorbance A de la solution à 545 nm en
fonction de er, £&c, CL,
q, x, y et la longueur de la cuve |.
6- À partir de la figure 2, expliquer comment obtenir la relation entre x et y
et la donner.
En réalité les ions H° interviennent dans la complexation, l'équation de la
réaction de
formation du complexe s'écrit alors :
xGE*+yHCh+zH* = [Gd(HCh), HV
On note K,»-. sa constante d'équilibre.
On appelle Cr la concentration totale en chrome azurol S (et donc sa
concentration initiale)
et «à le taux de formation du complexe, défini par le rapport de la
concentration en complexe
sur Sa concentration si la transformation était totale (01235°C, 0
désignant la température. La phase f est une structure de type cubique centrée
: la maille
élémentaire est un cube avec un atome au centre et un atome à chaque sommet. Le
paramètre
de maille est a=406 pm.
9- Donner la coordinence du gadolinium dans la phase f.
10- Donner l'expression de la masse volumique de la phase B en fonction du
paramètre de
maille et de la masse molaire du gadolinium.
Page 3/8
Chimie 2020 - Filière PSI
11- Exprimer le rayon atomique r du gadolinium dans la phase G en fonction du
paramètre
de maille et déterminer sa valeur. Vérifier la cohérence avec la valeur de
référence fournie en
annexe.
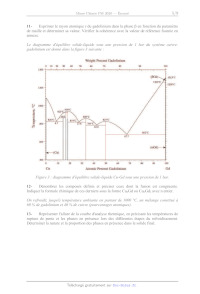
Le diagramme d'équilibre solide-liquide sous une pression de 1 bar du système
cuivre-
gadolinium est donné dans la figure 3 suivante :
Weight Percent Gadolinium
o 100
1400
+ - 1M13°C
L 1235°C
1200 - L
D 1000 - e
aÿ 4 L
_
Z
cé
8
E 800 - É
F
AN) E ne
] (GG) ----%f
Le (Cu)
400 ro er FPT Er PREMIERE EE PERRET CAE TETE PTE
o 10 20 30 40 50 60 70 80 90 100
Cu Atomic Percent Gadolinium Gd
Figure 3 : diagramme d'équilibre solide-liquide Cu-Gd sous une pression de I
bar.
12- Dénombrer les composés définis et préciser ceux dont la fusion est
congruente.
Indiquer la formule chimique de ces derniers sous la forme Cu:Gd ou Cu1Gd2 avec
n entier.
On refroidit, jusqu'à température ambiante en partant de 1000 °C, un mélange
constitué à
60 % de gadolinium et 40 % de cuivre (pourcentages atomiques).
13- Représenter l'allure de la courbe d'analyse thermique, en précisant les
températures de
rupture de pente et les phases en présence lors des différentes étapes du
refroidissement.
Déterminer la nature et la proportion des phases en présence dans le solide
final.
Page 4/8
Chimie 2020 - Filière PSI
On admet que l'équation suivante est vérifiée pour le liquidus dans la zone des
fractions
molaires en gadolinium x élevées :
x = Le [1 - 4
RTf T
avec AssH° l'enthalpie standard de fusion du gadolinium et T; sa température de
fusion à
pression atmosphérique. Afin de simplifier la question suivante, on fera comme
s'il n'existait
qu'une seule phase solide du gadolinium et on considèrera que le liquidus est
une droite entre
le point eutectique et x=1.
14- Exprimer la valeur de la pente du liquidus à x=1 et en déduire une valeur
approchée de
AnsH°. Vérifier la cohérence de cette valeur avec les données en annexe.
Le gadolinium est principalement extrait de la monazite, un phosphate mixte de
lanthanides et
de thorium, sous forme d'oxyde Gd:03 après de multiples séparations impliquant
des
techniques d'échange d'ions. L'oxyde est transformé en fluorure ou chlorure
avant d'être
réduit à l'état métallique. Le chlorure est préparé en passant par une étape
intermédiaire au
cours de laquelle il se forme un chlorure mixte (NH4)2/GdCls] par chauffage à
230 °C de
l'oxyde Gd203 en présence de chlorure d'ammonium, sel qui se sublime à 338 °C.
15- Ecrire l'équation modélisant la formation du chlorure mixte (NH4)[GdCls],
sachant
que les autres produits de la réaction ne contiennent n1 gadolinium n1 chlore.
Le chauffage de ce chlorure sous vide au-dessus de 350 °C permet d'obtenir
GdCl3; sous
forme anhydre. Le gadolinium étant un métal très électropositif, seuls quelques
métaux
peuvent être utilisés pour réduire GdCl:. Le calcium peut effectuer cette
réduction selon
l'équation-bilan :
2GdCl:+3Ca=2Gd+3CaCl.
La réaction a lieu sous atmosphère d'argon dans un creuset en tantale avec un
léger excès de
calcium. La température de réaction est de l'ordre de 1350 °C. Après
refroidissement et
lavages à l'eau, le bloc de métal obtenu est chauffé à nouveau -brièvement- par
induction à
1350 °C sous vide de 0,1 Pa. On précise que la solubilité du calcium solide
Ca(s) dans le
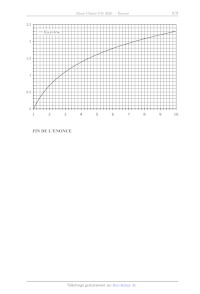
gadolinium solide Gd(s) est très faible (<0,2 %). Les températures pour atteindre une pression de vapeur saturante de 0,1 Pa sont respectivement 790 K pour le calcium et 1680 K pour le gadolinium. 16- Réécrire l'équation de la réaction modélisant la réduction de GdCl; en faisant apparaître les états physiques des constituants. Evaluer, à l'aide des données et d'approximations éventuelles, l'enthalpie libre standard de réaction à 1350 °C. Commenter la valeur obtenue. 17- Quel est le rôle de la dernière étape de chauffage bref et sous vide ? Page 5/8 Chimie 2020 - Filière PSI C) Electrodéposition cathodique d'hydroxyde de gadolinium. La technique d'électrodéposition cathodique combine électrolyse de l'eau et précipitation: en prenant pour électrolyte une solution aqueuse de chlorure de gadolinium 0,01 mol.L'|, les ions HO générés par réduction de l'eau à la cathode permettent la précipitation de l'hydroxyde de gadolinium sur cette électrode. On précise que les ions chlorure ne sont pas électro-actifs dans les conditions considérées. 18- À quelle valeur de pH a lieu la précipitation de l'hydroxyde de gadolinium au niveau de la cathode ? 19- Ecrire les équations des réactions qui se déroulent à la cathode, correspondant respectivement à la réduction de l'eau et à la précipitation de l'hydroxyde de gadolinium. En déduire l'équation de la réaction modélisant l'électrodéposition de l'hydroxyde de gadolinium sur la cathode. 20- Proposer un schéma de cellule électrochimique pour réaliser cette expérience en contrôlant le potentiel de la cathode. 21- Risque-t-on d'observer un dépôt de gadolinium métallique en compétition avec la précipitation de l'hydroxyde de gadolinium ? Justifier. On réalise l'électrolyse avec une densité de courant fixe de 10 mA.cm*° et on obtient le résultat suivant: o TD SE 2| LE © OL & © -- = © n YU = # g'u OU 8 1} SO : D À UD © D = S & E © il) 4 f 1 1 L L L 1 2 4 6 8 10 durée d'électrolyse (/min) Figure 4 : masse déposée sur la cathode en fonction de la durée d'électrolyse. 22- En supposant que tout l'hydroxyde de gadolinium précipité est bien déposé sur la cathode, estimer la valeur de l'efficacité faradique du procédé et commenter. Page 6/8 Chimie 2020 - Filière PSI Données : Numéro atomique du gadolinium : Z(Gd)-64 Masses molaires atomiques : M(Gd)-157,25 g.mol'! ; M(O)-16 g.mol'! Rayon atomique du gadolinium mesuré selon la diffraction des rayons X: r(Gd)-180 pm Constante d'Avogadro : Na= 6,0.10°* mol! Constante des gaz parfaits : R= 8,3 J.K'!.mol'! Constante de Faraday : F= 96500 C.mol'! à 298 K : m0 = 0,06V Enthalpies standard de formation et entropies standard (à 298 K), températures de fusion ou vaporisation, masses volumiques des solides AfH° (k].mol!) | Sx (J.K'!mol!) To (K) p (kg/m*) Ca(s) 0 42 1112 1500 Ca(l) e 50 1757 Ca(g) 178 155 - - CaCl(s) -796 104 1045 2200 CaCl(1) 168 131 >2000
Gd(s) 0 68 1585 7900
Gd(1) 10 74 >2000 -
GdCl:(s) _1008 151 875 4500
GdCl:(1) -967 198 1853
To représente la température de fusion pour un solide, de vaporisation pour un
liquide.
Produit de solubilité Ks de l'hydroxyde de gadolinium à 298 K:
Gd(OH)3, =Gd** +30H° Ks=2.107*
Potentiel standard du couple Gd**/Gd à 298 K:
E°(Gd**/Gd) = -2,40 V (à 25 °C et pH--0)
. 10 7
Approximations numériques : 2 = 7 \3 = 4
Page 7/8
Chimie 2020 - Filière PSI
FIN DE L'ENONCE
Page 8/8