CCINP Physique 2 PSI 2007
| Thème de l'épreuve | Autour de la mesure de la vitesse. Les divers procédés de nickelage. |
| Principaux outils utilisés | ondes sonores, électronique, mécanique des fluides, thermochimie, électrochimie, atomistique |
| Mots clefs | effet Doppler, traitement du signal, écoulement de Poiseuille cylindrique, nickelage, passivation, piles, dépôt électrochimique |
Corrigé
:👈 gratuite pour tous les corrigés si tu crées un compte
👈 l'accès aux indications de tous les corrigés ne coûte que 1 € ⬅ clique ici
👈 gratuite pour tous les corrigés si tu crées un compte
- - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - -
👈 gratuite pour ce corrigé si tu crées un compte
- - - - - - - - - - - - - - - - - - - -
Énoncé complet
(télécharger le PDF)












Rapport du jury
(télécharger le PDF)

Énoncé obtenu par reconnaissance optique des caractères
WOH5OÉ .--v " 0@H5ñ--...
« ...ËOOEËE
...mm ËH--A--h .. OEDOËËOHÆOE HËËAN
......=a.z=v...-->dooe ...::lzou mu=0uzcu
'
Les calculatrices sont autorisées.
***aa
N.B.----: Le candidat attachera la plus grande importance à la clarté, & la
précision et à la concision
de la rédaction. Si un candidat est amené à repérer ce qui peut lui sembler
être une erreur
d'énonce', il le signalera sur sa copie et devra pourSuivre sa composition en
expliquant les raisons
des initiatives qu'il a été amené à prendre.
***a*
L'épreuve comporte un problème de physique et un problème de chimie. Les
candidats traiteront les
deux problèmes dans l'ordre de leur choix et les rédigeront de façon séparée.
Le sujet comporte 12
pages et un document réponse de 2 pages à joindre àla copie.
Durées approximatives : Physique : 2 heures
Chimie : 2 heures
PROBLEME DE PHYSIQUE
AUTOUR DE LA MESURE DE VITESSE
Les trois parties de ce probléme sont indépendantes. Au sein d'une même partie,
plusieurs questions
sont largement indépendantes. Un formulaire se trouve en fin de problème.
PARTIE I : Célérité des ondes acoustiques et effet Doppler
. Soit (R) m (0, x, y, z) le référentiel d'étude supposé galiléen, et (R')
«**--« (O', x', y, 2) un autre
référentiel, en translation uniforme àla vitesse 2320 == uoêx par rapport au
référentiel (R). A la date
t x 0, le point O' coïncide avec le point 0. On suppose de plus, que no << c0 , 'où co est la vitesse de propagation du son. On remarquera qu'en l'absence d'onde sonore, l'air est au repos dans le référentiel (R) et en écoulement uniforme à la vitesse --iïo dans le référentiel (R'). Dans toute cette partie, l'air est assimilable à un gaz parfait non visqueux. Les transformations thermodynamiques sont supposées adiabatiques et réversibles. On note Po et po, la pression et la masse volumique de l'air au repos (pg == 1,25 kg.m'3 et P0 = 105 Pa). 1l1fl On note XS le coefficient de compressibilité isentropique de l'air (XS = 6,8 10'6 Pa'l). L'effet de la pesanteur sera négligé. Σ. C V constante des gaz parfaits R = 8,31 J K"1mol'1 et la masse molaire de l'air M = 29 g mol'1 . On donne : le rapport 7 = = 1,4 des capacités thermiques à pression et à volume constants, la A] Ondes sonores dans le référentiel (R) : On se propose d'étudier la propagation unidirectionnelle des ondes sonores planes. Après une perturbation élémentaire, les caractéristiques de l'air sont alors décrites par les grandeurs suivantes, fonction de la position x et du temps t : v(x, t) : la vitesse de l'air (dirigée suivant ëX ), P(x, t) : P() + p(x, t) la pression de l'air, p(x, t) : po + ,u(x, t) la masse volumique de l'air. -A.1) Rappeler en quoi consiste l'approximation acoustique. A.2.a) Ecrire l'équation vectorielle d'Euler (on notera El l'équation correspondante). A.2.b) Simplifier cette équation dans le cadre de l'approximation acoustique. On notera E2 l'équation correspondante. ' A.3.a) Ecrire l'équation locale de conservation de la masse ou équation de continuité (E3). A.3.b) Simplifier cette équation dans le cadre de l'approximation acoustique. On notera E4 l'équation correspondante. A.4.a) Rappeler l'expression de XS en fonction de V (le volume) et de P (la pression), puis en fonction de p (la masse volumique) et P, ou de leurs dérivées partielles, on notera Es l'expression correspondante. ' A.4.b) Simplifier cette équation dans le cadre de l'approximation acoustique. On notera E6 l'équation correspondante. A.5.a) En déduire l'équation de propagation de l'onde acoustique vérifiée par la grandeur p(x, t). A.5.b) Quelle est l'expression et la valeur numérique de la célérité co des ondes acoustiques dans l'air à la température TO = 298 K? A.6) Pour modéliser une onde sonore plane progressive sinusoïdale (O.S.P.P.S.), se propageant suivant les x croissants, on adopte les notations suivantes pour lesquelles les fonctions complexes associées aux grandeurs sinusoïdales réelles sont soulignées : j(wt--kx) £(JC, [) : pOe j(wt-kx)ê 3206» t) = }:(x, 0%. = Voe x Etablir la relation de dispersion liant ou et k. B] Ondes sonores dans le référentiel (R') et effet Doppler simple : On décrit une onde sonore dans le référentiel (R') par les grandeurs suivantes, fonction de la position x' et du temps t : P '(x ', !) =--= R, + p'(x ', t) la pression de l'air, V'(x',t) = ----uo + v'(x ', t) la vitesse du fluide, ' p'(x',t) = p() + y'(x',t) la masse volumique de l'air. On remarquera que dans cette étude, l'opérateur [I7 '. g?ad ] s'écrit : [(v'------ u0) %x ,] . . B.1) - Préciser dans le cadre de l'approximation acoustique : quelles sont les grandeurs supposées comme infiniment petites du premier ordre ? On supposera par la suite, que leurs dérivées partielles sont aussi des infiniment petites du premier ordre. B.2) On rappelle que l'équation (E'3) traduisant l'évolution isentropique des particules de fluide Dp' DP' D s'écrit: ------------------ ---- p '------------zs ----------- est la dérivée particulaire. Dt Dt Dt Etablir deux autres équations aux dérivées partielles, notées E'1 et E'2 couplant les trois grandeurs P'(x',t), V'(x',t) et p'(x',t). ' B. 3. a) En effectuant une linéarisation (développement limité al' ordre 1), comm 1 équation E'4 entre et) âv 'ôp' les grandeurs --------------- ------------- et ôx' ôt Ôx' B. 3. b) De même, déterminer la relation E' 5 entre les grandeurs êÏ----, ---ô--E-- et tÊE----. ôx' ôx' ôt B.3.c) Enfin, déterminer la relation E'6 entre les grandeurs ÊE-- ,--ô--Ï--, êË----, ÊE----. - ôx' ôt ôx' ôt B.4) Pour modéliser l'O.S.P.P.S.dans le référentiel (R'), on adopte les notations suivantes pour lesquelles les fonctions complexes associées aux grandeurs sinusoïdales sont soulignées : £'(X',Ï) : pûej(w't--k'x') v î'(x' t) = v'(x' t)ë : v' ej(w't'k'x')ê .... ' _ ' x 0 x ,U'(X',Ï) : flvo ej(w't--k'x') B.4.a) Comment se simplifient les équations E'4, E'5, E'6 avec les notations complexes proposées ici '? On notera E'7, E'g et E'g les équations correspondantes. B.4.b) Par élimination, en déduire l'équation vérifiée par p'(x ', t), puis la relation de dispersion reliant oe', k ' , c0 et u0 . Cette relation est--elle compatible avec celle obtenue à la question A.6) ? CO B.4.c) En remarquant que k et k' sont positifs, en déduire que k' = . co ---- u0 B.5.a) Justifier que le champ de pression est indépendant du référentiel galiléen dans lequel on travaille. B.5.b) Quelle relation existe--t--il entre x,x', uo et t '? B.5.c) En déduire une relation simple entre k et k', puis exprimer 00 en fonction de (D', k' et uo . B.5.d) En notant f la fréquence de l'onde sonore dans le référentiel R, et f' la fréquence de l'onde sonore dans le référentiel R', déterminer la relation liant f, f", uo et co. Fait expérimental : B.6.a) Pourquoi un piéton, marchant en avant sur la voie de droite, perçoit-il un changement de tonalité de l'onde sonore émise par une automobile au moment où celle-ci le double ? B.6.b) Soit fe la fréquence de l'onde sonore émise par l'automobile dans le référentiel lié à celle--ci. Déterminer les deux fréquences fp2 et fp1 de l'onde sonore reçue par le piéton, respectivement après et avant son dépassement par l'automobile. On exprimera ces deux fréquences en fonction de fc, co et de la vitesse v de l'automobile par rapport au piéton. La nouvelle tonalité est--elle plus grave ou plus aiguë après le dépassement qu'auparavant ? $ PARTIE II : Double effet Doppler, application au radar Rappel sur l'effet Doppler simple : E R ------------------------------------------------>
O _ x
On considère un émetteur E, fixe à l'origine de l'axe Ox, qui délivre une onde
ultrasonore
plane progressive sinusoïdale, de fréquence fE , se propageant à la célérité
co, dans le sens des x
positifs.
On rappelle qu'un récepteur R, situé en avant de E, qui se déplace le long de
l'axe Ox, à la vitesse
v > O, perçoit une onde de fréquence f,, : fE (1 ----Y--) .
Co
A] Double effet Doppler :
On considère ici un émetteur E et un récepteur R, immobiles au même point O. On
s'intéresse au changement de fréquence entre l'onde émise à la fréquence fE et
l'onde reçue à la
fréquence fR, après réflexion sur une cible C, située en avant de O et qui se
déplace à la Vitesse
v>0, sur cet axe, avec v << co . 0 x ...... E,R C En remarquant que tout se passe comme si R était l'image de E, par la symétrie de centre le 'miroir cible' C, déterminer l'expression liant fE, fR , co et v. B] Principe du radar Doppler, traitement du signal : On assimile l'onde issue de l'émetteur au signal électrique : SE (1) : EO sin(wEt ------ $) et l'onde perçue par le récepteur au signal électrique : s,, (t) = R0 sin(th) . Le signal sR(t) est d'abord mis en forme par un comparateur simple utilisant un amplificateur opérationnel parfait, de tension de saturation :L-V sat' Le signal sc(t), issu de ce comparateur et le signal sE(t) sont ensuite envoyés dans un multiplieur. , Le signal sm(t), issu du multiplieur est ensuite filtré puis envoyé dans un compteur. ' sm t _ s t N On rappelle qu' un multiplieur attaqué par deux signaux s1(t) et sz(t) délivre un signal s...(t)== k*sl(t)*sz(t) où k est une constante multiplicative égale' a 0.1 VI. Le fonctionnement simplifié d'un compteur est le suivant . une initialisation permet de le mettre à zéro. Le compteur est ensuite incrémenté de 1 à chaque fois que le signal sF(t) passe au-dessus d'une tension critique positive Vc choisie au préalable. La durée de comptage choisie est de To secondes avec To >> l/fg.
B.l.a) Quelle est l'utilité du comparateur '?
B.l.b) Sur un même graphe, dessiner l'allure du signal sR(t) et du signal
sortant du comparateur
sc(t).
B.2) Effectuer une décomposition en fréquence du signal s...(t) (Série de
Fourier), puis représenter
l'allure de son spectre.
B.3.a) Quel type de filtre permet de ne conserver que la composante à la
fréquence fg-fR du signal
issu du multiplieur '?
B.3.b) Proposer une réalisation simple de ce filtre, n'utilisant que des
composants passifs, et
préciser sous forme d'une ou plusieurs inégalités les contraintes que doivent
respecter les
composants utilisés pour réaliser la fonction désirée.
B.4) Montrer que la valeur N, fournie par le compteur est proportionnelle à la
vitesse v de la cible
C, pourvu que la tension critique Vc soit inférieure à une tension maximale
V......
On exprimera le coefficient de proportionnalité q, tel que N = q*v, en fonction
de To, fg et co et on
précisera la valeur de la tension maximale Vmax en fonction de Vsat, k et E0.
PARTIE III : Mesure de la vitesse mo enne d'écoulement d'un fluide vis ueux
Le capteur de vitesse est constitué d'un tube cylindrique d'axe Oz, de diamètre
2a, dans lequel
s'écoule en régime permanent, le fluide incompressible de masse volumique p et
de viscosité
n connue. Soit AP = P1-P2 la différence de pression entre deux sections 81 et
82 du tube, située
autour des points 01 et 02 de côte 21 et 22, et distantes de 0102 = L. On
rappelle que la densité
volumique de force de viscosité s'écrit nAîz' . On négligera les forces de
pesanteur. Le référentiel
d'étude est supposé galiléen.
A.1) On suppose que l'écoulement est laminaire et s'effectue suivant êz. Quelle
hypothèse nous
conduit à chercher iî sous la forme ?: v(r,z)êz et P sous la forme P(r,z) '?
A.2) Montrer que l'expression de la vitesse v(r,z) est indépendante de z et ne
dépend donc que
de r.
B.1) En appliquant le principe fondamental de la dynamique ou équation d'Euler,
montrer que P
ne dépend que de z et que : _
dz r dr dr
B.2) Préciser les conditions aux limites qui permettent de déterminer P(z) et
v(r).
)] : K1 où K1 est une constante.
B.3) Exprimer v(r) et P(Z) en fonction de P], AP, n, L, a, r et 2.
Cl) Montrer que le débit volumique peut se mettre sous la forme Dç = K2 AP, où
K2 est une
constante que l'on exprimera en fonction de a, L et n. ,
. . . D '
C.2) On définit la Vitesse moyenne du lubrifiant par V,... = " montrer que v...
= K3 AP, ou
29
m1
K3 est une constante que l'on exprimera en fonction de a, L et n.
C.3) Quel instrument est encore nécessaire pour accéder à la vitesse moyenne de
l'écoulement '?
FORMULAIRE :
On donne la décomposition en série de Fourier d'un signal carré c(t) de
fréquence f, dont
l'amplitude varie entre -E et +E :
4E °° sin 2 +127z t
75 p=0 2p+1
On donne en coordonnées cylindriques :
div(Ü) : ------ ' --------------------- +
ôr r 59 62
rat(ç)= 3-- ÔVZ ---Y--"--ê-- ê + avr--ô": ê +1 ô("9)--ô"r ê
r 66 r 0 z
_. ôU.. 15U.. ÔU...
"" d U ==-------------e +=---------------- +-------e
gra ( ) ôr r r6969 ô'z :
ô(rÊY--j 2
_l_ ôr 8 v __
+--------EUR.
[r ôr 522 Z
1 ô(rv ) 1 ôvEUR ôvz
r
Pour 5 : v(r,z)ê}; on & Ai; :
PROBLEME DE CHIMIE
LES DIVERS PROCEDES DE NICKELAGE
Toutes les données nécessaires à la résolution de ce problème apparaissent en
fin d'énoncé. Sauf
indication contraire, la température est fixée à 298 K.
1. La pile fer-nickel
On souhaite vérifier la valeur du potentiel redox standard du couple Ni2+(aq)/
Ni(S) donné par la
littérature. '
Pour ce faire, on dispose d'une électrode constituée d'un fil de nickel
métallique de très haute
pureté, d'une solution aqueuse de sulfate de nickel (II) de concentration 1,00
mol.L"', d'une
électrode de référence au sulfate mercureux (MSE pour Mercury Sulfate
Electrode) dont le potentiel
est fourni dans les données numériques et d'un voltmètre de précision de très
grande impédance
d'entrée. On précise que les ions sulfate sont électro-inactifs dans de telles
solutions aqueuses peu
concentrées. '
1.1. Quelle différence de potentiel doit--on relever entre les deux électrodes
partiellement immergées
dans la solution ?
|
1.2. On réalise maintenant une pile Ni(s) | NiSO4(aq) : F eSO4(aq) | Fe(s). Les
solutions aqueuses utilisées
ont une molarité de 0,01 mol.L_l. Elles sont séparées par une paroi poreuse.
Calculer et comparer les potentiels redox des deux couples ion métallique/métal
mis en jeu,
exprimés par rapport à l'électrode standard à hydrogène (ESH). Ecrire les deux
demi-réactions
redox qui interviennent, dans le sens où elles se produisent quand la pile
débite du courant.
1.3. Quelle différence de potentiel en circuit ouvert mesure-t--on aux bornes
de cette pile ?
1.4. F aire un schéma de la pile en y portant les signes des pôles (+ ou --)
ainsi--que leur nom (cathode
ou anode). On indiquera le sens de circulation des électrons quand la pile
débite.
1.5. Ecrire le bilan de la réaction chimique mise en jeu quand la pile débite.
Calculer l'affinité
chimique de cette réaction. Commenter son signe.
1.6. Une réaction parasite, gênant le fonctionnement de cette pile, provient du
fait que le cation F e2+
. . , . . . . . 3+ . .
est sensrble a 1 oxydation par le dioxygene dissous qui le transforme en P e .
Ecrire les deux dem1--
réactions mises en jeu et le bilan global redox de cette réaction parasite qui
intervient quand on ne
prend pas la précaution de travailler à l'abri de l'air.
II. Le nickelage par déplacement chimique
On prépare deux récipients distincts, l'un rempli d'une solution aqueuse de
NiSO4, l'autre d'une
solution aqueuse de F eSO4. On plonge dans le premier une lame de fer
métallique, dans le second
une lame de nickel métallique. On observe que la lame de fer se recouvre de
nickel métallique.
Cette opération est nommée « nickelage par déplacement ».
11.1. Pourquoi la lame de nickel ne se recouvre--t-elle pas de fer ?
11.2. Ce procédé de nickelage n'est utilisé que pour préparer des couches de
nickel très fines car on
observe que sa vitesse s'annule quand le dépôt de nickel compact atteint une
épaisseur de l'ordre de
quelques dizaines de nanomètres. Pourquoi ?
III. Le nickelage par électro-dépôt
Le dépôt électrochimique de nickel métallique est largement utilisé
industriellement. Ce procédé
consiste à immerger la pièce en fer à revêtir, dans une solution de sulfate de
nickel et à effectuer une
électrolyse, la pièce en fer étant placée en cathode. L'anode est inerte.
L'épaisseur de nickel déposé
n'est alors pas limitée; elle est fonction de la densité de courant, de la
durée de l'opération et de
l' intervention éventuelle o.. réactions eathodiques parasites.
Compte rendu d'expérience :
0 Pièce traitée : disque de fer, diamètre 10 cm, épaisseur 0,5 mm (épaisseur
négligée pour le
calcul de l'aire totale) ; dépôt sur les deux faces.
Masse initiale : 30,866 g
Intensité du courant : 2,4 A
Durée d'électrolyse : 65 mn
Masse finale : 32,051 g
111.1. Quelle est la quantité d'électricité mise en jeu au cours de cette
expérience '?
111.2. Quelle masse de nickel aurait-on dû obtenir si le rendement de
l'opération avait été 100 % '?
111.3. Déterminer le rendement effectif de cette opération de nickelage.
111.4. Quelle eSt l'épaisseur du dépôt de nickel obtenu ?
111.5. Quelle autre demi--réaction a pu se produire à la cathode en parallèle
avec la réduction de
Ni2+ conduisant' a la baisse du rendement ?
111.6. Cette autre demi-réaction conduit à l'insertion d'une partie de l'espèce
chimique formée dans
les sites interstitiels («lacunes ») du réseau cubique à faces centrées du
nickel. Rappeler les
géométries des deux types de sites interstitiels, les positionner sur le schéma
d'une maille et préciser
leur nombre par maille.
III.7. On emploie aujourd'hui souvent l'anion amidosulfate en lieu et place de
l'anion sulfate dans
les bains de nickelage par électro-dépôt. Cet anion est la base Conjuguée de
l'acide amidosulfurique
qui dérive de l'acide sulfurique H2804 par substitution d'un groupe --OH par un
groupe ----NH2.
Ecrire deux formules de Lewis de l'acide amidosulfurique, l'une sans séparation
des charges,
l'autre avec la séparation totale des charges.
IV. Dépôt chimique autocatalytique à l'hydrazine
Le procédé de nickelage chimique autocatalytique repose sur la réduction d'un
sel de nickel, non
par la polarisation électrique cathodique, mais par un réducteur chimique
ajouté à la solution
aqueuse, ici l'hydrazine HgN--NH2 ou N2H4. Ce procédé a été mis au point en
France à l'Office
National de la Recherche Aéronautique (ONERÀ).
IV. 1. Quelle est la formule de Lewis de l'hydrazine ? En vous aidant des
règles VSEPR, montrez
que cette molécule ne peut pas être plane et proposez une représentation
perspective de sa
conformation édipsée.
IV.2. A température ambiante, l'hydrazine pure est un liquide. Calculer son
enthalpie libre standard
de formation à 25°C et conclure quant à sa stabilité.
IV.3. On observe que l'hydrazine pure se décompose quand on la chauffe. Est--cé
dû à une raison.
thermodynamique ou à une raison cinétique '? Expliquez.
IV.4. La solution aqueuse d'hydrazine est une base N2H5+(aq) + OH"(aq).
Préciser le nom du cation de
cette base par analogie avec un autre cation de la chimie de l'azote.
IV.5. Ecrire la demi-réaction d'oxydation de N2H5+ générant le diazote gazeux
et appliquer la loi de
Nemst pour en déduire l'équation qui décrit l'évolution avec le pH du potentiel
redox du couple
N2/ N2Hs+ dans les conditions suivantes :
. [N2H5+]==10"3 mol.L"l
. P(N2) = 1 bar
IV. 6. La Figure 1 du document réponse présent; le diagramme potentiel-pH muet
du système
nickel- -eau à 25°C pour une concentration de Ni2+ égale à lO""4 mol. L_1. Y
porter les noms des
espèces de chaque domaine, en précisant selon le cas: « domaine d'existence
de.. .» ou « domaine
' de prédominance de. .» Identifier le couple redox correspondant a la droite
en pointillés. Placer la
courbe relative au couple N2 / N2H5+ dans les conditions précisées ci- dessus.
IV.7 . Déduire- graphiquement de ce diagramme :
o Le domaine de pH où le cation nickel (Il) est insensible à la précipitation
sous forme
d'hydroxyde de nickel (Il)
: le domaine de pH où le nickel métallique n'est pas oxydé par l'eau
0 le domaine de pH où le cation nickel (Il) est réductible par N2H5+
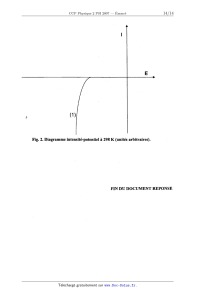
IV. 8. Le diagramme intensité--potentiel schématique de la Figure 2 du document
réponse, tracé à
pH= 4, présente la courbe (l) de réduction de Ni2+ (aq). Cette courbe n'est pas
modifiée quand on la
trace sur diverses électrodes (Ni, Fe, Pb, .) La courbe d'oxydation de N2H5
est, elle, fortement
dépendante de la nature de l'électrode. Cette oxydation est lente sur la
plupart des électrodes
métalliques, mais rapide sur une électrode de nickel (ce qui a fait appeler le
procédé
« autocatalytique »). Tracer sur ce diagramme, de façon schématique, la courbe
d'oxydation de
N2Hs+ dans les deux situations suivantes:
. Courbe (2) : oxydation rapide, pas de surtension, réduction rapide de Ni2+
. Courbe (3) : oxydation très lente, surtension très élevée, pas de réduction
possible de Ni2+
V. Dépôts de nickel protecteurs contre la corrosion par le fluor
Parmi les nombreuses applications du nickelage des aciers, la protection contre
la corrosion gazeuse
à chaud par le difluor mis en jeu dans l'enrichissement isotopique de l'uranium
est un des succès les
plus marquants.
V.1. Calculer l'enthalpie libre standard de formation du difluorure de nickel
solide à 373 K à partir
des valeurs à 298 Ken considérant que les diverses grandeurs thermodynamiques
ne varient pas
avec la température. Le nickel est--il corrodable par le difluor gazeux à cette
température ?
V.2. En fait, le difluorure de nickel qui se forme, passive fortement le
nickel. Citer deux adjectifs
caractérisant un produit de corrosion solide apportant une passivité de qualité.
DONNÉES NUMÉRIQUES
Numéros atomiques :
H1N708816Fe26Ni:28
_Masse molaire :
Ni = 58,71 >< 10""3 kg.mol"' Constante des gaz parfaits : R = 8,314 J.1<"'.moi"1 Charge élémentaire : q== 1,60 >< 10--190 Nombre d'Avogadro : N = 6,02x 1023 m1"1 Constante de Nernst à 298 K : ln 10 >< RT/Î ... 0,06 V Enthalpies de formation à 298 K (kJ.mol"l) : N2 (,,) + 2 H2 @ : N2H4 ... ' A,H°m = + 50,60 Ni(s) + F2 (,) : Nin (,) A,H°298 = -- 657,73 Entropies à 298 K (J....1"1 K"l) : H2 @ : 130,68 F..., : . 202,80 N2 (g) : 191,61 N2H4... : 61,05 Ni(s) : 29,87 NiF2 (,) : 73,60 Potentiels redox standard à 298 K : 02 (g) / 1120 e° = + 1,23 V/ESH Fe2+(aq) / Fe@ e° = --- 0,44 V/ESH Niï,... / Ni(s) e° == -- 0,23 V/ESH ' Fe3+(aq) / Fe"..., e° = + 0,77 V/ESH N2 (,) / N2H5+(aq) e° = - 0,22 V/ESH Potentiel à 298 K de l'électrode de référence au sulfate mercureux (saturée en K2SO4) : e° = + 0,66 V/ESH Masse volumique du nickel métallique : p... = 8,90 >< 103 kg.m_3 Fin de l'énoncé. Note . ' / Appréciation du correcteur {uniquement s'il s'agit d'un examen} : "20 * Uniquement s'il s'agit d'un examen. DOCUMENT REPONSE 0 2 4 6 8 10 12 14 Fig. 1. Diagramme potentiel--pH du système nickel--eau prenant en compte les trois espèces an), Ni(OH)2 @, Ni"... Concentration de l'espèce dissoute : 1 x 104 mol.L"'. 1/2 & (1) ""'?" Fig. 2. Diagramme intensité--potentiel à 298 K (unités arbitraires). FIN DU DOCUMENT REPONSE