e3a Physique et Chimie PSI 2007
| Thème de l'épreuve | Dessalement de l'eau de mer par osmose inverse |
| Principaux outils utilisés | écoulement incompressible, bilan (de matière et d'énergie), rendement énergétique, solutions aqueuses, thermodynamique chimique, potentiel chimique |
Corrigé
:👈 gratuite pour tous les corrigés si tu crées un compte
👈 l'accès aux indications de tous les corrigés ne coûte que 1 € ⬅ clique ici
👈 gratuite pour tous les corrigés si tu crées un compte
- - - - - - - - - -
👈 gratuite pour ce corrigé si tu crées un compte
- - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - -
Énoncé complet
(télécharger le PDF)








Rapport du jury
(télécharger le PDF)



Énoncé obtenu par reconnaissance optique des caractères
A44T
e 3 &
CONCOURS ENSAM - ESTP - ARCHIMEDE
Épreuve de Physique - Chimie PSI
durée 4 heures
Si, au cours de l'épreuve, un candidat repère ce qui lui semble être une erreur
d'énoncé, d'une
part il le signale au chef de salle, d'autre part il le signale sur sa copie et
poursuit sa composition
en indiquant les raisons des initiatives qu'il est amené à prendre.
L'usage de la calculatrice est autorisé
Ce problème illustre le fonctionnement d'une unité de dessalement de l'eau de
mer et comporte deux volets indépendants : la chimie de l'eau de mer (première
partie), le
dessalement par osmose inverse et le bilan énergétique de l'installation
(seconde partie).
Remargues préliminaires importantes : il est rappelé aux candidat(e)s que
. les explications des phénomènes étudiés interviennent dans la notation au même
titre que les développements analytiques et les applications numériques ; les
résultats exprimés sans unité ne seront pas comptabilisés,
- tout au long de l'énoncé, les paragraphes en italiques ont pour objet d'aider
à la
compréhension du problème mais ne donnent pas lieu à des questions,
. tout résultat fourni dans l'énoncé peut être admis et utilisé parla suite,
même s'il n'a
pas été démontré par les candidat(e)s.
La population du monde ne cesse d'augmenter alors que la ressource en eau de la
planète
se dégrade. 97% de l'eau disponible sur la Terre se trouve dans l'océan mais
elle est salée.
Les pays en voie de développement, qui ont un besoin croissant en eau, se sont
donc tournés
vers les procédés de dessalement de l'eau de mer. Jusqu'aux années 80-90, le
procédé de
distillation était le seul utilisé pour des installations de grande capacité.
Dans les années 80,
l'osmose inverse est apparue, d'abord pour les eaux saumâtres, puis pour les
eaux de mer; elle
concurrence actuellement le procédé de distillation pour des installations de
capacité élevée (à
Médine, en Arabie Saoudite, 128000 m3 d' eau sont traités chaque jour par
osmose inverse).
Tournez la page S.V.P.
2
PREMIERE PARTIE:
CHIMIE DE L'EAU DE MER
AI Constitution et pH de l'eau de mer
La masse totale des sels dissous dans un kilogramme d' eau de mer peut varier
d'une eau
de mer à une autre (plus de 40 g. L en mer Rouge, moins de 10 g. L en mer
Baltique). La grande
particularité de I' eau de mer est que les proportions relatives des principaux
sels restent
sensiblement constantes; cette propriété a été établie par le chimiste écossais
W. DITTMAR et
permet de considérer I' eau de mer comme une solution dont les constituants
majeurs sont
répertoriés dans le tableau ci--dessous. Les concentrations y sont exprimées en
g. L et en mol. L",
pour une eau de salinité 35 et de masse volumique ,OEM" -- 1022 kg m"
g.L" mol.L" 9. L" mol.L"
H20 988,08 54,74 {8 (OH). , B (OH), } 0,0046 000043
Na' 11,007 0,4788 C" 19,780 0,5579
M9" 1,318 0,0542 SOÎ' 2,772 00289
Ce" 0,421 001051 {HCOâ , COÊ'} 0,121 à 0,149 000198 à 000245
K+ 0,408 001043 Br ' 00890 000088
Sr2+ 00081 0000092 F ' 00013 000007
A_L Calculer la masse totale des différents constituants (eau non comprise) par
litre puis par
kilogramme d'eau de mer (elle devra être exprimée en 9. L" ,puis en g. kg ).
Définir la
salinité de cette eau. Pourquoi les eaux du Golfe Persique ont-elles une
salinité plus
élevée que celles de la mer Méditerranée ou de l'Océan Atlantique ?
Préparons une eau de mer artificielle, selon la « recette » du tableau
précédent, en
mélangeant des bases fortes et des acides forts dans la quantité d'eau
nécessaire. La solution SM
ainsi constituée exclut les composés du bare, B(OH)3 et B(OH).{ ainsi que les
ions HCOJ et CO32'.
A2*a. A quels acides forts et bases fortes peuvent être associés les différents
ions présents ?
A2*b. Ecrire la condition d'électr0neutralité de la solution SM. Quelles
espèces, acides ou bases,
sont--elles en excès dans SM? Evaluer cet excès (exprimé en mol.L") en calculant
l'alcalinité A de la solution SM, définie comme : A = [OH'] -- [H'].
A3*a. En déduire le pH de la solution SM, sachant que le produit ionique de
l'eau de mer de
salinité 35 vaut Ke : 5_10-14
A3*b. Montrer que le pH de la solution S.... varie légèrement dès lors que les
composés du bore,
B(OH)3 et B(OH)4', sont maintenant pris en compte.
A3*c. Quelle est l'influence des composés du bore et du carbone ? Quels sont
les phénomènes
qui provoquent les plus grandes variations du pH de l'eau de mer ?
B I Equilibre thermodynamique du système {CO2 ,HCO; ,COâ'}
Le dioxyde de carbone est un gaz atmosphérique, sa pression partielle
p(COz(gaz)) est une
grandeur mesurable évaluée actuellement à 365.10 bar. Il est soluble dans
toutes les eaux
3
nature/les ; sa forme dissoute C02(aq) est en équilibre avec sa forme gazeuse
COz(gaz) et cet
équilibre obéit à la loi de Henry :
[C02(aq):' : Ko -p (C02(gaz)) ,
où Ko = 2, 8. 10'2 est le coefficient de solubilité de 602 pour une eau de
salinité 35 et à 25 °C.
L'eau de mer renferme quatre formes de carbone inorganique en solution : deux
formes
neutres, COz(aq) et H2C03, et deux formes ioniques HCO{ et CO32'. Les formes
neutres sont
reliées par l'équilibre d'hydratation :
H20 + COQ... : H2CO3 [E]
B1*a. Ecrire la constante K... de cet équilibre noté [E]. KH étant proche de
103, en déduire que
seule la somme des deux formes ioniques en solution est accessible à la mesure.
L'acide carbonique H2C03 est un diacide. Compte tenu de l'équilibre [E], sa
dissociation en
ion hydrogénocarbonate HCO{ s'écrit sous la forme simplifiée suivante :
H20 + co... : H' + HCOg [E1]
B1*b. Justifier cette écriture, puis exprimer la constante de dissociation K1
de l'équilibre [E1].
B1*c. Ecrire l'équilibre de dissociation [EZ] de l'ion HCO{ et exprimer sa
constante K2.
Contrairement aux vitesses d'échanges gaz--liquide qui ont des échelles de
temps de
plusieurs jours, les cinétiques des réactions entre espèces dissoutes sont à
l'échelle du centième
de seconde. Iso/ée ou non de l'atmosphère, l'eau de mer constitue un milieu
dans lequel les
espèces COZ(aq) , HCO{ et CD? sont en équilibre permanent ; c'est pourquoi il
est pratique de se
référer au carbone inorganique total, noté : CT : [COZ(aq)] + [HCOg ] + [COË'] .
BZ*a. Expliquer pourquoi l'état d'équilibre gaz--liquide est si lent à
s'établir.
BZ*b. Exprimer les concentrations [COZ(aQ)], [HCGQ] et [COÊ'] en fonction de
K1, K2, CT et
[H*i
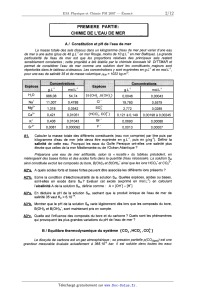
La figure 1 représente les variations en fonction du pH des trois rapports r, :
[COZ(aQ)]/Cï ,
r2 : [HCG;]/C, et r3 : [COj']/Cï (exprimés en %) pour une eau de salinité 35, a
25 °C et sans
échange avec l'atmosphère.
|'1 , "2 , rs
100 %
80 %
60 % Figure 1
40 %
20 %
0 % pH
Tournez la page S.V.P.
4
BZ*c. Analyser cette représentation en déterminant les domaines de prédominance
des espèces
chimiques et en évaluant pK, et pK2.
BZ*d. Le pH de l'eau de mer étant égal à 8, justifier que le fait d'augmenter
la concentration en
COZ dans l'air (ce que l'homme est incontestablement en train de faire) va
mettre en péril
les organismes marins (coraux, mollusques à coquille, crustacés,
phytoplancton...) qui ont
besoin de se construire une coquille ou un squelette à base de calcaire composé
majoritairement de carbonate de calcium Ca003.
C I Détermination de l'alcalinité totale par titrage acide de l'eau de mer
L'eau de mer renferme des ions inactifs qui restent, quel que soit le pH,
entièrement
dissociés de leurs acides ou de leurs bases conjugués ainsi que des ions actifs
dont la
concentration varie en fonction du pH. A partir de la relation
d'électroneutra/ité de l'eau de mer, en
groupant d'un côté les ions inactifs et de l'autre les ions actifs, il est
possible de définir I'alcalinité
totale AT comme bilan des charges électriques portées par les ions inactifs.
Ceci peut s'écrire :
AT =[HC05]+Z [COË'J+ [B(OH)Q]+ [OH--]" [H+]
Modélisons le comportement de l'eau de mer en réalisant une solution S de
chlorure de
sodium de concentration 0,7 mol. L", dans laquelle se trouve de l'acide
carbonique pur de
concentration CT = 2, O. 10'3 mol. L".
C1*a. Ecrire l'électroneutralité de la solution et montrer qu'elle peut se
réduire à :
[H*] -- [ou] = [HCOg]+ 2 [cog-]
Que vaut alors l'alcalinité totale AT ?
C1*b. A l'aide des relations établies en BZ*b, déterminer la concentration
totale de carbone
inorganique CT en fonction de K,, KZ, Ke et [H'] = 10".
C1*c. La solution S a un caractère nettement acide. Exprimer simplement, puis
calculer le pH de
cette solution, sachant que les différentes constantes d'équilibre valent :
K1 = 9.10", K2 = 6.10"°, K,, = 6.10".
Introduisons maintenant un excès A[Na'] d'ions sodium, par addition de soude
concentrée àla solution S.
CZ*a. Ecrire la nouvelle relation d'électroneutralité.
C2*b. En négligeant les corrections de dilution dues à l'addition de soude,
exprimer la relation
notée [R1], reliant K,, KZ, K.,, [H'], cT et A[Na'].
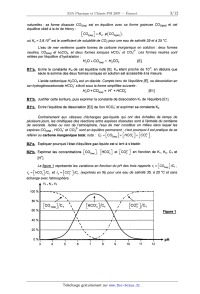
Ce résultat correspond à la courbe expérimentale décrite figure 2 : les
variations du pH
d'une solution d'acide carbonique dans le chlorure de sodium à 0,7 mol.L" et de
sa dérivée
deÆA[NaÜ y sont représentés en fonction dela concentration A[Na7 en ion sodium
ajouté.
C3*a. Qualifier l'allure d'une telle courbe. Quelle(s) information(s) la courbe
dérivée fournit-elle ?
C3*b. Analyser les points notés respectivement 1, 2, 3, 4 et 5.
Adoptons cette fois le scénario inverse : au lieu de contenir des quantités
égales d'ions
. + ,. - . , . . . . . ,. .
sodrum Na et d tons chlorure Cl , une solution 8 contient mrtra/ement un exces
d Ions sodrum par
rapport aux ions chlorure, tel que : A[Na'] : [Na'" :] ---- [CI] : 2, 3. 10'3
mol. L", et dans laquelle se
trouve de l'acide carbonique pur de concentration CT = 2, O. 10'3 mol. L".
-1 0 1 2 3 4 5
Concentration en sodium ajouté (mmol.L")
C4*a. Après avoir reproduit sUccinctement le profil de la courbe de dosage
(figure 2), positionner
le point (noté 0) sur cette courbe, traduisant l'état de la solution après
l'ajout d'ions sodium.
Effectuons ensuite des ajouts A[Cl] d'ions chlorure, sous la forme d'acide
chlorhydrique
concenhé.
C4*b. Traduire la nouvelle électroneutralité de la solution. En déduire la
relation [R2], qui relie
A[Cl'], K1, K2, K.,, [H"'], cT et A[Na'].
C4*c. Proposer une méthode de représentation, sur la courbe de titrage, de
l'ajout des ions
chlorure.
C4*d. Quelle quantité d'acide conviendrait--ll de verser afin de mesurer
l'excès d'ions sodium ?
Conclure quant à la possibilité de mesurer l'alcalinité de la solution.
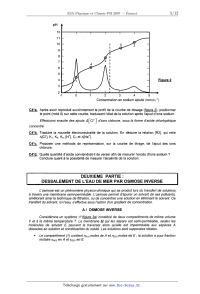
DEUXIEME PARTIE:
DESSALEMENT DE L'EAU DE MER PAR OSMOSE INVERSE
L'osmose est un phénomène physico--chimique qui se produit lors du transfert de
solutions
à travers une membrane semi--splitéable. L'osmose permet d'épurer un solvant de
ses polluants,
améliorant ainsi la technique de filtration, ou de concentrer une solution en
éliminant le solvant. Ce
transfert du solvant, ici l'eau, s'effectue sous l'action d'un gradient de
concentration.
A I OSMOSE INVERSE
Considérons un système Æ(figure 3a) constitué de deux compartiments de même
volume
V et à la même température T. La membrane M qui les sépare est semi--splitéable,
seules les
molécules de solvant E peuvent la traverser alors qu'elle est imperméable aux
espèces A
dissoutes en solution et constituantes du soluté. Les solutions sont supposées
idéales.
- Le compartiment ( 1 ) contient nA... moles de A et ng... moles de E ; la
solution a pour fraction
molaire XA... en A et XE... en E.
Tournez la page S.V.P.
6
- Le compartiment (2) contient nA(2) moles de A et nE(2) moles de E ; la
solution a pour
fraction molaire xA(2) en A et xE(2) en E.
- Le compartiment (2) contient la solution la plus concentrée oula plus saline
: XA (2) > xA (1 ).
Hi (T, P) Hz (T, P) (T, P)
(38)
.....
-----
.....
.....
.....
uuuuu
-----
.....
ccccc
.....
.....
.
oooooooooo
.............
...............
ooooooooooooo
----------------
___________________________
- - - - - - - - - - - - - r:+*+'+'+'++'+'+"+'+'+'+'+++++++++++++q
...............................................
.............
.............................
.°.'.'.'-'.'.°.'.'.'-'.'.'. b++++++++0++++++++++++++++4£
_.;.;.;.;.:.;.;.;.;.;.;.;.ä.'._._.... .............. ;I;Z;Z ______________
f;":îfiîfitIÊÏIÏËIÏIÏËIÎËÊÎËËËIÎÊÏÏ
(1) (2) (1) "l (2)
Etat initial Equilibre osmotique
Figures 3 : osmose directe
(T, P) (T, P) AP > ATI (T, P)
(4a) (4b) ÇîÇÏZ (4e)
.............
.............
.............
.............
...........
;. ...........................
.............
o .
.............
' . ° . ' . ° . ' . ° . ' . ' . ° . ' . ' . ' . ' .
_+'+'+,+'+'+'+'+,+'+;'+'+'+'+'+'+'+.+'+'+'+'+'+'4'+'3
(1) (2)
Etat initial
Figures 4 : osmose inverse
Le potentiel chimique p,- ( T, P) d'un constituant A,-- dans un mélange liquide
idéal sous une
pression P et a la température T est relié a sa fraction molaire x,-- et au
potentiel chimique (J,--* (T, P)
du constituant A,- pur pris dans les mêmes conditions (T, P) parla relation :
lil-(T, P) =lli*(T, P) +RT/fl Xr
A1 *a. Quelles relations a-t--on entre les fractions molaires x)...) et x...,
puis entre X...) et xE(2) ?
A1*b. Exprimer, pour le compartiment (1), les potentiels chimiques (JE... (T,
P, XE...) du solvant E
et ...... (T, P, X)...) du soluté A en fonction de x..., XA... et des
potentiels chimiques des
corps purs. Ecrire de même pE(2) (T, P, xE(2)) et (T...) (T, P, xA(2)) pour le
compartiment (2).
L'osmose directe se traduit par un flux du solvant dirigé du compartiment ( 1 )
vers le
compartiment (2) (figure 3b) jusqu'à ce que le système soit à l'équilibre
osmotique (figure 3c).
A1*c. Relier les variations dnE... et dnE(2) dues au passage spontané du
solvant à travers la
membrane. Que dire de dn...) et dn...) ?
A1*d. La température et la pression étant constantes, écrire la différentielle
dG de l'enthalpie libre
du système @5" en fonction de (JE... (T, P, x...), (_|...) (T, P, x...) et
dnE..., puis en fonction de
x...), x...), dnE..., de la température T et de la constante des gaz parfaits R.
A1 *e. En déduire le sens du transfert des molécules de solvant à travers la
membrane.
La pression osmotique absolue 171 dela solution ( 1 ) est définie comme la
pression qu'il faut
lui appliquer pour arrêter l'arrivée du solvant -- l'eau dans la solution ( 1 )
-- en considérant que la
solution (2) n'est constituée que d'eau pure (figure 3e). Le volume molaire du
solvant pur, supposé
indépendant de la pression dans l'intervalle de pression considéré, est défini
par :
v"'= Ô|JE(T,P)
E op T
A2*a. Déterminer dans le cas d'une solution assez diluée où XA... << 1 et II, << P, la différence : "EUR (T, P+ÏÏ1) ' UE* (T, P)- En déduire la relation de Van't Hoff reliant H,, x...), R, T et VE : 1'11 VE = XA(1) R T. A2*b. Quelle équation relie H,, le volume du solvant pur VE, n...), R et T ? Quelle loi connue cette l'expression vous rappelle--t--elie ? Déduire de cette loi l'expression de H, en fonction de R, T et C..., la concentration molaire du soluté A. [le volume du solvant pur v,} est supposé identique au volume de la solution (solvant + soluté)]. Dans le cas où le compartiment ( 1 ) contient plusieurs espèces dissoutes A,-- de concentrations molaires respectives C,--..., la pression osmotique absolue 171 dela solution ( 1 ) est : 171=z Ci(1)RT A2*c. Calculer la pression osmotique absolue d'une solution aqueuse de NaCl, dont la concentration en sel vaut 0,35 9. L (ou 0,35 kg m 3) à 25 °C. Données. masses molaires M(=Na) 23 g. moi et M(CI)= 35, 5 g. mol, constante des gaz parfaits R= 8, 314 J. K'. mol. Exprimer cette pression osmotique en bar, sachant qu 'un bar vaut 105 Pa. Revenons au système &: 171, la pression osmotique absolue de la solution ( 1 ) et 172, la pression osmotique absolue de la solution (2) sont les pressions qu'il faut respectivement appliquer pour stopper le flux de solvant a travers la membrane (figure 3a). A3*a. La solution (2) est constituée des mêmes espèces dissoutes A, que la solution (1), mais à des concentrations différentes C, (2) : écrire Hz en fonction de C, (2), R et T. A3*b. Lorsque les surpressions IL et H2 ne sont plus appliquées, montrer que le système atteint une position d'équilibre caractérisée par une dénivel|atîon Ah (figure 30 ou 4a) correspondant à la pression osmotique apparente : AH ==--l'I2 --I'I1 : pS 9 Ah, où ps est la masse volumique de la solution et g l'accélération de la pesanteur. A3*c. Les deux compartiments renferment des solutions aqueuses de NaCl aux concentrations respectives de 35 9. L et 0,35 9. L'; calculer, à 25 °C, la pression osmotique apparente AH, exprimée en bar. Appliquons sur le compartiment (2) renfermant la solution la plus concentrée, une pression AP supérieure à la pression osmotique apparente AH (f igure 4b); une migration d'eau est alors observée en sens inverse du flux osmotique normal, dela solution plus concentrée vers la solution moins concentrée : c'est le phénomène d'osmose inverse découvert par REID en 1950. A4*a. Que devient la pression osmotique dans le compartiment de droite où la surpression AP est appliquée ? A4*b. En vous appuyant sur des considérations thermodynamiques, expliquer le sens des transferts dans l'osmose directe et dans l'osmose inverse. Tournez la page S.V.P. 8 B I FONCTIONNEMENT DE L'OSMOSEUR La figure 5 ci--dessous schématise le fonctionnement d'un osmoseur industriel. Figure 5 E CAR Production 'cïi \z< v / v : ÏZÏ°._:-Ï:.}î ' '", V .g Turbopompe M d | A B î haute pression 0 u e = :: ---->
"' <1 .Ë Concentrat < :_,f L'alimentation de l'osmoseur est la solution à épurer, elle est 3_ puisée en mer par des pompes immergées, éventuellement prétraitée, à"; puis stockée dans un bassin de rétention. Elle est ensuite mise sous & pression par l'intermédiaire d'une turbopompe haute pression puis ;," introduite dans le module d'osmose inverse ; ce module renferme une 8° ou plusieurs membranes _M_ en polyamide, montées dans des supports Ë plans ou spiralés. La solution à traiter s'écoule tangentiellement à la Pompe membrane puis se divise en deux parties de concentrations immergée differentes : la partie qur passe a travers la membrane est le permeat, l'autre, qui ne passe pas à travers la membrane, est appelée concentrat ou retentat. Les membranes doivent être stables chimiquement, thermiquement et d'un point de vue microbiologique. L'installation est équipée de pressostats Pr (dispositifs permettant le contrôle de la pression) en amont et en aval de la pompe haute pression, de débitmètres D sur les deux sorties du module, de vannes V de régulation du débit, d'un clapet anti--retour CAR ainsi que d'un conductimètre .(2. B1*a. Expliquer pourquoi du chlore doit être injecté dès le début de la prise d'eau de mer. B1*b. Préciser le rôle des pressostats mentionnés sur le schéma de l'installation. Tout le dispositif fonctionnant en régime permanent, les concentrations massiques C (exprimées en g.L' ) et les débits volumiques Q de l'installation seront notés comme suit : . CA concentration de soluté, QA débit de l'eau dans le flux d'alimentation, . CR concentration de soluté, QR débit de l'eau dans le flux rejeté (ou concentrat), . CP concentration de soluté, Q,: débit de l'eau dans le flux produit (ou splitéat). Les membranes n'étant pas rigoureusement imperméables au soluté, l'eau est partiellement dessalée. Afin de caractériser le fonctionnement du module d'osmose inverse, quelques termes usuels doivent être préalablement définis : -- taux de rejet : TR = CR / C A taux de soluté ne traversant pas la membrane, - passage de sel: P8 = C,, / C A taux de soluté traversant la membrane, . taux de conversion : TC = Q,, /QA rapport du débit de splitéat au débit d'alimentation. 9 Les masses volumiques des solutions sont supposées indépendantes dela pression et des concentrations de soluté. BZ*a. Ecrire, pour le dispositif, l'équation de conservation des débits volumiques entre QA, QR et Q: ainsi que l'équation de conservation des masses de soluté reliant QA, QR, Qp, CA, CR et Cp. BZ*b. Si le taux TR est supérieur à 95%, la concentration Cp est pratiquement nulle. Etablir alors la relation entre TR et TC. Calculer TR pour To de l'ordre de 40% puis 70% ; en déduire la pression osmotique absolue II du concentrat (exprimée en bar) en partant d'une solution aqueuse de NaCl à la concentration de 35 g.L", à 25 °C. Les transferts de solvant et de soluté a travers une membrane semi--splitéable se font par solubilisation-diffusion : toutes les espèces moléculaires (soluté et solvant) se dissolvent dans la membrane et diffusent à l'intérieur de celle-ci comme a travers un solide ou un liquide sous l'action d'un gradient de concentration et de pression. Le flux volumique Jp de splitéat traversant la membrane (volume d'eau traversant _M par unité de surface et par unité de temps) s'écrit sous la forme : J,, = K,, (AP--AI] ) où KP est le coefficient de splitéabilité de la membrane vis--à--vis de l'eau, AP la pression différentielle appliquée et AH la différence de pression osmotique de part et d'autre de M. Le flux massique de solutés diffusant a travers la membrane (flux exprimé par unité de surface et par unité de temps) s'écrit par ailleurs : JS ==KS (AC), où KS est le coefficient de splitéabilité dela membrane vis--à-vis des solutés et AC la différence de concentration massique en soluté de part et d'autre de _M_ : AC : (C,, ---- Cp) . B3*a. Comment expliquez-vous que l'écoulement soit dirigé tangentiel|ement à la membrane et non de manière frontale ? B3*b. Quelles sont les facteurs favorisant ou pénalisant le débit de splitéat ? B4*a. Définir la concentration en soluté dans le splitéat Cp, en fonction des flux Jp et JS. Exprimer Cp en fonction de CA, J.: et KS, puis en fonction de CA, K,», KS, AP et AH. B4*b. Déterminer la concentration en rejet salin CR en fonction de CA, Cp et TC. B4*c. Avec les données numériques suivantes : cA = 35 g.L", Kp= 2,8.10'7 m.s".bar", KS = 1.10'7 ms", T = 25 °C, AP = 70 bar, TC = 40%, calculer Jp, Cp, JS, et CR, sachant que la différence de pression osmotique AH de part et d'autre de _M a toujours la valeur obtenue en A3*c. Analyser ces résultats. Le débit de splitéat JP varie proportionnellement à l'inverse de la viscosité ,uEM de l'eau de mer : J,, = % . La viscosité de l'eau de mer (liquide newtonien), en fonction de la température, EM E° ), où EO est l'énergie d'activation d'écoulement et T la suit une loi du type : ,uEM : p,, exp(RT température absolue. d1uEM dT AIUEM IuEM de viscosité de l'eau de mer en fonction de la température, puis la B5*a. Ecrire la variation de viscosité en fonction d'une variation AT de la température. variation relative BS*b. En déduire le sens de variation du débit de splitéat dès lors que la température croît. Tournez la page S.V.P. 10 B5*c. Exprimer puis calculer la variation relative du débit de splitéat par degré d' augmentation de la température de l'eau de mer (à partir de 25 °C), sachant que Eo- -- 22, 5 k.]. mol ' B5*d. Quel dispositif technique faut--il prévoir au niveau du module d'osmose, et compte tenu des résultats précédents, afin d'assurer un débit de splitéat sensiblement constant ? Des calculs plus complexes, faisant intervenir les phénomènes d'adsorption au niveau de la membrane, la viscosité et la température de l'eau salée permettent d'optimiser la concentration en soluté dans le splitéat Cp, puis de définir la qualité de l'eau osmosée par rapport a des références normalisées. La figure 6 ci--dessous représente l'évolution de cette qualité de l'eau osmosée en fonction du taux de conversion, pour différentes valeurs de la pression différentielle (AP -- A1?) de fonctionnement, variant entre une base unité et dix fois cette unité. ÉS--- "EE-- ÉËSE. x4- . 'M "' & base1 0,2 0,4 0,6 0,81,0 Taux de conversion Qualité de l'eau osmosée (ua) ou Ill|l IllWl W Bô*a. Définir la plage de travail pour obtenir la meilleure qualité d'eau osmosée possible. Bô*b. Préciser s'il est préférable de choisir de : . travailler à pression élevée (ou faible) pour un taux de conversion donné, . utiliser un taux de conversion faible (ou élevé) en maintenant une pression constante. Afin de limiter les consommations d'eau, le montage de plusieurs modules - dit en « série-- rejet» -- est couramment pratiqué : le rejet du premier module est injecté à l'alimentation du second, et ainsi de suite. Notons respectivement QA(i), Qp(i), QR(i) les différents débits et Tdi) le taux de conversion de chaque module noté i. B7*a. En vous inspirant de la figure 5, représenter schématiquement une telle association pour trois modules. B7*b Déterminer le taux de conversion TC(E) effectif de cette association, puis généraliser à la mise en série de n modules identiques (taux TC(i) = 40%). B7*c En utilisant les données et les résultats obtenus précédemment, calculer le taux de conversion TC(E) effectif, pour une association série-rejet constituée de cinq modules. A la sortie de l'installation, de nombreux contrôles ou tests physico-chimiques sont réalisés sur/' eau douce produite dont la concentration en sel doit se situer vers 300 mg. L & Proposer deux grandeurs qui vous paraissent essentielles vis--à-vis de la qualité de l'eau produite et préciser la technique (ou le dispositif) qui permet de tester chacune d'elles. 11 C I BILAN ENERGETIQUE DE L'OSMOSEUR Les besoins en énergie électrique pour le dessalement de l'eau de mer par osmose inverse constituent 42 % du coût d'exploitation. Ces besoins sont éminemment variables car ils dépendent de nombreux paramètres : capacité journalière de production, caractéristiques de l'eau de mer (salinité, température), choix du système de mise sous pression, rendement du système de récupération de l'énergie hydraulique du concentrat, facteur de conversion souhaité, choix du matériau et structure de la membrane, de l'ensemble des pré-- et post--traitements effectués sur l'eau de mer ou sur le splitéat. Afin d'établir un bilan énergétique représentatif, étudions un site de dessalement possédant les caractéristiques suivantes : module avec membrane composite, à configuration spiralée capacité de production : 10 000 m3/jour température : 25 °C minéralisation de l'eau de mer : 35 g. L" facteur de conversion : TC : 40% masse volumique de l'eau de mer : par = 1022 kg. m'3 pression disponible à l'alimentation dela pompe haute pression : P0 = 1 bar pression nette d'alimentation du module d'osmose : A P = 70 bar contre--pression sur la sortie du splitéat : P0 = 1 bar. Afin de réaliser ce bilan, procédons par étapes en analysant les postes essentiels. Calcul préliminaire : ç_:l_._ Evaluer le débit d'alimentation QA ainsi que le débit de rejet QR (exprimés en m3/h). En déduire le nombre n de pompes immergées nécessaires, sachant que chacune d'elles possède un débit unitaire de 149 m3lh. Etude dela pompe d'alimentation : (figure 5) Le pompage en mer s'effectue à l'aide de n pompes immergées, alimentées par des moteurs électriques (Mi), présentant une dénivelée de pompage AH de 35 m (entre le niveau dela mer et celui du bassin de rétention) et de rendement global np = 0,74. La chaîne énergétique d'une pompe ---- ou d'un compresseur --- peut se représenter schématiquement comme suit : (figure 7) Pompe EF ou Fluide Compresseur Moteur électrique pertes pertes Figure 7 La pompe est entraînée par un moteur électrique qui consomme l'énergie EE transformée en énergie mécanique EM nécessaire pour faire tourner la pompe ; celle--oi communique au fluide une énergie E,=. Désignons par (S) le système ouvert constitué parle fluide compris entre l'entrée, où la pression vaut Pæ, et la sortie de la pompe, où la pression vaut P(S) ; l'écoulement du fluide (eau de mer de masse volumique pEM) est supposé unidimensionnel, permanent (débit volumique constant Qv) ; la viscosité du fluide de même que tous phénomènes de transfert thermique seront négligés. C2*a. A l'aide du premier principe de la thermodynamique, écrire l'expression générale de l'énergie er.-- reçue par le fluide, par unité de masse. Simplifier cette expression en analysant les différences de vitesse entre l'entrée et la sortie de la pompe. C2*b. Montrer que la puissance ?} fournie par la pompe au fluide (supposé incompressible) peut s'écrire sous la forme : %, : QV [pm 9 AH + (P(S) --- P(e) )] . Tournez la page S.V.P. 12 C2*c. Déterminer la puissance @... de la pompe immergée, en notant que la prise d'eau en mer et le rejet en bassin se font à des pressions voisines de P0 = 1 bar. C2*d. Calculer la puissance absorbée aux bornes du moteur entraînant la pompe (exprimée en kW), puis la puissance totale du groupe de pompage. (g = 9,81 m.s'2) Pompe haute pression : (figure 5) Cette pompe joue le rôle d'un compresseur afin d'amener l'eau salée (à la pression Po dans le bassin) à la pression requise à l'entrée du module d'osmose (AP). Les résultats obtenus à la question C2*b pourront être utilisés. C3*a. Exprimer la puissance OEPHP absorbée aux bornes du moteur électrique (Me) entraînant cette turbopompe en fonction du débit d'alimentation QA, de la pression différentielle aux bornes de celle--ci et des rendements anp de la turbopompe et n... de son moteur électrique. Calculer @PHP sachant que anp = 0,85 et n... = 0,96. (1 bar = 105 Pa) C3*b. En déduire l'énergie W....» dépensée au niveau de la turbopompe, ramenée au mètre cube de splitéat produit par l'osmoseur (exprimée en kWh.m'3). Dans les premières installations d'osmose inverse, le circuit de rejet était détendu à travers une vanne, ce qui représentait une perte considérable d'énergie. La puissance associée au débit QR du concentrat peut être récupérée de façon avantageuse grâce à des turbines (Pe/ton, Kaplan) et plus récemment par des systèmes d'échangeurs de pressions (dispositifs non étudiés ici). Bilan final : Compte tenu du débit de concentrat, des dimensions de la conduite d'alimentation, du dispositif de récupération choisi et de son rendement, la puissance réellement récupérée s'élève à 980 kW C4. Evaluer la proportion de puissance ainsi récupérée par rapport à celle nécessaire pour faire fonctionner la pompe haute pression. Proposer le mode de récupération de ce pourcentage de puissance. A ces puissances absorbées, il convient d'ajouter les pertes en lignes ainsi que les pertes dans les transformateurs d'alimentation ; la puissance associée à ces pertes s'élève à 150 kW 05*a. Evaluer la puissance totale associée au pompage en mer, à l'osmoseur et aux pertes électriques ; en déduire l'énergie électrique (exprimée en kWh) facturée à l'exploitant du site de dessalement par mètre cube d'eau produite. C5*b. En comptant 0,1 EUR comme prix moyen du kWh, et sachant que la part d'énergie électrique représente 42% du coût de fonctionnement d'une telle installation, estimer le prix de revient du mètre cube d'eau dessalée. C5*c. Rechercher le lien entre salinité et consommation électrique du dispositif. Est-il plus onéreux de dessaler les eaux de l'Océan Atlantique ou celles du Golfe Persique ? Justifier votre réponse. FIN DE L'EPREUVE