Mines Physique et Chimie PCSI 2005
| Thème de l'épreuve | Continuité et discontinuité. Dosage d'une solution de glucose par la méthode de Bertrand. Étude de l'oxydation d'un mélange de glucose et de fructose par les ions molybdate. Synthèse de la (S)-fenfluramine. |
| Principaux outils utilisés | mécanique, électricité, magnétostatique, thermodynamique, solution aqueuse, cinétique chimique, oxydoréduction, chimie organique |
Corrigé
:- - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - -
Énoncé complet
(télécharger le PDF)








Énoncé obtenu par reconnaissance optique des caractères
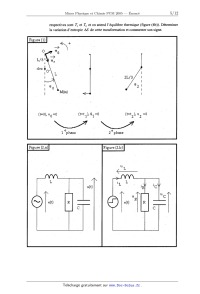
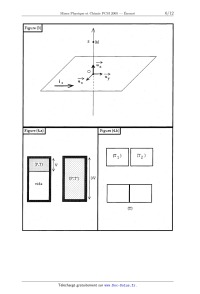
CONCOURS COMMUN 2005 DES ÉCOLES DES MINES D'ALBI, ALÈS, DOUAI, NANTES Épreuve Spécifique de Physique et Chimie (filière PCSI option PC) Vendredi 20 mai 2005 de 08h00 à 12h00 Barème indicatif: Chimie 1/2 - Physique 1/2 Instructions générales : Les candidats doivent vérifier que le sujet comprend : 12 pages numérotées 1/12, 2/ 12, 12/12. Les candidats sont invités à porter une attention particulière à la rédaction : les copies illisibles ou mal présentées seront pénalisées. Les candidats colleront sur leur première feuille de composition l'étiquette à code à barres correspondante. ' L'emploi de la calculatrice est interdit PHYSIQUE Continuités, discontinuités. Ce sujet de physique comprend quatre parties indépendantes, que le candidat pourra traiter dans l'ordre de son choix. Le fil conducteur de ce sujet est l'étude dans divers domaines de la physique des propriétés de continuité et de discontinuité des grandeurs. On rappelle qu'une fonction y = f(x) est une fonction continue en x0 si et seulement si la ' limite à gauche en xO de f est égale à la limite à droite et à la valeur f (x0) . Dans tout ce sujet, on notera x5 une valeur de x immédiatement inférieure à x0 , x5 une valeur de x immédiatement supérieure àx0 . La continuité peut donc s'écrire aussi : füD=f(Xä)=f(X0 On rappelle les coordonnées dans la base polaire des vecteurs position OM , vitesse v et accélération Zi dans le cas du mouvement circulaire de rayon r : OM=rür Ü=r%@ Zi=--r(d--9) ii +rd 9ii Première partie : Mécanique 1.1. On considère un mobile ponctuel de masse constante m soumis, dans un référentiel galiléen, à un ensemble de forces de résultante f , partout et constamment définie dans l'espace et le temps. Question 1. En utilisant le principe fondamental de la dynamique (ou théorème du centre d'inertie), montrer que, sous cette hypothèse, la norme v du vecteur vitesse du mobile est une fonction continue du temps. 1.2. On étudie un pendule simple modifié, présenté sur la figure (1). Un mobile ponctuel M de masse m , est accroché à l'extrémité d'un fil inextensible de longueur L et de masse négligeable, dont l'autre extrémité est fixe en 0. On néglige tout frottement et on repère l'inclinaison 9 du brin de fil soutenant M par rapport à la verticale. Lorsque9 > O, le système se comporte comme un pendule simple de centre O et de longueur de filL . A la verticale et en dessous de O, un clou est L planté en O' avec OO'= ?, qui bloquera la partie haute du fil vers la gauche: quand9 < 0, le système se comporte donc comme un pendule simple de centre O' et de longueur de fil %L-. A la date t = 0 , on abandonne sans vitesse initiale le mobile M en donnant au fil une inclinaison initiale H(O) : 90 > 0. On note t1 la date de la première rencontre du fil avec le clou, t2 la date de première annulation de la vitesse du mobile pour 9 < 0. L'intervalle de dates [O, t1[ est nommé première phase du mouvement, l'intervalle ] tl,t2] est nommé deuxième phase. A la date tl" immédiatement inférieure à t1 , le fil n'a pas encore touché le clou et à la date tf' immédiatement supérieure, le fil vient de toucher le clou. Question 2. Etablir l'équation différentielle vérifiée par 9 pour la première phase du mouvement. Question 3. Dans l'hypothèse des petites oscillations, on suppose que sin9 % 9 . Reconnaître l'équation différentielle d'un certain type d'oscillateur et en déduire, sans résoudre l'équation, la durée 5 t , de la première phase du mouvement. Question 4. En utilisant le théorème de l'énergie mécanique,déterminer la vitesse v," de M à la | _ , . . * . _ 6119 date t1 . En dedu1re la V1tesse angulaire a)1 : --------- à cette date. , . _ dt Question 5. Le blocage de la partie supérieure du fil par le clou ne s'accompagne d'aucun transfert énergétique. Déterminer la vitesse vf de M à la date t1+ . En déduire la . ". d 9 v1tesse angula1re col+ : -- à cette date. dt Question 6. , En utilisant le résultat des questions 2 et 3,_ donner sans calcul la durée 5 t,, de la deuxième phase. Question 7. Déterminer l'expression de l'angle 92 à la date t2. Question 8. .Décrire brièvement la suite du mouvement de ce système et donner 1' expression de sa période T. Question 9. Dresser 1 allure du portrait de phase, dans le système d'axes (9, fig) Conclure. dt Deuxième partie : Electricité 11.1. Un circuit électrique comprend un résistor de résistance R', une bobine d'inductance L et un condensateur de capacité C , toutes constantes. Question 10. Expliquer pourquoi la tension aux bornes du condensateur et l'intensité du courant traversant la bobine sont des fonctions continues du temps. 11.2. On considère le circuit de la figure (2.a) alimenté par un générateur de tension alternative sinusoïdale du type e(t) = E cos(wt) et on s'intéresse au régime sinusoïdal forcé. Question 11. Etablir l'expression de la fonction de transfert complexe en boucle ouverte de ce , circuit assimilé à un quadripôle : ' _Ïi= 1oe ": Question 12. En déduire la relation entre les grandeurs réelles e(t) et u(t) et leurs éventuelles dérivées temporelles. II. 3. On considère maintenant le circuit de la figure (2. b) alimenté par un générateur d'échelon de tension dont la tension est: e(t)= O pour t< 0 e(t)= E pour t> O. A la date t = O' , toutes les grandeurs électriques sontnulles : uL = u R = uc = 0 et i L_ = i R = ic = 0. On admettra pour la suite de cette partie que la tension aux bornes du condensateur vérifié l'équation différentielle : d2uc + _1:_ duc dt2 R dt On ne demande pas de résoudre complètement cette équation différentielle. LC + uc = e(t) Question 13. Montrer que le type de régime dépend de la valeur de la résistance R , comparée à celle d'une résistance critique RC ' dont on donnera l'expression. L'observation d'oscillations amorties a--t--elle lieu pour R > RC ou pour R < RC '? Interpréter ' physiquement. ' ' Question 14. Donner en les justifiant les valeurs des six grandeurs électriques u L , u R, uc , i L , i R et ic àladate t=O'. 11.4. On considère un condensateur plan formé de deux plaques de surface S très grande, séparées par une tranche de vide d'épaisseur 6 très petite. On suppose que cette épaisseur diminue , e brusquement de e a e'= ------. 2 Question 15. Quelles sont dans ce cas les grandeurs électriques (capacité, charge, tension, énergie électrique) encore continues et par quels coefficients respectifs sont multipliées les autres ? Justifier quantitativement et interpréter physiquement les réponses. Troisième partie : Magnétostatique 111. Sur la figure (3), le plan infini P = (O, x, y) est parcouru par un courant électrique constant de densité surfacique ÎS = j Sû y. Soit M un point de l'axe (0, z) de cote z . ' Question 16. Donner, en la justifiant, l'expression vectorielle du champ magnétique Ë en M. Montrer que ce champ présente une discontinuité à la traversée du plan et vérifier que cette discontinuité peut s'écrire AË= B(z= O')-- B(z= 0 )= ,uojSu Question 17. On admet que cette expression de la discontinuité est toujours valable à la traversée d'une membrane portant une densité surfacique de courant ÎS , même si cette membrane n'est pas un plan infini. On considère un solénoïde idéal, infini, parcouru par un courant constant d'intensité i, comportant 71 spires par mètre de lOngueur. On admet que le champ magnétique est nul à l'extérieur et uniforme à l'intérieur de la bobine. Déduire de l'expression de la discontinuité ci- dessus la norme du champ magnétique àl' intérieur du solénoïde, en fonction de ,a... n et i. Quatrième partie : Thermodynamique IV.1. On donne les coordonnées du point triple (T T : 217K,PT = 510kPa) et du point--critique (TC : 304K , PC : 7 3MPa) du dioxyde de carbone. Question 18. Tracer une allure du diagramme (pression, température) pour le dioxyde de carbone, sans chercher a respecter des échelles. Expliquer' a partir de ce diagramme ce qu' on appelle la continuité de l'état fluide. Quel est le phénomène observé au point critique ? ' IV.2. Lorsqu'on met au contact deux systèmes thermodynamiques séparément homogènes et à l'équilibre thermodynamique, on observe transitoirement une discontinuité des grandeurs intensives. Il en est ainsi lors de la détente de Joule Gay-Lussacet lors de la mise au contact de deux corps de températures différentes. \ Question 19. On opère une détente de J oule Gay-Lussac pour une mole de gaz parfait monoatomique de volume initial V , et de température initiale T . Le volume final est V'= 3V (figure (4a)). Déterminer, en précisant soigneusement toutes les hypothèses et en détaillant tous les calculs, la variation d'entropie AS de cette transformation et . ' commenter son signe. Question 20. Dans une enceinte adiabatique, on met deuxcorps indéformables de même capacité calorifique C (en J - K ") au contact thermique; leurs températures initiales reâpectives sont T1 et T 2 et on attend l'équilibre thermique (figure (4b)). Déterminer la variation d'entropie AS de cette transformation et commenter son signe. * ' 2Lr3 (t=0], v0 =0 _ ' [t=t 1'], 91 =Û (t--t2 ], v2 =Û ' e I, - ' ' V _ 1 phase . 4 \ 2 phase Figure (2.a)l ' « .v , » ' Figure (2.13) | _ ,, ' < L ' , L /\ ' L ' 1 _ ' .f\ __ /\ /\ -- ' /\_ "e" V 0II Il @ ÜIl IIÆ Figure (3) Figure [43] * Figu ré [4.b] 12.5 12' 11.5 Doæge de 10 mL de la solution d'a aide tartrique à O, 1 mol/L par une solution de soude à 0,1 mol/L CHIMIE . _ Premier problème : Dosage d'une solution de glucose par la méthode de Bertrand Cette méthode est utilisée pour doser des solutions de glucose, le principal réactif est la liqueur de F ehhng La liqueur de F ehlmg est préparée en mélangeant des volumes égaux: ' _- De la solution A contenant 3,5 mol/L d' hydroxyde de sodium et 1 mol/L de tartrate de ' " sodium et potassium. - De la solution B solution desulfate de cuivre 11. 1. Etude de l'acide tartrique . . Cet acide a pour formule brute: C4H606.11 possède deux fonctions alcool et deux fonctions acide carboxylique. * L' acide tartrique (n0té H2T) se comporte comme un diacide en solution aqueuse dont les pKa ont 1 pour valeur: pKa1= 2 ,9 ,_pKaz -- 4,5. Question 1. Présenter la liaison hydrogène de manière succincte et équuér son influence sur les ' valeurs des deux pKa de l'acide tartrique. | ' QueStîon 2. Tracer le diagramme de prédominanCe de l'acide tartrique en fonction du pH. v On dose 10 mL d' une solution d' acide tartrique à 0,1 mol/L par une solution de soude à 0,1 mol/L. _ _ " On suit ce titrage par pHmétrie, les F1gure 1 / ' résultats expérimentaux sont reportés sur la figurel. , _, : Par -modélisation informatique on superpose à la courbe obtenue V les courbes de répartition des espèces en fonction du pH. , Question 3. Identifier ces courbes. Question 4. Le pH lu sur la courbe ' pH=f(v) pour v=0 mL est--il en accord avec % . l'hypothèse consistant à ; négliger la seconde % acidité ? , * Question 5. Combien de sauts de pH observe--t-o n '? Cela est--il _ justifiable ? Question 6. Retrouver le pH de la solution lorsque 10 mL de la solution de soude ont été Versé"S. ' Question 7. Calculer leppH de la solution lorsque 20 mL de la solution de soude ont été versés. D0n'nées : log(X) 2. Etude de la solution A: Question 8. ' Peut--on calculer le pH de la solution avec le modèle que l'on a l'habitude d'utiliser '? Question 9. Quelles sont les espèces chimiques présentes dans cette solution, ainsi que leur concentration ? * 3. Etude de la solution B : La solution B est de couleur bleue, elle est parfaitement limpide. Cette couleur est due à la présence des 10ns tétraaquacuivre Il Cu(HZO)4Z+ , Nous désirons déterminer la concentration de cette solution B en sulfate de cuivre par spectrophotométrie. Question 10. Rappeler la loi de Beer-Lambert et préciser les unités. On considère que dans la solution étudiée, seuls les ions complexes tétraaquacuivre II absorbent. Question 11. , Pour vérifier la loi de Beer--Lambert comment doit--on choisir la longueur d'onde utilisée ? , Pour déterminer la concentration de la solution Bien sulfate de cuivre 11 nous nous proposons d'utiliser la méthode des ajouts dosés. ... Cette méthode consiste à prendre 100 mL de la solution B et d'ajouter successivement m=1,0.10'3 mol de sulfate de cuivre Il pentahydraté cristallisé (CuSO4,5HZO) cela sans variation de volume ce qui correspond à une concentration ajoutée C1. On obtient alors les résultats suivants pour la longueur d'onde X=800 nm : Question 12. Exprimer l'absorbance An en fonction de Co, 11, C1.En déduire la concentration CO en sulfate de cuivre de la solution B. 4. Etude de la liqueur de Fehling: On mélange 100 mL de la solution A avec lOOmL de la solution B. ' Pour simplifier les calculs, nous ferons l'hypothèse que le pH de la solution obtenue est de 14, cette valeur sera invariable dans les questions suivantes. Question 13. Calculer les concentrations en tartrate (noté T2' ), en Cu 2+ et en ions hydroxyde de la solution après mélange, mais avant toute réaction. Question 14. Déterminer les espèces présentes à l'équilibre ainsi que leur concentration. D' après les calculs la solution doit- elle rester limpide '? . Question 15. Expérimentalement nous observons une solution d'un bleu foncé. Conclure. Pourquoi doit-on préparer la liqueur de Fehling juste avant son utilisation '? Données : Cu(OH)2 (s) : sz = 19,0 (CuT2)2' : log 52 = 5,0 5. Dosage d'une solution de glucose par la méthode de Bertrand: Le glucose est un sucre réducteur de formule brute C6H1206. Il peut être oxydé à chaud en ion gluconate (C6H1107') par des oxydants doux tels ue les 10ns cuivre 11 présents dans la liqueur de, Fehling sous la forme d'ions complexes (CuT2) ' . On observe alors la formation d'oxyde de cuivre I solide de couleur rouge. ' ' Analyse du protocole expérimental : Verser dans un erlenmeyer de 150 mL, à col étroit , propre : 20 mL de la solution A 20 mL de la solution B ... 20 mL de la solution de glucose à doser. Porter à ébullition pendant 3 min, laisser refroidir la fiole inclinée, vérifier que le liquide sumageant est bien bleu. Verser la quasi--totalité du liquide sumageant dans l'erlenmeyer sur le verre fritté, filtrer sous vide. Rincer le solide rouge restant dans l'erlenmeyer avec de l'eau distillée bouillante, agiter; laisser reposer, fiole inclinée. Décanter le liquide sumageant sur le verre fritté comme précédemment. Recommencer au moins 6 fois de suite cette opération. Verser dans l'erlenmeyer 20 mL d' une solution d'alun de fer III (ammonium--fer III sulfate) acidifiée par l acide sulfurique. Agiter, on doit alors constater que la solution vire au vert et que le précipité d'oxyde de cuivre I est consommé. Rincer la fiole à vide, verser alors sur le verre fritté la solution verte obtenue et aspirer sous vide. Recommencer la même opération mais en prenant cette fois 10 mL de la solution de fer III, bien rincer les parois de l'erlenmeyer et faire passer sur le verre fritté. La solution verte' obtenue est titrée par une solution acide de permanganate de potassium à 0,02 mol.L'l. Question 16. Question 17. Question 18. Question 19. Question 20. Question 21. Question 22. Question 23. Question 24. Question 25. Données : Ecrire l'équation de la réaction d'oxydation du glucose par la liqueur de Fehling. Calculer la constante thermodynamique de cette réaction. Conclure. Ecrire l'équation de la réaction d'oxydation de l'oxyde de cuivre I par la solution de fer III. Ecrire l'équation de la réaction de l'oxydation des ions fer II par les ions permanganate. Le titrage est-il pertinent ? Pourquoi doit-on incliner l'érlenmeyer '? Pourquoi faut-il s'assurer qu'après ajout de la liqueur de Fehling le sumageant reste bien bleu '? Comment détecter le point d'équivalence lors du titrage par la solution de permanganate ? ' Peut-- on être sûr de la concentration de la solution de permanganate si elle a été préparée a l avance '? ' . Expérimentalement, on trouve un volume Ve= 20 mL de permanganate de potassium versé a l équivalence. En déduire la concentration de la solution de glucose en g. L'1 Potentiels standard redox : CuZ+/CuzO E°1.= 1,02 v C6H1207/C6H1206 E°2 : -0,24 V mor/Mn2+ E°3 = 1,51 v Fe3+/Fez+ E°4 = 0,77 v H3O+/HZO E°5 = 0,00 v , OZ/HZO E°6 = 1,23 V C6H1207/ C6H1107-- pKag= 5 ' Masse molaire du glucose Mg-- -- 180g. mol 1 Deuxième problème : Etude de la réaction d'oxydation d'un mélange de fructose et de glucose par les ions molybdate Le fructose noté F ainsi que le glucose G réduisent le molybdène (VI) présent sous la forme d'ions molybdate MoO4Z' symbolisées . en molybdène (V) M002 ou bleu de molybdène selon les réactions F + M0(VI ) _) Mo(V) + F' constante de viteSSe kp G + Mo(VI ) --> Mo(V) + G' constante de vitesse k(} , Ces deux réactions présentent la même loi cinétique, on note 01 et B les Ordres partiels respectivement par rapport au Sucre et au 1 _ molybdène (VI). _Question 26. Donner » la ? configuration ' ' électronique du mo1ybdène \ ï _ :» (Mo: Z=42), indiquer sa' ' ' position dans la classification périodique " 4 .... ... _ = . , .'Quéstion 27. Donner la représentation de '. 6° _,80 ' -y , . Lewis dés1ons molybdate. , "" """ Question 28. Quelle est la géométrie que l'on " peut prévoir pour ces ions ? \ On désire déterminer l'Ordre de ces"réactions ainsi que leur constante de vitesse. POur cela on exploite que les solutions aqueuses de bleu de molybdène sont colorées et présentent une bande d'absorption à 720 nm. On suit alors l'évolution du milieu réactionnel par spectrophotométrie' a cette longueur d'onde. L' abs0rbance de la solution est alors proportionnelleà la concentration en Mo(V), c'est à dire en sucre ayant réagi. / Question'29. Exprimer la Vitesse de réaction pour les deux réactions envisagées. Question 30. Dans un cas de dégénerescence de l'ordre par rapp0rt aux ions molybdate et en ' faisant l'hypothèse où a=l calculer l' expreSSion en fonction du temps du fructose ayant disparu a la date t On notera kp' la constante apparente de vitesse. Question 31. Dans la pratique nous mesurons [Mo(V)] en fonctiOn du temps, donner son expreSsion. On admettra que la réaction est finie au bout de 120 min et l'on posera [MO(V)]_oe = [M0(V)] 120 On fait une première série d'expériences en présence de fructose seulement On introduit dans une fiolé Jaugée de 100 mL ' 20 mL dune solution de fructose' a 10'4 mol/L 20 mL d'une solution de molybdate d'ammonium' a 10"2 mol/L 10 mL d'une solution d'acide sulfurique' a 4,5 mol/L ' et l'on complète' a 100 mL avecïde l' eau distillée. _ , ' ' ' "' ' " ' ' On verse 5 mL de la solution obtenue dans 5 tubes à \ essais parfaitement propres . ' et secs , On porte cette ' solution pratiquement instantanément " à 100°C, puis aux dates de 10 min, 20 min, 45 ,min, .1 20 min, on plonge un tube dans un bain d'eau glacée, puis ' on mesure -l'absorbance de la solution obtenue ...-----' On tracé alors Ln(y)=f(t), où [M0 (V)]. tr.--[MO (V)]. ,. : 1Mo(V')1. Question 32. Quelle est l'influence de la température sur la vitesse d'une réaction '? Pourquoi refroidit-on brutalement le milieu réactionnel avant d'effectuer la mesure '? Question 33. Que penser de l'hypothèse faite sur l'ordre partiel de la réaction par rapport au fructose ? Question 34. Calculer la constante apparente de vitesse kp', préciser son unité. On fabrique trois solutions contenant un mélange de fructose et glucose de fraction molaire en fructose m = 0,1 ; 0,5 ; 0,9, et de concentration totale en sucre 10'4mol/L. [M0 (V)]. --[M0(V)lt Question 35. On pose alors comme précédemment : y = , montrer alors que - [M0 (V)]... y varie linéairement en fonction de la fraction molaire initiale de fructose dans le , [F ]o ' melange xF0 = ---- [F ]0 + [G]o Question 36. En déduire qu'il est possible de déterminer kp' et kg' en mesurant y à un instant donné 1 pour différentes valeurs du rapport ng_ On obtient expérimentalement en prenant t = 45 min : kG'= 3,6.10'3 min"1 Question 37. Que cbnstate-t-on '? Cela est mis à profit pour réaliser un dosage différentiel du fructose et glucose dans le sang. Troisième problème : Synthèse de la (S)-fenfluramine La fenfluramine est une molécule active utilisée lors de traitement contre l'obésité car elle empêche CF3 HNEt Et : 02H55 (1) la digeStion des sucres. Mais seul le stéréoisomère (l) possède ces propriétés. Nous allons étudier une possibilité de synthèse de cette molécule. _ 1. Etude de la molécule de fenfluramine : Question 38. L'atome' d'azote peut--il être un centre de chiralité ? Cette molécule est--elle chirale ? Préciser la configuration absolue du ou des centres chiraux. Question 39. La (S) fenfluramine est dextrogyre, expliquer brièvement ce que cela signifie. Existe- t-il une relation entre ce renseignement et le fait que le descripteur stéréochimique du centre d'asymétrie soit S '? Si nous envisageons une synthèse non stéréosélective, nous obtenons un mélange racémique de (S) fenfluramine et de (R) fenfluramine. @ OH Nous avons à notre disposition un stéréoisomère de l'acide lactique 'HO' ÊLH ainsi que des solutions concentrées d'acide chlorhydrique et de soude. 3 Question 40. Donner la configuration absolue du carbone asymétrique de la molécule d'acide lactique. Question 41. Lorsque l'on fait réagir l'acide lactique sur la fenfluramine quelle réaction observe--t-- on '? En déduire une méthode expérimentale pour séparer du mélange racémique la (S) fenfluramine. Question 42. Qui le premier a réalisé la première séparation des énantiomères d'un mélange racémique '? 2. Synthèse de la fenfluramine : On réalise la séquence de réactions suivantes : CF3 Solvant anhydre --------------> A Br Mg 0 Solvant anhydre h drol se en milieu acide zx . A __, s --y_--y----------> _9_ CF3 C chauffage en milieu acide D HBr ----------------------> _ ------------> ---- en l'absence de peroxydes . /\ Bf TSC] NH2 C ' ) E _____> fenfluramine O TSC] est le chlorure de Toser : --@%--Cl 0 Question 43. Justifier le type de solvant choisi pour la formatiOn de _A_ . Donner un exemple. Citer les précautions à prendre lors de cette synthèse. Question 44. Rappeler le mécanisme de l'addition de HBr sur l'exemple du propène, en l'absence de peroxyde, justifier en particulier la régiosélectivité de la réaction. . Question 45. Le passage de _Ç_ à I_)_ se fait par un chauffage à reflux. Faire un schéma légendé du montage expérimental utilisé. Quel est l'intérêt d'un chauffage à reflux '? ' Question 46. La molécule d'époxypropane est-elle chirale ? Donner la configuration absolue de son (ses) centre(s) de chiralité. _ Question 47. Donner le mécanisme de l'action de A_ sur l'epoxypropane. Justifier la régiosélectivité de cette réaction, préciser la stéréochimie du produit Ç_.. Question 48. Représenter les formules topologiques de l_3_, Q, D_, E. Pour étudier la dernière étape de la synthèse de la fenfluramine, on étudie la cinétique de la réaction suivante: OT3 éthanol )\ + H2N/\ ""'--> _G_ .E Question 49. Quelle propriété de l'éthylamine met-on en jeu lors de cette réaction ? Déterminer Q. ' Question 50. On constate expérimentalement que la vitesse de cette réaction possède un ordre 1 par rapport à l'éthylamine et un ordre 1 par rapport à E . Pr0poser un mécanisme pour cette réaction. ' Question 51. La fenfluramine obtenue se présente-t--elle sous la forme d'un mélange racémique '? FIN DU SUJET