Mines Physique et Chimie PCSI 2007
| Thème de l'épreuve | Diverses approches de la température. Étude de l'eau de mer et d'un composant des crèmes solaires. |
| Principaux outils utilisés | mécanique, thermodynamique, optique, électrocinétique, atomistique, solutions aqueuses, oxydoréduction, chimie organique, thermochimie |
| Mots clefs | température, troposhère, résistance de platine, cycle de Sabathé, évaporation de l'atmosphère, énergie réticulaire, dosage, organomagnésiens, conductimétrie, addition radicalaire |
Corrigé
:- - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - -
Énoncé complet
(télécharger le PDF)














Énoncé obtenu par reconnaissance optique des caractères
CONCOURS COMMUN 2007
DES ÉCOLES DES MINES D'ALBI, ALÈS, DOUAI, NANTES
Épreuve Spécifique de Physique et Chimie
(filière PCSI option PC)
Vendredi 11 mai 2007 de 08h00 à 12h00
Barème indicatif : Chimie 1/2 - Physique 1/2
Instructions générales :
Les candidats doivent vérifier que le sujet comprend : 16 pages numérotées
l/l6, 2/l6, ...l6/ 16.
Les candidats sont invités à porter une attention particulière à la rédaction :
les copies illisibles ou mal
présentées seront pénalisées.
Les candidats colleront sur leur première feuille de composition l'étiquette à
code à barres
correspondant à l'épreuve spécifique.
L'emploi d'une calculatrice est autorisé
La dernière page est à découper et à rendre avec la copie (annexe correspondant
à la partie Physique).
Ne pas oublier d'y indiquer votre code candidat.
SUJET DE PHYSIQUE
Malgré un thème commun : la température, les six parties de ce sujet sont
totalement indépendantes.
Données :
constante de Boltzmann kB =l,38.10_21"J.1{_1
masse de la Terre M = 6.1024 kg
masse atomique molaire de l'azote M N = 14 g.mol _1
masse atomique molaire de l'oxygène M O = 16 g.mol _1
rayon de la Terre RT = 6400 km
constante de gravitation kG = 66721011 N .m_2 .kg_1
capacité thermique massique du platine (: = 133 J.kg".K"1
indice de réfraction du verre n = l, 5
verre
indice de réfraction de l'air nair = l, 0
CONCOURS COMMUN SUP 2007 DES ÉCOLES DES MINES D'ALBI, ALÈS, DOUAI, NANTES
Epreuve Spécifique de Physique et Chimie (filière PCSI - Option PC) Page 1/ 16
A- Première partie : Aspect cinétique de la température.
Q]. Définir la température cinétique.
. . , . * % T ,
Q2. On rappelle que la v1tesse quadrat1que moyenne d une part1cule est u = nî ,
ou kB
représente la constante de Boltzmann, m la masse de la particule et T la
température. Calculer
les vitesses quadratiques des molécules de dioxygène et de diazote à une
température de 20 °C.
L'atmosphère terrestre étant principalement constituée de dioxygène et de
diazote, nous allons dans la
partie suivante rechercher la vitesse de libération, c'est-à-dire la vitesse
nécessaire pour qu'une
molécule s'échappe de l'atmosphère terrestre, pour la comparer à la vitesse
quadratique moyenne. Le
modèle utilisé est celui d'un problème à deux corps : la Terre de masse M de
centre O et une molécule
de masse m de position P. L'interaction gravitationnelle est la seule prise en
compte. L'étude sera
conduite dans le référentiel géocentrique muni d'une base orthonormée polaire
(u,, ua) .
Figure 1
Q3. Que peut-on dire de la masse réduite du mobile fictif associé à ce système
à deux
corps (Terre, molécule) ? Est-ce légitime de supposer le centre de la Terre
(supposée sphérique)
confondu avec le barycentre du système ? On considérera, dans la suite, la
Terre immobile et la
particule soumise uniquement au champ gravitationnel terrestre.
Q4. En appliquant le théorème de Gauss, déterminer l'expression du champ
gravitationnel @ à
l'extérieur de la Terre à une distance r (r > RT) avec ; = fi ; on exprimera @
en fonction de
r, kG (constante de gravitation), M et 1î .
QS. Exprimer la force qui s'exerce sur la particule de masse m et en déduire
l'énergie potentielle
associée à une constante près. Donner une valeur à cette constante en
justifiant votre choix.
Q6. A partir de quelle valeur de l'énergie mécanique la particule est-elle << libre >> ? En déduire
l'expression de la vitesse de libération en fonction de r, kG et M. Evaluer
cette valeur à la
surface de la Terre.
Q7. Comparer la vitesse de libération de la question précédente aux vitesses
quadratiques du
dioxygène et du diazote (question 2). Conclure.
CONCOURS COMMUN SUP 2007 DES ECOLES DES MINES D'ALBI, ALES, DOUAI, NANTES
Epreuve Spécifique de Physique et Chimie (filière PCSI - Option PC) Page 2/16
B- Deuxième partie : Température et pression dans la troposphère.
Pour la troposphère, située entre les altitudes 0 et 11 km au-dessus de la
Terre, la température est une
fonction affine de l'altitude, soit la relation suivante :
T (2) = az + 19
avec 2 l'altitude en kilomètres, T la température en kelvin, a et b des
constantes.
Q8. Sachant qu'au niveau du sol la température est de 15°C et de --50°C à une
altitude de
10 km , déterminer les coefficients a et b en précisant leur unité.
Q9. En assimilant l'air à un gaz parfait de masse volumique ,u(z) et de masse
molaireM
air '
exprimer la masse volumique en fonction de M R (constante des gaz parfaits),z ,
a , b et
air '
P(z) (pression à l'altitude z ).
Q10. En supposant le fluide en équilibre, appliquer le principe de la statique
des fluides puis
déterminer la pression en un point de la troposphère en fonction de z , a , b ,
MW , R , g
l'accélération de la pesanteur et de P(0) la pression au niveau du sol.
Pourquoi g peut-elle être
considérée comme constante ?
C- Troisième partie : Chaîne électronique de mesure de la température.
On construit une chaîne électronique avec trois amplificateurs opérationnels
(figure 2). La tension v(«9)
est fournie par un capteur de température qui ne peut délivrer de courant
électrique. Cette tension est
seulement fonction de la température 9 et elle est donnée avec précision par :
v(<9) = VO -- 61.9 avec vo = 0,7 V eta = 2 mV."C_1 , les résistances ont pour valeurs R; = 2 k!) et R, = 1 k[2. AOl HT.--"'?! Figure 2 QI]. Les trois amplificateurs sont supposés parfaits et fonctionnent en régime linéaire : rappeler les caractéristiques de tels amplificateurs. Q12. Quelle relation y a-t-il entre u1 et v? Quel est le rôle de ce premier étage (A01) ? ÇONCOURS COMMUN SUP 2007 DES ECOLES DES MINES D'ALBI, ALES, DOUAI, NANTES Epreuve Spécifique de Physique et Chimie (filière PCSI - Option PC) Page 3/16 Q13. Exprimer u, en fonction de u1 et vo, puis en déduire u, en fonction de la température 9 . Q14. Exprimer % en fonction de u,. En déduire la relation entre % et la température 9. Q15. Quel est l'intérêt d'utiliser un millivoltmètre pour mesurer la tension de sortie du montage (us) ? D- Quatrième partie : Température et résistance de platine. Les capteurs << résistance de platine Pt100 >> sont très utilisés pour mesurer
les températures d'un milieu
liquide. Le principe repose sur une relation quasi affine (dans un certain
domaine de température) entre
la résistance R et la température 9 : R(T ) = R0 (1+ 059) .
Différentes mesures de R en fonction de T sont consignées dans le tableau
suivant :
R(Q) 101 103 110 122 129
9(°C) 273 283 303 323 343
Q16. Justifier, par ses propriétés physicochimiques, l'utilisation du platine.
Q17 . Représenter la courbe R = f (19) sur la feuille de papier millimétré
ci-jointe.
Q18. En déduire les valeurs de R0 et du coefficient de température a .
Q19. Au moment de l'immersion de la résistance à la température T0 dans un
liquide à la
température î], l'équilibre thermodynamique n'est pas réalisé On se propose
d'étudier la
variation de T en fonction du temps. En notant (: la capacité thermique
massique du platine,
exprimer le transfert thermique reçu 5QÏ par le platine pour une variation
infinitésimale de la
température d T .
Q20. Les pertes thermiques du capteur, pendant une durée dt , sont
caractérisées par un transfert
thermique 5Qp = ,6' (T --î})dt . Etablir l'équation différentielle entre T et
[, puis la résoudre.
Q21. On obtient la courbe suivante :
T = f(t)
360
350
340
330
320
310
300
290
280
270
TenK
0 10 20 30 40 50 60 70 80
tens
Figure 3
CONCOURS COMMUN SUP 2007 DES ECOLES DES MINES D'ALBI, ALES, DOUAI, NANTES
Épreuve Spécifique de Physique et Chimie (filière PCSI - Option PC) Page 4/16
En déduire les valeurs de T0 , Y} et définir une constante de temps ? ,
l'évaluer et en déduire la
valeur de ,B .
E- Cinquième partie : Température et un peu d'optique.
On considère un thermomètre à colonne de mercure, l'enveloppe est un cylindre
en verre de rayon
extérieur R et de rayon intérieur r (figure 4).
Mercure
Verre
Figure 4
, . . r . .
Q22. Montrer qu'a part1r d'une certame valeur de E , un observateur volt le
mercure comme s'1l
remplissait entièrement un cylindre de rayon R , c'est-à-dire que l'épaisseur
du verre n'est plus
visible. On pourra utiliser les points 0, M et H .
Pour mesurer à distance la température T S d'une source, on utilise un
pyromètre optique à disparition
de filament (gamme de mesure : 700 -- 5000 °C). Le principe consiste à comparer
l'exitance de l'image
de la source avec l'exitance d'un filament préalablement étalonné, la mesure de
l'intensité du courant
électrique traversant le filament permet d'accéder à la température
L'exitance est la puissance totale émise par rayonnement par unité de surface.
Si le filament apparait en
plus clair ou en plus sombre que l'image de la source, sa température est
supérieure ou inférieure à T S.
Lorsque le filament disparaît, les températures sont identiques.
CONCOURS COMMUN SUP 2007 DES ECOLES DES MINES D'ALBI, ALES, DOUAI, NANTES
Épreuve Spécifique de Physique et Chimie (filière PCSI - Option PC) Page 5/16
Objectif (L) Oculaire (L')
' î
Filament
° A °" &
OEil
Source S
V V
: Figure 5
Q23. Proposer une unité pour l'exitance.
Q24. Sachant que la distance focale de l'objectif (L) est f ' = 10 cm et que le
filament se trouve à
une distance d =15 cm de l'objectif, déterminer la position de la source en
calculant
D = SO (figure 5).
Q25. L'oculaire (L') a une vergence v = 55 : à quelle distance 00' faut-il
placer cette lentille
pour observer l'image de la source et le filament confortablement ?
F- Sixième partie : Températures et machine thermique.
L'ingénieur allemand Rudolf Diesel (1858-1913) inventa un moteur à combustion
interne par auto-
allumage en 1893. Le cycle thermodynamique associé à ce moteur est représenté
figure 6 en
coordonnées de Watt P = f(V) :
PA
Figure 6
CONCOURS COMMUN SUP 2007 DES ECOLES DES MINES D'ALBI, ALES, DOUAI, NANTES
Épreuve Spécifique de Physique et Chimie (filière PCSI - Option PC) Page 6/16
Les moteurs Diesel actuels fonctionnent suivant un cycle théorique modifié
appelé cycle de Sabathé : il
diffère du précédent par une combustion en deux étapes. Il est constitué des
transformations
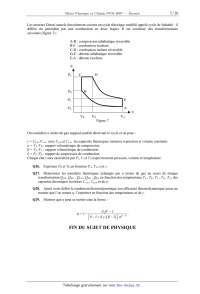
suivantes (figure 7) :
A-B : compression adiabatique réversible
B-C : combustion isochore
C-D : combustion isobare réversible
D-E : détente adiabatique réversible
E-A : détente isochore
P
A
PC C D
PB B
PA ------- A
? >v
VB VD VA
Figure 7
On considère n moles de gaz supposé parfait décrivant le cycle et on pose :
y = C,... /C... avec CP,," et C... les capacités thermiques molaires à pression
et volume constants
oc = VA /VB : rapport volumétrique de compression
,8 = VD /VC : rapport volumétrique de combustion
5 = Pc/PB : rapport de surpression de combustion
Chaque état i sera caractérisé par P,, V,-- et T,-- respectivement pression,
volume et température
Q26. Exprimer PB et T B en fonction PA, T A, a et y.
Q27. Déterminer les transferts thermiques échangés par n moles de gaz au cours
de chaque
transformation QAB , QBC , QCD , QDE , QEA en fonction des températures T A , T
3, T C, T D, T E , des
capacités thermiques molaires C... , C,... et de n.
Q28. Après avoir défini le rendement thermodynamique (ou efficacité
thermodynamique) pour un
moteur que l'on notera 17, l'exprimer en fonction des températures et de y.
Q29. Montrer que 17 peut se mettre sous la forme :
«îflï--1
[5--1+5y(fl--1[bflf"'
n=1--
FIN DU SUJET DE PHYSIQUE
CONCOURS COMMUN SUP 2007 DES ECOLES DES MINES D'ALBI, ALES, DOUAI, NANTES
Épreuve Spécifique de Physique et Chimie (filière PCSI - Option PC) Page 7/16
SUJET DE CHIMIE
La chimie et l'été au bord de mer
Les différentes parties de ce problème sont largement indépendantes et dans
chaque partie, de
nombreuses questions sont indépendantes. Les données numériques nécessaires a
sa résolution sont
rassemblées en fin de problème.
1. L'eau de mer
L'eau de mer est une solution saline complexe dont nous allons étudier
certaines caractéristiques.
1.1. Étude structurale du solvant
Q1.
Q2.
Q3.
Q4.
Q5.
Donner la configuration électronique, dans l'état fondamental, des atomes de la
molécule d'eau.
En déduire la représentation de Lewis de la molécule d'eau.
Déduire, à partir de la théorie V.S.E.P.R. (théorie de Gillespie), la géométrie
de l'arrangement
des doublets électroniques dans la molécule d'eau et la géométrie de cette
dernière.
Justifier la valeur numérique de l'angle a entre les liaisons O--H.
Le module du moment dipolaire permanent de la molécule d'eau vaut 1,85 D.
Déterminer le
moment dipolaire (sens et norme) des liaisons O--H en debye et en C.m.
Calculer le pourcentage d'ionicité des liaisons O--H. Conclure.
1.2. Étude de la conductivité de l'eau pure.
Q6.
Q7.
Q8.
Q8.a.
Q8.b.
L'eau pure est le siège d'une réaction d'autoprotolyse. Écrire l'équation de
cette réaction.
Calculer à 25°C la conductivité théorique de l'eau pure.
Au laboratoire, la mesure de la conductivité de l'eau distillée à 25°C, donne
150 uS.m'l.
Commenter cette valeur.
On cherche, désormais, à déterminer la valeur du pKe de l'eau pure, supposée
inconnue. On
construit pour cela deux piles :
Pile 1: Pt | Hz(gaz) HË...> + CY...) | AgCl(s) Age)
La pression en dihydrogène est de 1 bar et la concentration en acide
chlorhydrique vaut
C= 10"3 mol.L'l.
Pt
Pile 2 : Age) AgCl(s) (K+(aq) + 0H'eq)) + (K+(aq) + Cl}....) | H2(gaz)
La pression en dihydrogène est de 1 bar, les concentrations en hydroxyde de
potassium et en
chlorure de potassium valent C = 10"3 mol.L'l.
Le chlorure d'argent est très peu soluble dans la solution avec laquelle il est
en contact.
Quelles sont les demi-équations rédox envisageables à chacune des électrodes de
la pile ] ?
Donner l'expression du potentiel de chaque électrode en fonction de C et de
constantes
thermodynamiques connues.
Indiquer le pôle positif de la pile ] et donner l'expression de la force
électromotrice (f.e.m.) E 1
de la pile ] en fonction de C et de constantes thermodynamiques connues.
CONCOURS COMMUN SUP 2007 DES ÉCOLES DES MINES D'ALBI, ALES, DOUAI, NANTES
Épreuve Spécifique de Physique et Chimie (filière PCSI - Option PC) Page 8/16
Q8.c. Quelles sont les demi--équations rédox envisageables à chacune des
électrodes de la pile 2 ?
Donner l'expression du potentiel de chaque électrode en fonction de C, de
constantes
thermodynamiques connues et de pK,.
Q8.d. Indiquer le pôle positif de la pile 2 et donner l'expression de la force
électromotrice (fem) E 2
de la pile 2 en fonction de C, de constantes thermodynamiques connues et de pKe.
Q8.c. Les piles sont reliées par leurs électrodes d'argent. La mesure de la
force électromotrice de la
pile double donne E = 0,472 V à 25 0C ; en déduire la valeur du pK, de l'eau à
cette température
et comparer à la valeur connue à 25 °C.
1.3. Les ions de la solution
L'eau de mer contient un grand nombre d'espèces ioniques en solution, parmi
celles--ci: les ions
sodium, magnésium, calcium, potassium, strontium, chlorure, sulfate,
hydrogénocarbonate, carbonate,
bromure, fluorure. ..
Q9. Les énergies de première ionisation EI; des éléments de la période du
chlore sont les suivantes :
Atome Na Mg Al Si P S Cl Ar
EI] / kJ.mol'1 496 738 577 786 1012 1000 1251 1520
Q9.a. Définir l'énergie de première ionisation pour un atome.
Q9.b. Justifier brièvement l'évolution générale de ces valeurs et expliquer les
particularités présentées
par l'aluminium et le soufre.
Q10. Donner la géométrie de l'ion carbonate COÎ, sachant que le carbone est
l'atome central. Que
peut-on dire des longueurs des liaisons carbone--oxygène ? Justifier.
Q11. Lorsqu'une espèce ionique est introduite dans l'eau, elle << s'hydrate >>.
Les ions s'entourent de
molécules d'eau puis se dispersent. Cette dissolution s'accompagne la plupart
du temps, d'un
échange énergétique. Écrire l'équation de réaction traduisant la dissolution du
chlorure de
sodium (pour une mole de NaCl cristallisé). Calculer l'enthalpie standard de
dissolution du
chlorure de sodium à 298 K.
1.4. La salinité de l'eau de mer
La définition de la salinité établie en 1902 est la suivante :
La salinité est la masse en grammes de substances solides contenues dans un
kilogramme d'eau de
mer, les carbonate ayant été transformés en oxyde, les bromure et iodure ayant
été remplacés par leur
équivalent en chlorure, les matières organiques ayant été oxydées.
La salinité 1902, symbole S, était exprimée en g/kg d'eau de mer ou %0. La
détermination directe de la
salinité est une opération trop délicate et trop lente pour pouvoir être
utilisée dans des mesures de
routine. Dans la pratique océanographique, la salinité a été déduite, jusqu'en
1961, de la chlorinité puis
progressivement à partir de cette date, elle a été déduite des mesures de
conductivité électrique.
La chlorinité est la masse en grammes des halogènes contenus dans un kilogramme
d'eau de mer, les
ions bromure et iodure étant remplacés par leur équivalent en ions chlorure.
CONCOURS COMMUN SUP 2007 DES ECOLES DES MINES D'ALBI, ALES, DOUAI, NANTES
Epreuve Spécifique de Physique et Chimie (filière PCSI - Option PC)
Page 9/16
Actuellement, on utilise la relation suivante entre salinité (symbole S) et
chlorinité (symbole Cl) :
S %o = 0,030 + 1,8050 . Cl %0
On détermine la chlorinité de l'eau de mer par la méthode de Mohr.
Le titrage des ions chlorure se fait par précipitation avec les ions argent (I)
en présence d'ions
chromate. L'équivalence est repérée par l'apparition d'un précipité rouge
brique de chromate d'argent.
Tous les ions halogénure présents dans l'eau de mer réagissent de la même
façon. On mesure bien par
cette méthode la chlorinité. L'étude sera faite en ne considérant que l'ion
chlorure.
Manipulation :
On dispose de 100 mL d'eau de mer (solution S0) de concentration CO en ions
chlorure. Compte tenu de
la forte teneur en ions chlorure dans l'eau de mer, cette solution est diluée
dix fois, on obtient la
solution S ;. On appellera C 1 la concentration en ions chlorure dans cette
solution.
On prélève V1 = 5,0 mL de la solution S ;, on les place dans un bécher et on y
ajoute 0,50 mL de
solution de chromate de potassium de concentration C = 0,050 mol.L'l. On
appelle S2, la solution ainsi
obtenue d'un volume de 5,5 mL.
On ajoute alors, à la burette, une solution de nitrate d'argent de
concentration CAg = 0,025 mol.L'l. Le
précipité rouge brique de chromate d'argent apparait pour un volume versé VAgE
= 11,0 mL de nitrate
d'argent.
Q12. Écrire l'équation de la réaction de titrage; écrire l'équation de la
réaction se produisant à
l'équivalence et permettant de repérer l'équivalence.
Q13. Quelle est la concentration des ions chlorure dans la solution S] ? dans
la solution SO ? En
déduire la chlorinité puis la salinité de l'échantillon d'eau de mer (on
considérera pour
simplifier que l'eau de mer a une densité de 1,00).
Q14. Montrer que le précipité de chlorure d'argent apparaît dès l'ajout de la
première goutte de la
solution de nitrate d'argent dans le bécher. On peut considérer que le volume
d'une goutte est
égal à Vg,æ = 5,0.10'2 mL.
Q15. Tracer un diagramme d'existence, en pAg, pour les deux précipités AgCl et
Ag2CrO4 dans les
5,5 mL de solution S2, en considérant qu'il n'y a pas de variation de volume de
la solution
quand on ajoute la solution d'ions argent.
Q16. Déterminer la concentration en ions argent (1) dans le bécher lorsque le
précipité rouge brique
apparaît; en déduire celle des ions chlorure à cet instant. Le dosage est-il
quantitatif ? (une
réponse justifiée est attendue).
Q17. Pourquoi ce dosage ne peut-il être effectué en milieu acide ou en milieu
basique ?
2. La peau et le soleil
Le rayonnement solaire est souvent synonyme de santé (il est indispensable àla
synthèse de la vitamine
D essentielle pour la croissance) mais son caractère nocif est aussi reconnu et
on prend progressivement
conscience de la nécessité de s'en protéger.
On sait depuis longtemps que le rayonnement solaire brûle la peau, on sait
maintenant que le
rayonnement UV est responsable du vieillissement prématuré et des cancers de la
peau.
Les produits solaires agissent préventivement : ils contiennent des filtres ou
des écrans protecteurs.
Le rayonnement solaire comprend :
o le rayonnement infrarouge, responsable de l'échauffement cutané,
CONCOURS COMMUN SUP 2007 DES ECOLES DES MINES D'ALBI, ALES, DOUAI, NANTES
Épreuve Spécifique de Physique et Chimie (filière PCSI - Option PC) Page 10/16
o le rayonnement visible,
. le rayonnement ultraviolet.
Le rayonnement UV se décompose en UV A (315-380 nm), UV B (280-315 nm) et UV C
(IO-280 nm).
Les UV C sont arrêtés par la couche d'ozone (là où elle existe).
Les UV B permettent le bronzage (fabrication de la mélanine) et sont aussi
responsables des coups de
soleil et de certains cancers de la peau : les mélanomes.
Les UV A pénètrent beaucoup plus profondément dans la peau, ils participent à
la formation de
peroxydes et de radicaux libres qui accélèrent le vieillissement de la peau et
favorisent l'apparition de
cancers cutanés (en particulier les carcinomes).
2.1. Les filtres et les écrans solaires
Les filtres minéraux (écrans inorganiques) sont constitués d'oxyde de zinc ou
d'oxyde de titane sous
forme de particules ; ils sont stables et ne provoquent pas d'allergie.
Leur fonction principale est d'absorber et de diffuser les rayons UV. On
utilise des particules de petite
taille: 40 à 50 nm (nanoparticules) car elles ne diffusent que le bleu (les
particules plus grosses
diffusent aussi les autres longueurs d'onde du visible, ce qui donne un aspect
blanc).
Q18. Sachant que la transition entre les niveaux d'énergie correspond à environ
3,3 eV, déterminer la
valeur correspondante de la longueur d'onde absorbée par un écran d'oxyde de
zinc et préciser
le domaine de la longueur d'onde calculée.
Les filtres organiques sont des substances dont l'action photoprotectrice est
due à leur capacité à
absorber une partie du rayonnement UV.
L'acide 4-aminobenzoïque (ou acide paraaminobenzoïque) est nommé PABA dans la
nomenclature
internationale des constituants cosmétiques. Il absorbe à 296 nm. Il existe une
grande famille des
dérivés du PABA qui présentent un spectre étroit d'absorption aux environs de
300 nm.
Ces filtres organiques dérivés du PABA ne sont pas tous stables (dégradation
dans le temps) et peuvent
aussi provoquer des allergies.
Q19. Titrage acidobasique d'une solution de PABA
L'acide 4-aminobenzoïque est un acide aminé ; il contient un groupe aux
propriétés acides et un groupe
aux propriétés basiques.
O
H2N
OH
On réalise le titrage de VA = 100 mL d'une solution d'acide 4-aminobenzoïque de
concentration CA par
une solution d'hydroxyde de sodium de concentration CB = 1,00.10'1 mol.L'l. Le
dosage est suivi par
pHmétrie. On observe un saut de pH à VBE = 10,3 mL.
Une réflexion sur les phénomènes est demandée en évitant toute dérive
calculatoire.
Q19.a. Indiquer les électrodes nécessaires àla réalisation un titrage
pH-métrique, en précisant le rôle de
chacune.
Q19.b. Donner la formule de l'entité obtenue par la réaction acido-basique
intramoléculaire entre les
deux groupes à propriétés acido-basiques lors de la mise en solution.
Q19.c. Tracer le diagramme de prédominance des espèces en fonction du pH ;
préciser les formules
semi développées de chaque espèce dans son domaine de prédominance.
CONCOURS COMMUN SUP 2007 DES ECOLES DES MINES D'ALBI, ALES, DOUAI, NANTES
Épreuve Spécifique de Physique et Chimie (filière PCSI - Option PC) Page 11/16
Q19.d. Écrire l'équation de la réaction associée à la réaction de la solution
d'acide 4-aminobenzoïque
avec la solution d'hydroxyde de sodium. Calculer la valeur de la constante
d'équilibre
correspondante.
Q19.e. Quelle est la concentration de la solution d'acide 4-aminobenzoïque ?
Q19.f. Quelle est la valeur approchée du pH de la solution àla
demi--équivalence ? Justifier.
2.2. Le vieillissement de la peau.
En vieillissant, la peau se pigmente de façon plus ou moins harmonieuse. Cette
pigmentation est due à
la formation de mélanine dont on essaie de prévenir la formation.
La synthèse de la mélanine se fait à partir d'un acide aminé : la tyrosine ; en
présence d'une enzyme, la
tyrosinase et d'ions cuivre et sous l'influence des UV B, la tyrosine se
transforme en
dihydroxyphénylalanine (DOPA), cette dernière est ensuite oxydée en
DOPAquinone. La
DOPAquinone se cyclise en indole-5,6-quinone. La mélanine est un polymère de
l'indole-5,6-quinone.
Synthèse de la tyrosine
Au laboratoire, on peut synthétiser la tyrosine (A) à partir d'un dérivé du
benzène : (Q). La synthèse de
ce dérivé (Q) est réalisée à partir du benzène, mais elle ne sera pas évoquée
ici.
La suite des réactions est la suivante :
0 O
/ Et2O
_»
N + \Mgl __ +
02N g 02N D
OH
N BH H PO
2 ' " = L» E
chauffage
02N E
peroxydes + CN"
E + HBr --' Q --' Ë
solvant apolaire - Br"
Les réactions suivantes ne seront pas étudiées ici.
0
H20 0 OH
H+
02N !
0 0
P4 OH OH
+ Cl _» _, _, _,
! 2 @ NH2
02N !
HO A
IOE
CONCOURS COMMUN SUP 2007 DES ECOLES DES MINES D'ALBI, ALES, DOUAI, NANTES
Épreuve Spécifique de Physique et Chimie (filière PCSI - Option PC) Page 12/16
Q20. Le descripteur stéréochimique du carbone asymétrique de la tyrosine
naturelle A est S
(sinister). Représenter dans l'espace cette molécule. Justifier.
Q21. Étude de la transformation C --> I_)
Q21.a. La réaction de synthèse de l'iodure de méthylmagnésium s'effectue dans
l'éther anhydre (ou
éthoxyéthane anhydre). Ecrire l'équation de formation de l'organomagnésien.
Pourquoi cette
synthèse doit-elle être faite dans un solvant anhydre ?
Q21.b. Parmi les solvants disponibles dans le laboratoire, on trouve, outre
l'éther, l'éthanol, le
cyclohexane, l'éthylamine (ou éthanamine), l'acide acétique, le
trichlorométhane et le THF.
Dire pour chacun de ces solvants, en justifiant votre réponse, s'il convient ou
non en
remplacement de l'éther pour la synthèse de l'iodure de méthylmagnésium.
Q22. Quel serait le produit obtenu, après hydrolyse acide, en faisant agir
l'iodure de
méthylmagnésium en excès, dans l'éther, sur le chlorure d'acyle 1_3 ? Donner le
schéma
réactionnel.
O
Cl
02N
|Ufi
Q23. La transformation E --> E est une déshydratation.
Q23.a. Proposer un mécanisme pour cette réaction. Préciser la formule semi
développée de E. Quel est
le rôle de l'acide phosphorique ?
Q23.b. Sachant que la réaction de déshydratation est endothermique, tracer le
profil énergétique de la
réaction.
Q24. Réaction 13 --> (_1.
Q24.a. Proposer un mécanisme pour la réaction 13 --> (_1. Préciser la formule
semi-développée de Q.
Q24.b. Justifier la régiosélectivité observée. Quel serait le produit
majoritaire de la réaction en
l'absence de peroxydes et en milieu polaire ?
Q25. Proposer un mécanisme pour la réaction G --> I_I. Comment se nomme ce type
de réaction ?
FIN DU SUJET DE CHIMIE
DONNEES SUR LA PAGE SUIVANTE
CONCOURS COMMUN SUP 2007 DES ÉCOLES DES MINES D'ALBI, ALÈS, DOUAI, NANTES
Épreuve Spécifique de Physique et Chimie (filière PCSI - Option PC) Page 13/16
Données
Constantes physiques
Constante de Planck : h = 6,62.10'34 J.s
Célérité de la lumière dans le vide : c = 3.108 m.s'1
Charge élémentaire : e = 1,6.10'19 C
Numéros atomiques -- Masse molaire atomique
atome H C O atome Cl
Z 1 6 8 A/ g.mol'1 35,5
Caractéristiques de l'eau
. . 1
Module du moment d1pola1re permanent : p = 1,85 D. 1D=5.1029C.m
Angle entre les deux liaisons O--H : a = 105O
Longueur de la liaison O--H : lO_H = 100 pm
Conductivités molaires limites à 298 K
ion H+(aq) HO-(aq)
À°/ S.m2.mol'l 3,5.10'2 2,010"2
Enthalpies standard à 298 K
Enthalpie standard d'hydratation des ions chlorure A...H°(CZQQ = - 381 kJ.mol'1
Enthalpie standard d'hydratation des ions sodium A...H°(NaëQ = - 409 kJ.mol'1
Énergie réticulaire (le signe dépend de la définition choisie) |AmH°(NaCZW))| =
783 kJ.mol'1
Potentiels rédox standard à 298 K
EîI+/H2 = 0,00 V
E;g+/Ag = 0,80 V
RT
Îln(x) = a.log(x) avec a = 0,059 V
Constantes de solubilité à 298 K
AgCl(s) szl = 9,8
Ag2CTO4(S) pK52 = 12,0
AgOH(S) sz3 = 7,7
Constantes d'acidité à 298 K
Produit ionique de l'eau pKe = 14,0
Acide chromique H2CrO4 pKa1 = 0,8 pKa2 = 6,5
Acide 4-aminobenzoïque pKa1 = 2,5 pKaZ = 4,9
CONCOURS COMMUN SUP 2007 DES ECOLES DES MINES D'ALBI, ALES, DOUAI, NANTES
Épreuve Spécifique de Physique et Chimie (filière PCSI - Option PC) Page 14/16
FEUILLE A DETACHER ET A RENDRE AVEC VOTRE COPIE
Code Candidat :
CONCOURS COMMUN SUP 2007 DES ÉCOLES DES MINES D'ALBI, ALÈS, DOUAI, NANTES
Épreuve Spécifique de Physique et Chimie (filière PCSI - Option PC) Page 16/16
Cuneo... Comm SUP" des Escles des Mines
1 - Sujet de PHYSIQUE--£...
Pme 4/16 : Partie D
La résistance Rei. in ...?éühfl: 8 (:x: °C) : R(B) == M1+u8)
Di "'z*---'--r "tes mesures de R en £omfian de la æmpémüm T (en ° K.) sont
Remplacer dæs le æbleau 8(°C) par HB.)
...... . . ....
............._......».........æ...fl............'«.WWWWVAw......,W......... «
...,......fi......
WWW...
WWW"...va