Mines Physique et Chimie toutes filières 2009
| Thème de l'épreuve | Électricité. Mécanique. Thermodynamique. Chimie. |
| Principaux outils utilisés | électricité, mécanique du point, thermodynamique, solutions aqueuses |
| Mots clefs | bobine réelle, frottements solides, moteur, pompe à vide, chlore |
Corrigé
:- - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - -
Énoncé complet
(télécharger le PDF)








Énoncé obtenu par reconnaissance optique des caractères
CONCOURS COMMUN 2009
DES ÉCOLES DES MINES D'ALBI, ALÈS, DOUAI, NANTES
Épreuve de Physique-Chimie
(toutes filières)
Lundi 18 mai 2009 de 8h00 à 12h00
Barème indicatif : Physique environ 2/3 - Chimie environ 1/3
Instructions générales :
Les candidats doivent vérifier que le sujet comprend 12 pages numérotées 1/12,
2/12, 3/12, 4/12...
Les candidats sont invités à porter une attention particulière à la rédaction :
les copies illisibles ou mal
présentées seront pénalisées.
Les candidats colleront sur leur première feuille de composition l'étiquette à
code à barres correspondant à
l'épreuve commune de Physique-Chimie.
Toute application numérique ne comportant pas d'unité ne donnera pas lieu à
attribution de points.
N.B. Les problèmes sont indépendants. Les diverses parties peuvent être
traitées dans l'ordre choisi par le
candidat. Il prendra toutefois soin de bien numéroter les questions. Les
exercices de chimie sont aussi
indépendants.
L'emploi d'une calculatrice est autorisé
Remarque importante :
Si au cours de l'épreuve, un candidat repère ce qui lui semble être une erreur
d'énoncé, il le signalera sur sa
copie et devra poursuivre sa composition en expliquant les raisons des
initiatives qu'il a été amené à
prendre.
CONCOURS COMMUN SUP 2009 DES ÉCOLES DES MINES D'ALBI, ALÈS, DOUAI, NANTES
Épreuve de Physique-Chimie (toutes filières)
Page 1/12
A Electricité
On dispose d'une bobine B que l'on assimilera à l'association série d'une
inductance L et d'une
résistance r. (L et r sont des constantes positives, indépendantes de la
fréquence)
Bobine
i(t)
r
L
u(t)
Figure 1
Détermination de r
1) La bobine est parcourue par un courant i(t). Exprimer la tension u(t) à ses
bornes en fonction de
r, L, i(t) et de sa dérivée par rapport au temps.
2) On réalise le circuit suivant, en plaçant, en série avec la bobine, un
résistor de résistance
R = 40 :. L'alimentation est un générateur de tension continue, constante, de
force
électromotrice E0 = 1,0 V et de résistance interne r0 = 2,0 :.
r
I
L
E0
R
UR
r0
Figure 2
On mesure, en régime permanent, la tension UR aux bornes de R.
Exprimer r en fonction des données de cette question. Calculer r avec UR = 0,56
V.
CONCOURS COMMUN SUP 2009 DES ÉCOLES DES MINES D'ALBI, ALÈS, DOUAI, NANTES
Épreuve de Physique-Chimie (toutes filières)
Page 2/12
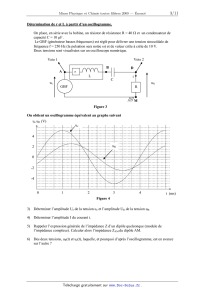
Détermination de r et L à partir d'un oscillogramme.
On place, en série avec la bobine, un résistor de résistance R = 40 : et un
condensateur de
capacité C = 10 µF .
Le GBF (générateur basses fréquences) est réglé pour délivrer une tension
sinusoïdale de
fréquence f = 250 Hz (la pulsation sera notée Z) et de valeur crête à crête de
10 V.
Deux tensions sont visualisées sur un oscilloscope numérique.
Voie 2
Voie 1
B
A
D
r
L
C
ue
GBF
i
uR
R
M
Figure 3
On obtient un oscillogramme équivalent au graphe suivant
ue uR (V)
ue
4
uR
2
0
-2
-4
0
1
2
3
4
t (ms)
t (m
Figure 4
3) Déterminer l'amplitude Ue de la tension ue et l'amplitude UR de la tension
uR.
4) Déterminer l'amplitude I du courant i.
5) Rappeler l'expression générale de l'impédance Z d'un dipôle quelconque
(module de
l'impédance complexe). Calculer alors l'impédance ZAM du dipôle AM.
6) Des deux tensions, uR(t) et ue(t), laquelle, et pourquoi d'après
l'oscillogramme, est en avance
sur l'autre ?
CONCOURS COMMUN SUP 2009 DES ÉCOLES DES MINES D'ALBI, ALÈS, DOUAI, NANTES
Épreuve de Physique-Chimie (toutes filières)
Page 3/12
7) Déterminer précisément, à partir de l'oscillogramme, le déphasage M u e / i
entre ue et i,
(c'est-à-dire entre ue et uR).
8) Ecrire l'expression générale de l'impédance complexe ZAM en fonction de r,
R, L, C, Z.
9) Ecrire l'expression de l'impédance complexe ZAM en fonction de son module
ZAM et du
déphasage M u e / i .
10) Exprimer r en fonction de R, ZAM et M u e / i . Calculer sa valeur.
11) Exprimer L en fonction de C, Z, ZAM et M u e / i . Calculer sa valeur.
Etude de la fonction de transfert.
12) Rappeler la définition de la fonction de transfert H du filtre ainsi formé
avec ue pour tension
d'entrée et uR pour tension de sortie.
13) Proposer un schéma équivalent en basses puis en hautes fréquences et en
déduire la nature
probable du filtre.
14) Exprimer H en fonction de r, R, L, C, Z.
15) Mettre H sous la forme : H =
H max
§Z
1 j ~ Q ~ ¨¨
© Z0
Z0 ·
¸
Z ¸¹
. On exprimera littéralement Hmax, le
paramètre Z0 ainsi que le facteur de qualité Q de ce circuit en fonction de r,
R, L, C.
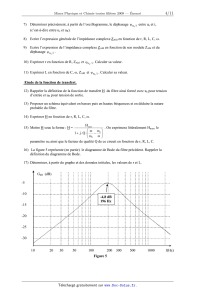
16) La figure 5 représente (en partie) le diagramme de Bode du filtre
précédent. Rappeler la
définition du diagramme de Bode.
17) Déterminer, à partir du graphe et des données initiales, les valeurs de r
et L.
GdB (dB)
-5
-10
-4,8 dB
196 Hz
-15
-20
-25
-30
10
20
30
50
100
200
300
500
1000
f(Hz)
Figure 5
CONCOURS COMMUN SUP 2009 DES ÉCOLES DES MINES D'ALBI, ALÈS, DOUAI, NANTES
Épreuve de Physique-Chimie (toutes filières)
Page 4/12
Facteur de puissance.
On reprend le montage figure 3 avec f = 250 Hz.
18) Rappeler la définition du facteur de puissance d'un circuit.
19) On place alors, en parallèle sur AD une boîte de condensateurs à décades
(figure 6) et l'on fait
varier cette capacité C' jusqu'à ce que, en observant l'oscilloscope, uR et ue
soient en phase.
C'
Voie 2
Voie 1
A
D
B
r
L
i
C
ue
uR
GBF
R
M
Figure 6
Quelle est alors la valeur du facteur de puissance du circuit AM ?
20) Quelle est alors la valeur du facteur de puissance du circuit AD ?
21) Quelle particularité présente alors l'admittance complexe YAD du circuit AD
?
22) Exprimer YAD en fonction de r, L, C, C' et de la pulsation Z.
23) Déterminer C' en fonction de r, L, C, Z. Faire l'application numérique avec
les valeurs de r et
L calculées précédemment.
B Mécanique
Une particule M de masse m peut glisser sur un rail horizontal X' X fixe dans
le référentiel terrestre
R supposé galiléen.
M
M
X'
0
G
uy
X
G
ux
0
Ressort non déformé
X'
0
G
uy
X
G
ux
0
x
Ressort déformé de x
M est fixée à l'extrémité d'un ressort de raideur k dont l'autre extrémité est
fixe dans R.
La position de M est repérée par son abscisse x. x = 0 correspond au ressort
détendu.
CONCOURS COMMUN SUP 2009 DES ÉCOLES DES MINES D'ALBI, ALÈS, DOUAI, NANTES
Épreuve de Physique-Chimie (toutes filières)
Page 5/12
24) Le glissement s'effectue, dans un premier temps, sans frottement.
Représenter, sur un dessin, les forces exercées sur M dans le cas où x > 0,
faire un bilan de ces
forces, puis, par application de la relation fondamentale de la dynamique,
déterminer l'équation
différentielle vérifiée par x(t). (Ne pas la résoudre pour l'instant).
25) Donner l'expression de l'énergie potentielle élastique emmagasinée dans le
ressort en fonction
de k et x.
26) Exprimer l'énergie mécanique du système {masse + ressort} en fonction de m,
k, x et de sa
dérivée x . Est-elle conservée au cours du mouvement ? (justifier)
27) De ce qui précède, déduire à nouveau l'équation différentielle du mouvement
de M.
28) Résoudre l'équation différentielle et obtenir l'équation horaire x(t) du
mouvement de M dans le
G
G
cas où M est lancée à t = 0 de l'abscisse x0 avec la vitesse v 0 x 0 .u x . (en
fonction de
x 0 , x 0 , k , m, t )
G
29) Maintenant, M est soumise, de la part du rail à une force de frottement
(frottement solide) f de
norme constante f quand M est en mouvement et comprise entre 0 et f quand M est
immobile.
Grâce à un schéma des forces quand M est en mouvement, et en précisant le sens
du
mouvement, déterminer l'angle M entre la réaction du support et la verticale en
fonction de m,
g, f.
30) On donne à M l'élongation (l'abscisse) x0, positive ou négative, et on
l'abandonne sans vitesse.
A quelles conditions sur x0, M démarrera-t-elle ? Entre quelles limites de x se
situera donc la
position d'équilibre finale de M ? (Réponse en fonction de f et k).
31) Du fait que les frottements n'ont pas toujours le même sens, montrer que la
force de frottement
G
G
G
dx
dx
> 0 et H = -1 si
< 0. f peut s'écrire: f H.f .u x , où le coefficient H est tel que H = +1 si dt dt Ecrire alors l'équation différentielle en x du mouvement de M (Paramètres : m, k, f, H. Ne pas la résoudre). 32) Pour toute la suite du problème, on prendra x0 positive et très supérieure à la limite de démarrage de M, de telle façon que M effectue plusieurs oscillations. Ecrire puis résoudre l'équation sur l'intervalle {x0, x1} où x1 est l'abscisse de M quand M s'arrête pour la première fois. Quelle est la durée de cette première étape ? Trouver la valeur de x1. 33) Le phénomène se reproduisant de x1 à x2 où M s'arrête à nouveau, etc., le mouvement de M est pseudo périodique. Déterminer la pseudo période T des oscillations. G 34) Exprimer le travail de f sur le parcours {x1, x2} en fonction de f, x1 et x2. Sans rechercher à nouveau l'équation horaire du mouvement de M, déterminer alors grâce à un théorème énergétique, l'élongation x2 quand M s'arrête pour la deuxième fois. (En fonction de x0, f et k) 35) De l'étude qui précède, déduire la nature de la décroissance de l'amplitude du mouvement au cours du temps. Déterminer l'équation xMax(t) de la courbe reliant les maxima de x. CONCOURS COMMUN SUP 2009 DES ÉCOLES DES MINES D'ALBI, ALÈS, DOUAI, NANTES Épreuve de Physique-Chimie (toutes filières) Page 6/12 C Thermodynamique (Les deux exercices sont indépendants) Cycle moteur théorique et peu performant. P0 = 1 bar, m = 10 kg, Données numériques : VB = 1 L, VA = 330 mL, T0 = 300 K, S = 100 cm². g = 10 N.kg-1. J = 1,4. La constante des gaz parfaits est : R = 8,314 J.K-1.mol-1. Les capacités thermiques du gaz seront supposées indépendantes de la température. C pm avec : Cpm et Cvm : capacités thermiques molaires, On rappelle que : R = Cpm-Cvm et J C vm respectivement à pression et à volume constants du gaz. Les différentes transformations seront supposées réversibles On imagine un cylindre aux parois diathermanes (splitéables à la chaleur), fermé par un piston. Le piston, de masse négligeable, peut glisser sans frottement entre 2 cales A et B, sa section est S. Dans l'état initial, le piston est en A, le cylindre renferme un volume VA d'air supposé gaz parfait, de coefficient J, à la température de l'extérieur : T0, pression P0, (gaz dans l'état 0 : P0,VA,T0) P0, T0 P0 B P0 B xxxxxxxxxx P0 V A T0 Etat 0 B A A xxxxxxxxx xxxxxxxxx m xxxxxxxxxx A A P0, T0 m xxxxxxxxxx xxxxxxxxxx B P1 VA T1 P2 VB T2 P3 VB T3 Etat 1 Etat 2 Etat 3 On place une masse m sur le piston et on chauffe très doucement le gaz par un moyen approprié, non représenté sur le schéma, jusqu'à ce que le piston décolle juste de la cale A (gaz dans l'état1 : P1, VA, T1). Puis, on maintient le chauffage jusqu'à ce que le piston arrive juste en B (gaz dans l'état 2 : P2,VB,T2), le chauffage est alors arrêté. On ôte m et on laisse refroidir l'ensemble jusqu'à ce que le piston décolle juste de B (gaz dans l'état 3 : P3, VB, T3). On laisse toujours refroidir jusqu'à la température T0, alors, le piston revient en A (gaz dans l'état 0), le cycle est terminé. 36) Exprimer les capacités thermiques à pression et à volume constants Cp et Cv du gaz en fonction de n (quantité de matière de gaz enfermé), R, J, puis en fonction de P0, VA, T0, J. 37) Quelle est la nature de la transformation de 0 à 1 subie par le gaz ? 38) Exprimer la pression P1 et la température T1 en fonction de P0, T0, m, g, S. Faire l'application numérique. 39) Exprimer la quantité de chaleur (transfert thermique) Q10 reçue par le gaz au cours de cette transformation en fonction de Cv ou Cp, T1, T0 puis P0, T1, T0, VA, J. Faire l'application numérique. 40) Quelle est la nature de la transformation 1 à 2 subie par le gaz ? CONCOURS COMMUN SUP 2009 DES ÉCOLES DES MINES D'ALBI, ALÈS, DOUAI, NANTES Épreuve de Physique-Chimie (toutes filières) Page 7/12 41) Exprimer la température T2 en fonction de T1, VA, VB. Faire l'application numérique. 42) Exprimer la quantité de chaleur (transfert thermique) Q12 reçue par le gaz au cours de cette transformation en fonction de Cv ou Cp, T1, T2 puis P0, T0, T1, T2, VA, J. Faire l'application numérique. 43) Quelles sont les natures des transformations 2 à 3 et 3 à 0 subies par le gaz ? 44) Exprimer le travail W échangé par ce « moteur » avec l'extérieur, au cours du cycle, en fonction de m, g, VA, VB, S. Faire l'application numérique. 45) Exprimer le rendement de ce « moteur » en fonction des différents transferts d'énergie. Faire l'application numérique. 46) Tracer l'allure du diagramme de Clapeyron d'un cycle. 47) Retrouver, d'après le diagramme, le travail W calculé précédemment. 48) Exprimer le rendement d'un moteur fonctionnant selon un cycle de Carnot entre les températures T0 et T2 puis le calculer. Pompe à vide. Le schéma suivant, (figure 7), représente, en coupe, un réservoir R, un cylindre C (leurs parois sont diathermanes, c'est-à-dire splitéables à la chaleur) et un piston P dont la course est limitée par le fond A et la cale B. Quand le piston est en A, le volume du cylindre limité par le piston est VA, quand il est en B : VB. Le système est de plus, muni de deux soupapes : S1 permettant le passage du gaz uniquement de C vers l'extérieur et S2 uniquement de R vers C, et ce, dès que la différence de pression entre les parties inférieure et supérieure de la soupape est positive. Le cylindre est relié, par un tube de volume négligeable devant les autres volumes du système, au réservoir R de volume V0, très supérieur à VB, contenant de l'air, supposé gaz parfait, dans lequel on souhaite «faire le vide ». Extérieur P0, T0 B Tige Réservoir xxxxxxxxxxxxS1xxxx xxxxxxxxxxxxxxxx R Volume V0 P Cylindre C A S2 Robinet Figure 7 CONCOURS COMMUN SUP 2009 DES ÉCOLES DES MINES D'ALBI, ALÈS, DOUAI, NANTES Épreuve de Physique-Chimie (toutes filières) Page 8/12 49) Dans l'état initial, le piston est en B, le cylindre et le réservoir contiennent de l'air à la pression atmosphérique P0 et à la température T0. On pousse le piston jusqu'en A exactement contre le fond (on considère qu'ici VA = 0) et on le ramène en B assez lentement pour que la température reste T0. Expliquer les différents transferts de gaz au cours de cet aller-retour. Montrer que la V0 pression P1 dans R quand le piston revient en B est : P1 P0 V0 VB 50) Si les transferts de gaz s'effectuent encore de la même façon, exprimer littéralement la pression P2 après un deuxième aller-retour du piston. 51) Donner, dans ce cas, la forme générale de Pn après le nième aller-retour. Quelle est la limite de Pn quand n o f ? 52) En réalité, quand le piston est en A, le volume VA entre le piston et le fond n'est pas nul. La limite théorique précédente ne peut pas être atteinte. Pourquoi ? Déterminer la véritable limite théorique de cette pompe à vide. Pourquoi appelle-t-on VA le « volume nuisible »? 53) Quel est, en supposant disposer d'une pompe idéale (VA = 0), le travail théorique minimum nécessaire pour faire le vide parfait dans R ? D Chimie Chlore, Dichlore, Chlorure... Constante des gaz parfaits R = 8,314 J.K-1.mol-1. T0 = 273 K correspond à 0°C Le chlore a pour numéro atomique Z = 17 Masse atomique molaire de H : 1 g.mol-1 Masse atomique molaire de Cl : 35,5 g.mol-1 (g), (l), (s), (aq) après la formule d'une espèce chimique signifient respectivement gazeux, liquide, solide et aqueux. Généralités 54) Que représente le numéro atomique d'un élément chimique ? 55) Quelle est la configuration électronique du chlore dans son état fondamental ? Dans quelle colonne de la classification périodique se situe le chlore ? Comment se nomment les éléments de cette colonne ? 56) Faire les schémas des structures de Lewis les plus probables des molécules de dichlore et de chlorure d'hydrogène (HCl). Donner dans les deux cas les nombres d'oxydation du chlore. 57) Qu'est ce qu'un nucléon ? 58) Rappeler la définition de deux isotopes d'un même élément. 59) Le chlore a une masse atomique molaire moyenne d'environ 35,5 g.mol-1. Il est essentiellement composé des isotopes 35 et 37. La masse molaire d'un nucléon est prise à 1 g.mol-1. Déterminer la proportion molaire de chaque isotope. CONCOURS COMMUN SUP 2009 DES ÉCOLES DES MINES D'ALBI, ALÈS, DOUAI, NANTES Épreuve de Physique-Chimie (toutes filières) Page 9/12 Chlorure d'hydrogène 60) Le chlorure d'hydrogène HCl(g), très soluble dans l'eau est entièrement dissocié en solution aqueuse. Ecrire la réaction de dissolution. Quel nom donne-t-on à cette solution ? 61) Sous la pression de 1 bar à 15°C, on peut dissoudre au maximum 500 L de chlorure d'hydrogène (gaz supposé parfait) dans 1 L d'eau. Cette dissolution se fait avec changement de volume du liquide. On obtient une solution S0 dont la masse volumique est 1,2 kg.dm-3. Quelle est la concentration molaire volumique de la solution d'acide obtenue ? Equilibre chimique en phase gazeuse. Sous la pression P0 = 1 bar maintenue constante, à la température T, à partir d'un mélange de HCl(g) et de O2(g), il se forme Cl2(g) et H2O(g). 62) Ecrire l'équation bilan de la réaction avec 1 pour coefficient (nombre) stoechiométrique de O2. 63) Les réactifs sont pris en quantités stoechiométriques (1 mole de O2). Quel est l'avancement maximum xmax de cette réaction ? 64) A l'équilibre, 75% de HCl a disparu. Déterminer l'avancement xe de la réaction à l'équilibre. 65) Les gaz étant supposés parfaits, déterminer les pressions partielles de chacun des constituants à l'équilibre. 66) Exprimer la constante de cet équilibre K 0P à la température T en fonction des pressions partielles et la calculer. Dosage des ions chlorure Cl-(aq) par précipitation. Dans cet exercice, tous les ions sont sous forme aqueuse. Pour s'assurer que le dosage des ions Cl-(aq) par les ions Ag+(aq) est possible, on réalise au préalable la manipulation suivante. 67) On effectue le dosage de V1 = 100 mL d'une solution S1 placée dans le bécher, de chlorure de sodium (Na+, Cl-) de concentration C1 = 10-2 mol.L-1 par une solution S2 de nitrate d'argent (Ag+, NO3-) placée dans la burette, de concentration C2 = 8.10-2 mol.L-1. Le produit de solubilité du chlorure d'argent AgCl(s) est : K S01 = 10-10. Ecrire la réaction de dosage. Exprimer la constante d'équilibre K S01 en fonction des concentrations. La précipitation débute-t-elle dès la première goutte ? (Une goutte = 0.05 mL). 68) Calculer le volume V2e de la solution de nitrate d'argent versé à l'équivalence. 69) On a ajouté dans le bécher, en guise d'indicateur coloré, V3 = 2 mL d'une solution de chromate de potassium K2CrO4, (2 K+, CrO42-) de concentration C3 = 1 mol.L-1, susceptible de donner le précipité Ag2CrO4(s), de couleur rouge, dont le produit de solubilité est K S0 2 =10-11,8. Ecrire la réaction de précipitation de Ag2CrO4(s). Exprimer la constante d'équilibre K S0 2 en fonction des concentrations. Montrer que AgCl(s) précipite avant Ag2CrO4(s). CONCOURS COMMUN SUP 2009 DES ÉCOLES DES MINES D'ALBI, ALÈS, DOUAI, NANTES Épreuve de Physique-Chimie (toutes filières) Page 10/12 70) Quelle est la concentration en ions Cl- dans le bécher quand Ag2CrO4(s) commence à précipiter. (On considérera que le volume est très voisin de celui à l'équivalence). 71) Le titrage précédent est maintenant réalisé par conductimétrie. Quelle est la grandeur physique mesurée ? Rappeler les différentes façons d'obtenir des courbes formées de segments de droites. 72) On donne les conductivités molaires limites ioniques suivantes (en mS.m2.mol-1) : O°(Cl-) = 7,6 O°(Ag+) = 6,2 O°(NO3-) = 7,1 O°(Na+) = 5,0. Exprimer la conductivité d'une solution ionique en fonction des concentrations et des conductivités molaires ioniques des ions. Expliquer de façon simple comment varie la conductivité de la solution contenue dans le bécher au cours du titrage et tracer l'allure de la courbe du titrage conductimétrique précédent. Cinétique Soit la réaction d'hydrolyse, en solution aqueuse, d'un chlorure d'alkyle noté RCl RCl + H2O o ROH + H+(aq) + Cl-(aq) Un bécher contient V0 = 250 mL d'eau et un indicateur coloré jaune en milieu acide et bleu en milieu basique. Au dessus, se trouve une burette contenant une solution aqueuse d'hydroxyde de sodium (ou soude Na+(aq), HO-(aq) ) concentrée. On considérera dans ce problème que le volume dans le bécher reste V0. A l'instant t = 0 min, on verse dans le bécher n = 5.10-4 mol de soude et une quantité de RCl, qui amène sa concentration initiale dans le bécher à une valeur « a » telle que a = 1,1.10-2 mol.L-1. On notera x la concentration en ROH à l'instant t. A l'instant t1, la couleur jaune apparaît. On note t1 et on verse à nouveau n = 5.10-4 mol de soude dans le bécher. La couleur jaune réapparaît à l'instant noté t2. On répète encore 3 fois l'opération et on note t3, t4 et t5. 73) Expliquer ces changements de couleur. 74) La cinétique de cette réaction étant d'ordre 1 par rapport à RCl, exprimer la loi de vitesse, en déduire une équation différentielle en x, l'intégrer et exprimer la concentration x en fonction de a, de t et de la constante de vitesse k. 75) Quelle fonction f(x) doit-on tracer pour différentes valeurs de t si l'on veut obtenir une droite de pente +k ? 76) Le tableau ci-dessous donne les différentes valeurs des ti. Reproduire et compléter ce tableau. ti en min xi f(xi) t0 = 0 min t1 = 2,5 min t2 = 6 min t3 = 10 min t4 = 16,5 min t5 = 30 min 77) Placer les couples de points (f(xi), ti ) sur un graphe (tracé sur la feuille). Leur alignement est-il satisfaisant ? Déduire la valeur de la constante de vitesse k en précisant bien son unité. Y W FIN X Z CONCOURS COMMUN SUP 2009 DES ÉCOLES DES MINES D'ALBI, ALÈS, DOUAI, NANTES Épreuve de Physique-Chimie (toutes filières) Page 11/12